Умовна делеція феритину Н у мишей спричиняє втрату запасу заліза та пошкодження печінки †
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ці автори не менш сприяли цій роботі.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ці автори не менш сприяли цій роботі.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Трансгенна мишача установа, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL) ISREC - Швейцарський інститут експериментальних досліджень раку, SV2516 - Bâtiment SV, станція 19, CH ‐ 1015 Лозанна, Швейцарія === Шукати інші статті цього автора
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ці автори не менш сприяли цій роботі.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ці автори не менш сприяли цій роботі.
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Трансгенна мишача установа, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL), ISREC - Швейцарський інститут експериментальних досліджень раку, Лозанна, Швейцарія
Ecole Polytechnique Fédérale de Lausanne (EPFL) ISREC - Швейцарський інститут експериментальних досліджень раку, SV2516 - Bâtiment SV, станція 19, CH ‐ 1015 Лозанна, Швейцарія === Шукати інші статті цього автора
Потенційний конфлікт інтересів: нічого не повідомляти.
Анотація
Білкові оболонки 24 феритинових субодиниць H та L можуть накопичувати до 4500 атомів заліза у вигляді Fe 3+ у всіх тканинах, але найбільш помітно в гепатоцитах та ретикулоендотеліальних клітинах печінки та селезінки. 1 Субодиниця ферритину Н має ферроксидазну активність, необхідну для осадження заліза. 2, 3 Трансляція обох субодиниць регулюється регулюючими залізом білками 1 та 2 (IRP1 та IRP2) у відповідь на наявність заліза. Таким чином, кількість феритину адаптується до рівня заліза в організмі. Залізо, що зберігається у феритині, може бути мобілізовано до його деградації. 5 Вважається, що функція знешкодження заліза феритину також запобігає опосередкованому залізом каталізу активних форм кисню (АФК), які провокують пошкодження тканин 6 і можуть спричинити рак 7 та нейродегенерацію. 8
Тут ми генерували мишей, що несуть сайти loxP 5 ' Fth генний промотор та 3 ′ екзону 1 для того, щоб видалити експресію ферритину Н у дорослих мишей за допомогою Cre рекомбінази. Ми умовно видалили файл Fth ген у дорослих самців мишей, що використовують Cre під контролем полі-IC-індуцибельного промотору гена Mx. 23 Це майже повністю видаляє феритин Н із печінки, кісткового мозку, селезінки та тимусу, але менш помітно в інших тканинах. Тут ми повідомляємо про вплив на зберігання заліза, токсичність заліза, гематологічні параметри та життєздатність клітин. Ми досліджували наслідки перевантаження залізом до або після делеції феритину Н і виявили швидку загибель клітин у печінці та у ембріональних фібробластів мишей, отриманих від наших мишей. У культивованих клітинах причину смерті можна віднести до АФК, деполяризації мітохондрій та переходу проникності.
Скорочення
АЛТ, аланінамінотрансфераза; AST, аспартатамінотрансфераза; Fth ген, ген феритину H; IRP, білок, що регулює залізо; АФК, активні форми кисню; ТУНЕЛЬ, маркування трансферази dUTP на нижньому кінці.
Матеріали і методи
Всі експериментальні процедури доступні як допоміжні матеріали та методи.
Результати
Умовна делеція феритину Н смертельна для ембріонів.
Для вивчення функції феритину Н у дорослих мишей ми генерували шляхом рекомбінації ембріональних стовбурових клітин мишей із модифікованим алелем ферритину Н, що позначаються як Fth loxNeo . У цьому алелі промотор феритину H та екзон 1 межують з сайтами loxP, які також фланкують касету відбору неоміцину між сайтами FRT (підтримка рис. 1). Щоб перевірити нашу стратегію націлювання на феритин H, ми перейшли Fth loxNeo миші з гемізиготними мишами нестин-Cre1. 24 Промотор нестину демонструє складну схему експресії з активністю в мозку, а також в зародковій лінії. 24 Отже, очікувалося, що повне видалення феритину Н відбудеться в Fth loxNeo/ +;Nes-Cre1 тварини. З 38 мишей F2 17 (44,7%) були Fth +/ + і 21 (55,3%) були Fth +/ -, що підтверджує нестин-Cre-індуковану делецію. Ні Fth -/- народилися миші, що вказує на важливу функцію феритину Н в ембріогенезі. Ці результати найкраще пояснюються делецією зародкової лінії феритину Н у Fth loxNeo/ +;Nes-Cre1 F1 покоління 24 з ембріональною летальністю при Fth ген відсутній у статевих клітинах. 9 Це узгоджується з раніше опублікованими дослідженнями щодо ембріональної летальності делеції феритину у мишей.
Делеція феритину Н у дорослих тварин викликає втрату запасів заліза.
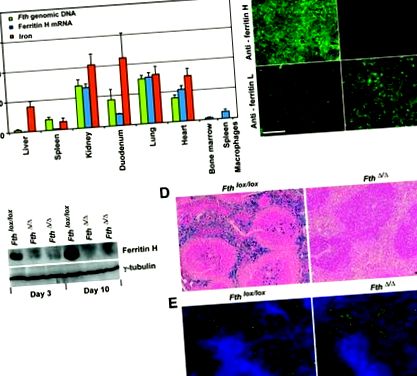
Умовна делеція феритину Н за допомогою Mx-Cre зменшує накопичення заліза в печінці та селезінці. Десяти тижнів Fth локс/локс;Mx-Cre та контролю Fth локс/локс мишам вводили полі-IC для активації експресії Cre. (А) На 10-й день делецію феритину Н оцінювали в різних тканинах методом ПЛР у реальному часі на геномній ДНК (зелений) та комплементарній ДНК феритину Н (кДНК) (синій). Вміст тканинного заліза (червоний) вимірювали методом батофенантроліну. Значення в Fth Миші Δ/Δ (n = 4) виражаються у відсотках від значень у Fth локс/локс мишей (n = 4) встановлено як 100% ± стандартне відхилення (SD). (B) Імунофлуоресцентне фарбування феритину H та L у заморожених зрізах печінки (день 10). Шкала шкали = 200 мкм. (C) Імуноблот-аналіз феритину H печінки в одному Fth локс/локс миша і два Fth Миші Δ/Δ на 3 і 10 день. (D) Заморожені зрізи селезінки, пофарбовані прусським синім кольором Перла на 30 день. Шкала шкали = 200 мкм. (E) Заморожені зрізи селезінки, забарвлені для макрофагів антитілами до CD11b та анти-F4/80, а також 4 ', 6-діамідино-2-феніліндол (DAPI). Шкала шкали = 100 мкм.
Феритин не потрібний для синтезу гемоглобіну.
Більша частина заліза рециркулюється з гемоглобіну застарілих еритроцитів ретикулоендотеліальними клітинами і згодом перетворюється на свіжий гемоглобін у клітинах-попередниках еритроїдів. Тому було цікаво спостерігати, чи індукована Mx-Cre-делецією феритину Н (рис. 1А) змінить рівень гемоглобіну та гематокриту. Fth Миші Δ/Δ не показали значної різниці порівняно з Fth локс/локс мишей (підтримуюча таблиця 1), і вони вижили протягом 2 років без помітного недоліку, тоді як обсяг видалених клітин залишався незмінним. Це свідчить про те, що феритин Н не є важливим для переробки заліза макрофагами та гемо-біосинтезом еритроїдів. Далі ми перевірили, чи виявляли миші без феритину Н у печінці та селезінці зміни рівня сироваткового заліза та насиченості трансферину через 3, 10 та 30 днів після делеції феритину Н (рис. 2В). Помірне, але значне збільшення спостерігалось для обох параметрів у експериментальних мишей порівняно з контрольними.
Делеція феритину Н спричиняє збільшення заліза у сироватці крові, насичення трансферину та 1 мРНК печінки гепсидином та репресію мРНК Dcytb дванадцятипалої кишки. (A) Експресія мРНК тестувалася за допомогою ПЛР у режимі реального часу на 3, 10 і 30 дні після делеції ферритину Н за допомогою праймерів, зазначених у допоміжній таблиці 2. Середня експресія (довільні одиниці) для Fth локс/локс мишей (n = 6; 3; 3) та Fth Миші Δ/Δ (n = 6; 3; 3) нормалізували до середнього геометричного показника двох контрольних генів (гліцеральдегід 3-фосфатдегідрогенази [GAPDH] та гіпоксантин-гуанін фосфорибозилтрансферази [HPRT] у печінці; GAPDH та β-актину в кишечнику) ) ± SD. ***P локс/локс (○) та Fth Δ/Δ (●) миші (R = 0,701 та P
Вплив делеції феритину H, опосередкованого Mx-Cre, на експресію генів.
Ланцюгова реакція полімерази в реальному часі (ПЛР) в Fth Δ/Δ проти Fth локс/локс миші в різні моменти часу виявили значне збільшення мРНК печінки гепсидину 1 (рис. 2А). Це збільшення корелювало зі збільшенням рівня сироваткового заліза (рис. 2B) та насичення трансферину (рис. 2C). Серед мРНК, що кодують білки дванадцятипалої кишки, лише мРНК DcytB була суттєво репресована, тоді як мРНК DMT1, ферропортину та гефестіну не показали суттєвих змін (рис. 2А та дані не показані). МРНК печінки феритину L, трансферину та Hfe були незмінними. У більшості тканин мРНК рецептора трансферину 1 була незначно знижена, сумісно з дестабілізацією мРНК через інактивацію IRP. 25 МРНК для рецептора трансферину 2, супероксиддисмутази 2 та глутатіонпероксидази 1 залишились незмінними в печінці та кишечнику.
Важкі пошкодження печінки делецією феритину Н у тварин з високим вмістом заліза.
Індукована залізом загибель клітин Fth Δ/Δ ембріональних фібробластів миші.
Для вивчення механізму клітинної токсичності заліза ми вивели Fth Δ/Δ і Fth +/ Δ ембріональні фібробласти миші, які показали однакові швидкості проліферації та життєздатності клітин за відсутності солей заліза. Однак при впливі на цитрат амонію заліза, Fth Клітини Δ/Δ були в 30 разів більш чутливими до заліза (середня летальна доза [LD50] = 1,3 мкг/мл), ніж Fth loxNeo/loxNeo клітин (LD50 = 36 мкг/мл) і в 120 разів більше, ніж Fth +/ Δ клітини (LD50 = 151 мкг/мл) (рис. 4А). Fth Загибель клітин Δ/Δ може бути врятована феритином дикого типу H за допомогою індуцибельного вектора (рис. 4B). При експресії мутантного феритину Н, що не має ферроксидазної активності, не було виявлено жодного врятування (рис. 4Б). У всіх досліджених популяціях клітин LD50 добре корелювали з рівнем мРНК феритину (рис. 4С). Разом ці дані вказують на важливу роль феритину у захисті від токсичності заліза.
Виживання ембріональних фібробластів миші в багатому залізом середовищі залежить від наявності функціонального феритину H. Ембріональні фібробласти мишей були отримані з Fth loxNeo/loxNeo і Fth +/loxNeo мишей, трансфікованих CMV-Cre-ER T і підданих дії тамоксифену для отримання Fth Δ/Δ і Fth +/ Δ клітини. (A) Fth Δ/Δ (○), Fth loxNeo/loxNeo (●) та Fth +/ Δ (⋄) клітини інкубували із збільшенням концентрацій цитрату амонію заліза та життєздатності клітин, виміряних через 4 дні методом МТС. (B) Fth Клітини Δ/Δ трансфікували кДНК феритину дикого типу H (▪) або феритину H без активності ферроксидази через мутації 62E → K та 65H → G (□). Токсичність заліза оцінювали як у (А). (C) Співвідношення між експресією мРНК феритину H та дозою LD50 заліза цитрату амонію заліза.
Обговорення
Гепсидин 1 має центральне значення для регуляції всмоктування заліза в кишечнику та рециркуляції заліза з ретикулоцитів. 14-16, 19, 20 Наші результати, що показують кореляцію між індукцією мРНК гепсидину 1 та збільшенням рівня сироваткового заліза та насиченості трансферином, здається, відображають залежний від заліза або голо-трансферрин залежний сигнал гену гепсидину 1. 14, 32 Більш дивним є зменшення експресії мРНК гепсидину 1 у тварин, які харчуються високим вмістом заліза, а потім видаляються з феритину Н (рис. 3С). Однак належне реагування клітин та передача сигналу гену гепсидину 1 можуть бути змінені серйозними ураженнями печінки. Ми та інші спостерігали, що виділені первинні гепатоцити в культурі клітин демонструють знижену експресію мРНК гепсидину 1 і не реагують на залізне заліза в середовищі (L. Vanoaica, unpubl. Obs.) 14, 33, якщо протягом декількох годин не обробляти їх залізом голо-трансферин. 32
Гостре ураження печінки, яке спостерігається протягом декількох днів після делеції феритину H у навантажених залізом мишей Mx-Cre, не може бути пов’язане ні з навантаженням заліза, ні з активацією шляху інтерферону-α полі-IC, як показали контрольні миші відсутні ознаки пошкодження. Наші результати, пов’язані з гепатоцитарною делецією SA-Cre-ER T2-делетованого феритину H із тамоксифеном або тамоксифеном та полі-IC, також виключають, що тільки полі-IC провокує пошкодження печінки. Отже, загибель клітин безпосередньо пов'язана із залізом, що виділяється при делеції та деградації феритину Н. Чи достатньо звільненого заліза для спровокування пошкодження печінки, чи включає сигнали через делецію феритину в інших тканинах, ще слід дослідити. Той факт, що миші, вилучені з ферритину Н, годували нормальну дієту протягом 2 місяців, а потім вводили декстран із залізом, свідчить про гостру печінкову недостатність, що свідчить на користь прямого впливу токсичності заліза на клітини печінки. Цікаво, що специфічна для гепатоцитів SA-Cre-ER T2-делеція ферритину Н, що спричиняє делецію, не спричиняє пошкодження (Довідкова Рис. 2). Це говорить про те, що гепатоцити захищені, оскільки сусідні макрофаги поглинають велику кількість звільненого заліза (рис. 3), чого не можна сказати про мишей Mx-Cre.
Подяка
Ми дякуємо Олаву Зіліану, Фаб'єну Зайлеру та Мішелю Аге за поради та мишу Mx-Cre, Андреасу Трампу за мишу Nes-Cre1 та pKI-Cre ER T, та Даніелю Мецгеру та П'єру Шамбону за мишу SA-Cre-ER T2, Майкл Мерфі для мітохінону та Майкл Рет для pAN ‐ MerCreMer. Ми дякуємо Сандживу Лютеру за фарбування макрофагів у селезінці та установі MIM ISREC за гістологію.
Додаткову допоміжну інформацію можна знайти в Інтернет-версії цієї статті.
| HEP_23058_sm_SupDoc.doc57,5 КБ | Допоміжні матеріали та методи |
| HEP_23058_sm_SupFig1.tif5,1 МБ | Малюнок 1. |
| HEP_23058_sm_SupFig2.tif5 МБ | Малюнок 2. |
| HEP_23058_sm_SupFig3.tif 18,6 МБ | Малюнок 3. |
| HEP_23058_sm_SupFig4.tif 18,6 МБ | Малюнок 4. |
| HEP_23058_sm_SupFig5.tif3,7 МБ | Малюнок 5. |
| HEP_23058_sm_SupFig6.tif5,7 МБ | Малюнок 6. |
| HEP_23058_sm_SupFig7.tif5,9 МБ | Малюнок 7. |
| HEP_23058_sm_SupTab1.tif959,5 КБ | Таблиця 1 додаткової таблиці. |
| HEP_23058_sm_SupTab2.tif5,4 МБ | Таблиця 2 додатків. |
Зверніть увагу: Видавець не несе відповідальності за зміст або функціональність будь-якої допоміжної інформації, наданої авторами. Будь-які запити (крім відсутнього вмісту) слід направляти до відповідного автора статті.
- Повна стаття Біостимулятор запобігає втраті врожаю та зменшує окислювальну шкоду у вирощуваних томатних рослинах
- Вплив тривалості зберігання яєць на виводимість та втрату ваги при інкубації типу яєць та м’яса
- Ураження печінки, спричинене наркотиками, внаслідок “натуральних продуктів”, що використовуються для схуднення
- Чи викликає детоксикація печінки втрату ваги; Харчування ТПВ
- Фітне трав'яний настій Оригінальний чай для схуднення для схуднення Сенна 40; THAI ETC GROUP Інтернет тайська