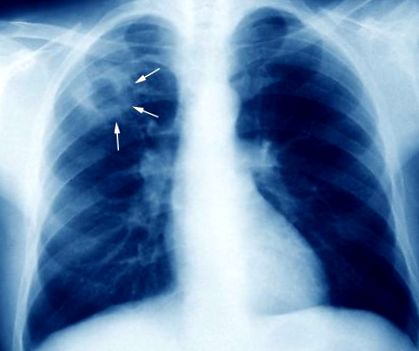
Туберкульоз (туберкульоз)
Мікобактерії - це дрібні повільно зростаючі аеробні палички. Вони відрізняються складною, збагаченою ліпідами оболонкою клітин, що відповідає за їх характеристику як кислотостійкої (тобто стійкої до знебарвлення кислотою після фарбування карболфуксином) та відносної стійкості до плями за Грамом. Найпоширеніша мікобактеріальна інфекція - туберкульоз; інші включають проказу та різні мікобактеріальні інфекції, що нагадують туберкульоз, наприклад, спричинені Mycobacterium avium складні.
Туберкульоз є основною інфекційною причиною захворюваності та смертності серед дорослих у всьому світі, внаслідок чого в 2016 році загинуло близько 1,7 мільйона людей, більшість із них у країнах з низьким та середнім рівнем доходу. ВІЛ/СНІД є найважливішим фактором, схильним до туберкульозної інфекції та смертності в частинах світу, де переважають обидві інфекції.
Етіологія
Туберкульоз належним чином відноситься лише до хвороб, викликаних Мікобактерії туберкульозу (для яких люди є головним водосховищем). Подібне захворювання іноді виникає внаслідок близькоспоріднених мікобактерій, M. bovis, M. africanum, і M. microti—Який разом із М. туберкульоз відомі як Мікобактерії туберкульозу складні.
Туберкульоз виникає майже виключно вдиханням містяться в повітрі частинок (ядер крапель) М. туберкульоз. Вони розходяться в основному за допомогою кашлю, співу та інших примусових дихальних маневрів людьми з активним туберкульозом легенів або гортані і мокрота яких містить значну кількість організмів (зазвичай достатньо, щоб мазок був позитивним). Люди з легеневими порожнинними ураженнями особливо інфекційні через велику кількість бактерій, що містяться в ураженні.
Ядра крапель (частинки
Епідеміологія
Близько четвертої частини населення світу інфіковано (на основі опитувань на шкірні дослідження на туберкулін). З заражених, можливо, 15 мільйонів мають активну хворобу в будь-який момент часу.
У 2016 році, за оцінками, у всьому світі сталося 10,4 млн. (140,5/100 000) нових випадків туберкульозу. Найбільше нових випадків трапилось у Південно-Східній Азії (45%), Африці (25%) та Західній частині Тихого океану (17% [1]).
Рівень захворюваності дуже різниться в залежності від країни, віку, раси, статі та соціально-економічного статусу. У 2016 році 64% нових випадків трапилось у 7 країнах; найбільше відбулося в Індії, за ними слідують Індонезія, Китай, Філіппіни, Пакистан, Нігерія та Південна Африка (2). Кількість країн, включаючи Північну Корею, Лесото, Мозамбік, Філіппіни та Південну Африку, мали показники захворюваності вище 500/100 000 (1).
Рівень зараження (при лікарсько-схильному туберкульозі) та смертність зменшуються. Нові випадки зменшились на 1,5% між 2014 і 2015 роками, поширюючи тенденцію, що спостерігається протягом ряду років. Ці тенденції, ймовірно, частково зумовлені глобальними зусиллями щодо боротьби з туберкульозом, які надали більшій кількості людей доступ до ліків від туберкульозу та ВІЛ-інфекцій.
У США рівень захворюваності зменшився з 1994 по 2014 рік. У 2016 році CDC повідомили про 9287 нових випадків захворюваності на 2,9/100 000, що було незначним зниженням порівняно з 2015 р. Більше половини цих випадків мали місце у пацієнтів, народжених за межами США в районах із високим поширенням. Рівень туберкульозу серед людей, які народилися в іноземцях (14,6/100 000), був набагато вищим, ніж серед людей, які народилися в США (1,1/100 000 [3]). Ризик зараження збільшується для людей, які проживають у групових закладах, таких як притулки, заклади тривалого догляду або виправні установи, а також для тих, хто залишився без житла в минулому році. У таких групах населення з високим рівнем ризику випадки захворюваності можуть наблизитися до тих, що знаходяться в частинах світу з великим навантаженням.
Відростання туберкульозу відбулося в деяких районах США та інших розвинених країнах між 1985 і 1992 роками; це було пов'язано з кількома факторами, включаючи коінфекцію ВІЛ, безпритульність, погіршення інфраструктури охорони здоров'я та появу мультирезистентного туберкульозу (МР ТБ). Хоча суттєво контролюється в США за допомогою ефективних заходів охорони здоров'я та інституційного контролю за інфекціями, проблема МРТБ, включаючи широко стійкий до наркотиків ТБ (XDR-TB), схоже, зростає у всьому світі, підживлюючись недостатніми ресурсами, включаючи діагностику та системи доставки лікування.
У більшості країн світу туберкульоз, стійкий до лікарських засобів, не можна швидко діагностувати та негайно лікувати ефективними схемами лікування, включаючи ефективне лікування побічних ефектів препаратів 2-ї лінії. Така ситуація призводить до тривалої передачі, низького рівня виліковування та посилення стійкості. Лікування XDR-ТБ має ще менш сприятливі результати; рівень смертності надзвичайно високий у пацієнтів, котрі заражені ВІЛ, навіть коли вони лікуються антиретровірусними препаратами. Ефективне лікування та управління несприятливими наслідками, охоплення громад та соціальна підтримка призвели до більш сприятливих тенденцій до зниження стійкості до лікарських засобів туберкульозу в кількох районах (наприклад, Перу, Томська область Росії). Індія та Китай лише починають впроваджувати загальнонаціональні програми з МР ТБ, і на майбутнє МР ТБ може значний вплив мати успіх або провал цих програм.
Посилання на епідеміологію
1. ВООЗ: Глобальний звіт про туберкульоз 2017 р .: Підсумок. Доступ 5/4/18.
2. ВООЗ: Інформаційний бюлетень про туберкульоз, 2017. Доступ 5/4/18.
Патофізіологія
Туберкульоз може протікати в 3 стадії:
М. туберкульоз Бацили спочатку викликають первинну інфекцію, яка рідко викликає гострі захворювання. Більшість (близько 95%) первинних інфекцій протікають безсимптомно і супроводжуються прихованою (сплячою) фазою. Змінний відсоток прихованих інфекцій згодом реактивується із симптомами та ознаками захворювання.
Інфекція, як правило, не передається на первинній стадії і ніколи не є заразною на латентній стадії.
Первинна інфекція
Інфекція вимагає вдихання частинок, досить малих, щоб пройти захист верхніх дихальних шляхів і відкластися глибоко в легені, як правило, в субплевральних повітряних просторах середньої або нижньої часток. Більші краплі, як правило, потрапляють у більш проксимальні дихальні шляхи і, як правило, не призводять до зараження. Зараження зазвичай починається з одного краплинного ядра, яке, як правило, несе мало організмів. Можливо, лише одного організму може бути достатньо, щоб викликати інфекцію у сприйнятливих людей, але менш сприйнятливим людям може знадобитися повторний вплив для розвитку інфекції.
Для ініціації зараження, М. туберкульоз бацили повинні потрапляти в альвеолярні макрофаги. Бацили, які не вбиті макрофагами, насправді реплікуються всередині них, в результаті вбиваючи макрофаг-хазяїна (за допомогою лімфоцитів CD8); запальні клітини притягуються до цієї ділянки, викликаючи вогнищевий пневмоніт, який зливається в характерні горбки, що спостерігаються гістологічно.
На перших тижнях зараження деякі інфіковані макрофаги мігрують до регіональних лімфатичних вузлів (наприклад, гомілкового, середостінного), де потрапляють у кров. Потім організми можуть гематогенно поширюватися на будь-яку частину тіла, особливо на верхівково-задню частину легенів, епіфізи довгих кісток, нирок, тіл хребців та мозкових оболонок. Гематогенна дисемінація є менш імовірною у пацієнтів з частковим імунітетом внаслідок вакцинації або попереднього природного зараження М. туберкульоз або екологічні мікобактерії.
Латентна інфекція виникає після більшості первинних інфекцій. Приблизно в 95% випадків, приблизно через 3 тижні нестримного росту, імунна система пригнічує реплікацію бацил, як правило, до розвитку симптомів або ознак. Вогнища паличок в легенях або інших місцях розпадаються на епітеліоїдні клітинні гранульоми, які можуть мати казеозні та некротичні центри. Бацили горбків можуть вижити в цьому матеріалі роками; баланс між стійкістю хазяїна та мікробною вірулентністю визначає, чи врешті-решт інфекція розсмоктується без лікування, залишається в стані спокою або стає активною. Інфекційні вогнища можуть залишити фібронодулярні рубці у верхівках одного або обох легенів (вогнища Саймона, які зазвичай є результатом гематогенного висіву з іншого місця зараження) або невеликих ділянок консолідації (гонські вогнища). Фокус Гона із ураженням лімфовузлів - це комплекс Гона, який, якщо звапніти, називається комплексом Ранке. Шкірний тест на туберкулін та дослідження крові на вивільнення інтерферону-гамми (IGRA) стають позитивними під час прихованої стадії інфекції. Місця прихованої інфекції - це динамічні процеси, не зовсім бездіяльні, як колись вважали.
Рідше первинний осередок негайно прогресує, спричиняючи гостре захворювання із запаленням легенів (іноді порожнинним), плевральним випотом та помітним збільшенням лімфатичних вузлів середостіння або суглобів (яке у дітей може стискати бронхи). Невеликі плевральні випоти переважно лімфоцитарні, зазвичай містять мало організмів і прозорі протягом декількох тижнів. Ця послідовність може бути більш поширеною серед маленьких дітей та нещодавно інфікованих або реінфікованих імунодепресивних пацієнтів.
Позалегеневий туберкульоз на будь-якій ділянці може іноді проявлятися без ознак ураження легенів. Туберкульозна лімфаденопатія - найпоширеніша позалегенева форма; однак менінгіт найбільше побоюється через високу смертність у дуже молодих та дуже старих.
Активне захворювання
Здорові люди, інфіковані туберкульозом, мають приблизно 5-10% ризику розвитку активних захворювань протягом усього життя, хоча цей відсоток суттєво різниться залежно від віку та інших факторів ризику.
У 50-80% тих, у кого розвивається активне захворювання, туберкульоз реактивується протягом перших 2 років, але це може трапитися і через десятки років.
Будь-який спочатку засіяний орган може стати місцем реактивації, але реактивація відбувається найчастіше у верхівках легенів, імовірно через сприятливі місцеві умови, такі як висока напруга кисню. Гонські вогнища та уражені гілярні лімфатичні вузли набагато рідше є місцями реактивації.
Стани, що погіршують клітинний імунітет (що є важливим для захисту від туберкульозу), значно сприяють реактивації. Таким чином, пацієнти, котрі заражені ВІЛ та не отримують відповідної АРТ, мають приблизно 10% річного ризику розвитку активного захворювання.
Інші умови, що сприяють реактивації, але меншою мірою, ніж ВІЛ-інфекція, включають
- Тубулоінтерстиціальний нефрит - сечостатеві розлади - Керівництво MSD Professional Edition
- Передчасні удари шлуночків (VPB) - Серцево-судинні розлади - Підручники Merck Professional Edition
- Вірусний менінгіт - неврологічні розлади - Підручники Merck Professional Edition
- Взаємозв'язок між харчуванням та інфекційними захворюваннями Огляд Фархаді С, Овчинников Р.С. -
- Поширені синдроми гастриту - шлунково-кишкові розлади - Підручники Merck Professional Edition