Тривале спостереження за індукованою бусереліном кишковою нейропатією у щурів
АНЕТТ ЙОНССОН
1 Відділ клінічних наук, Відділ внутрішньої медицини, Університетська лікарня Сконе, Університет Лунда, 205 02 Мальме, Швеція
ЕЛІН СЕНД
1 Відділ клінічних наук, Відділ внутрішньої медицини, Університетська лікарня Сконе, Університет Лунда, 205 02 Мальме, Швеція
2 Відділ експериментальної медичної науки, відділення нейрогастроентерології, BMC B11, Університет Лунда, 221 84 Лунд, Швеція
EVA EKBLAD
2 Відділ експериментальної медичної науки, відділення нейрогастроентерології, BMC B11, Університет Лунда, 221 84 Лунд, Швеція
БОДІЛ ОЛЬССОН
1 Відділ клінічних наук, Відділ внутрішньої медицини, Університетська лікарня Сконе, Університет Лунда, 205 02 Мальме, Швеція
Анотація
У кількох пацієнтів було показано, що під час лікування аналогами гонадотропін-рилізинг-гормону (GnRH) розвиваються сильні болі в животі та порушується рухливість шлунково-кишкового тракту. Модель ентеральної нейропатії щурів була розроблена шляхом введення щурам аналога GnRH. Описано втрату кишкових нейронів та гангліоневрит у шлунково-кишковому тракті без інших гістопатологічних змін. Метою цього дослідження було дослідити довгостроковий вплив цієї моделі щурів на масу тіла, а також на морфологію та запальні зміни в шлунково-кишковому тракті. Щурам вводили підшкірні ін'єкції бусереліну або фізіологічного розчину один раз на день протягом 5 днів і дозволяли відновлюватися протягом 3 тижнів. Цей режим повторювали чотири рази. Щурів зважували щотижня і забивали через 16 тижнів після четвертої обробки. Морфометрією вимірювали стінку кишечника та оцінювали наявність кишкових нейронів, тучних клітин, еозинофілів та Т-лімфоцитів. Було показано, що щури, оброблені бусереліном, мали меншу масу тіла при жертві порівняно з контролем (Р Ключові слова: кишкова нейропатія, гонадотропін-рилізинг-гормон, шлунково-кишковий тракт, модель щурів
Вступ
Гормон, що вивільняє гонадотропін (GnRH), стимулює секрецію фолікулостимулюючого гормону (FSH) та лютеїнізуючого гормону (LH) з гіпофіза, які регулюють секрецію стероїдних гормонів, таких як естроген та прогестерон (1). Рецептори GnRH та LH ідентифіковані в шлунково-кишковому тракті людини та щурів (ШКТ) (2–4), де GnRH інгібує проліферацію клітин (5,6). Стимуляція ЛГ фрагментує мігруючий міоелектричний комплекс у тонкій кишці (7) та зменшує виживання ентерогенних нейронів щурів у культурі (8). Ряд пацієнтів страждають від побічних ефектів з боку шлунково-кишкового тракту під час лікування аналогами GnRH, а у деяких пацієнтів розвивається хронічна псевдообструкція кишечника (CIPO) або кишкова дизмотичність (ЕД) з дегенеративно-запальними змінами в шлунково-кишковому тракті (3,9).
Попередні дослідження на щурах показали, що аналоги GnRH спричиняють втрату підслизових та міентеріальних нейронів на очному дні, клубовій кишці та товстій кишці, без будь-якого впливу на масу тіла, циркулюючі запальні біомаркери або морфометрію стінки кишечника (4,10). Показано, що кількість тучних клітин та еозинофілів не змінюється; однак виявлено ознаки гангліоневриту з інфільтрацією Т-лімфоцитів у кишкових гангліях (4,11). Спостерігали підвищений рівень естрадіолу в плазмі та потовщений м’язовий шар матки, поряд із зменшенням відносної кількості нейронів, імунореактивних на рецептори ЛГ, та підвищеною імунореактивністю активованої каспази-3 (4,10). Таким чином, лікування бусереліном у щурів являє собою модель ентеральної нейропатії щурів, і передбачається, що втрата нейронів буде опосередкована за рахунок підвищеного вивільнення ЛГ та гіперактивації кишкових нейронів, що несуть рецептори ЛГ (4,10,11), що призводить до посилення апоптозу (4, 12).
Попередні результати базуються на дослідженнях, при яких тварин приносили в жертву незабаром після остаточної обробки бусереліном (4,10,11). Метою цього дослідження було дослідити довгостроковий вплив бусерелінової кишкової нейропатії на масу тіла та шлунково-кишковий тракт щодо втрати нейрональних клітин, морфології та запальних змін.
Матеріали і методи
Тварини
Використовували самок щурів Sprague-Dawley (n = 20; вік, 7 тижнів; вага, 170–180 г), придбаних у лабораторіях Charles River (Сульцфельд, Німеччина). Щурам дозволяли пристосуватися до кліматичного та контрольованого світлом приміщення для тварин протягом принаймні 5 днів перед експериментами. Стандартна щуряча чау (4% жиру/г) (Lactamin R36, Стокгольм, Швеція) та вода постачалися за бажанням. Експериментальний проект був схвалений Комітетом з етики тварин, Лунд та Мальме, Швеція (M350–12, дата затвердження: 14.11.12). Тварин використовували відповідно до Директиви Ради Європейських Співтовариств (2010/63/ЄС) та Шведського закону про добробут тварин (SFS 1988: 534).
Вивчати дизайн
Щурам (n = 12) вводили 20 мкг аналога GnRH-бусереліну (1 мг/мл) (Suprefact, Sanofi-Aventis, Bromma, Швеція) (розчиненого в 0,2 мл фізіологічного розчину) підшкірно, один раз на день протягом 5 днів, а потім 3 тижнів одужання, що представляє один сеанс лікування (4). Дозування та введення бусереліну базуються на попередніх дослідженнях, які показали надійні фізіологічні ефекти з точки зору гіпертрофії матки без будь-яких негативних наслідків (4,10,13). Контрольні тварини (n = 8) отримували 0,2 мл фізіологічного розчину. Тварин зважували перед включенням у дослідження та щотижня вранці під час дослідження. Через тридцять два тижні після початку дослідження та через 4 місяці після останнього сеансу лікування щурів знеболювали за допомогою хлоралгідрату (300 мг/кг маси тіла; C8383; Sigma-Aldrich, Сент-Луїс, Міссурі, США) і вбивали пункцією аорти. Зразки тканин із очного дна, дистального відділу клубової кишки, проксимального відділу ободової кишки та дистальної частини рогу матки були зібрані та оброблені для гістологічної оцінки.
Підготовка тканин
Очне дно/тіло шлунка, клубова кишка (починаючи 8 см проксимальніше сліпої кишки і продовжуючи в проксимальному напрямку) і товста кишка (починаючи 2 см дистально від сліпої кишки і продовжуючи в дистальному напрямку) відкрили і сплющили на фільтрувальному папері . По одній ділянці кожної області кишки фіксували в закріплювачі Стефаніні (суміш 2% формальдегіду (Sigma-Aldrich) і 0,2% пікринової кислоти (Sigma-Aldrich) у фосфатному буфері, рН 7,2) протягом 22 год при 4 ° C, і інші ділянки та роги матки фіксували у 4% параформальдегіді (Sigma-Aldrich) у 0,1 М фосфатному буфері протягом 22 год при 4 ° C. Зразки, закріплені за Стефаніні, тричі промивали в розчині Тирода, що містить 10% сахарози, перед тим, як їх орієнтувати і встановити для поперечного та поздовжнього зрізу в тканині Тек (Сакура, Гістолаб, Гетеборг, Швеція), заморозити на сухому льоду та розрізати (10 мкм) в кріостаті (HM500; Microm GmbH, Вальдорф, Німеччина). Зразки, зафіксовані параформальдегідом, зневоднювали в етанолі, очищали в ксилолі, орієнтували для поперечного та поздовжнього зрізу, вкладали в парафін і розрізали (5 мкм). Зрізи обробляли для імуноцитохімії та гістохімії.
Гістохімія
Морфометрію проводили на сканованих, депарафінізованих, гідратованих, а також забруднених гематоксиліном та еозином парафінах (усі Histolab Products AB, Гетеборг, Швеція) з поперечних перерізів маткових рогів та поздовжньо вирізаних областей ШКТ за допомогою комп'ютеризованої системи аналізу зображень (Imagescope, Aperio ScanScope GL SS5082, Vista, Каліфорнія, США). Міометрій та кишкові шари очного дна, дистального відділу клубової кишки та проксимального відділу товстої кишки (слизова оболонка та циркулярні та поздовжні м’язові шари) вказували вручну, а потім вимірювали за допомогою комп’ютерного двійкового курсору. Середні значення 6–10 репрезентативних вимірювань розраховували від кожного щура в кожній області.
Імуноцитохімія
Тучні клітини
Фарбування толуїдиновим синім (Histolab Products AB) проводили на парафінових зрізах для виявлення тучних клітин в ШКТ (14). Зрізи очного дна, клубової кишки та товстої кишки депарафінізували, гідратували та фарбували 0,1% толуїдиновим синім у 60% етанолі протягом 60 хв при кімнатній температурі. Поперечно-поздовжньо розрізані цілі стінові зрізи сканували та аналізували в Imagecope (Aperio ScanScope). Слизові, підслизові, циркулярні та поздовжні м’язові шари оцінювали окремо, і всі тучні клітини підраховували щонайменше 12 мм, вирізавши на 6–9 різних глибинах з кожної області та щурів. Результати виражаються як кількість тучних клітин на мм довжину області ШКТ.
Еозинофіли
Для ідентифікації еозинофілів застосовували процедуру фарбування на основі ціанідостійкої еозинофільної пероксидази (ЕРО) (15). Кріо-зрізи очного дна, клубової кишки та товстої кишки промивали у буфері PBS (pH 7,2), DAB (75 мг/100 мл), H2O2 (100 мкл/100 мл) та NaCN (50 мг/100 мл) протягом 8 хв і потім промивали у воді протягом 10 хв, перш ніж монтувати в гліцериновий желатин (Kaiser, Merck K, Дамштадт, Німеччина). Як поперечно, так і поздовжньо вирізані ділянки цілої стіни аналізували за допомогою світлового мікроскопа (Olympus BX43, з прикріпленою камерою Nikon XC30, прилад LRI, Гамбург, Німеччина). Кількість клітин оцінювали окремо в слизовій, підслизовій і м’язових шарах кожної області в діапазоні від 0 до +++, де 0 означає відсутність клітин, + позначає кілька клітин, ++ позначає помірне число, і + ++ вказує на велике число, як описано раніше (4,15). У регіонах, які показали різницю між групами, еозинофіли підраховували щонайменше 30 мм, розрізали на 6–9 різних глибин від кожної області та щурів. Результати виражаються як кількість еозинофілів на мм або см довжини області ШКТ.
Т-лімфоцити
Наявність CD3-імунореактивних Т-лімфоцитів аналізували на поперечно та поздовжньо вирізаних цілостінних парафінових зрізах із очного дна, клубової кишки та товстої кишки. Зрізи інкубували протягом ночі з первинними поліклональними антитілами проти CD3, вирощеного на козі (розведення 1: 1000; кат. № 1127, Santa Cruz Biotechnology, Inc., CA, USA). Потім зрізи піддавали дії впливу кон’югованого DyLight-TM-594 осличого IgG (розведення 1: 1000; Jackson ImmunoResearch Europe, Ltd., Ньюмаркет, Великобританія) протягом 1 год і встановлювали у фосфатний буфер: гліцерин 1: 1. Флуорофор збуджували, а Т-лімфоцити візуалізували при 488 нм за допомогою мікроскопа Olympus BX43.
Т-лімфоцити окремо оцінювали в епітелії, слизовій, підслизовій, циркулярному та поздовжньому м’язових шарах та серозах очного дна, клубової кишки та товстої кишки в діапазоні від 0 до +++, де 0 означає відсутність клітин, + означає мало, + + позначає помірне число, а +++ позначає велике число, як було описано раніше (4,15). Підраховували лише ті регіони, які показали різницю між групами, принаймні 20 мм довжини ГІ, вирізані на 6–9 різних глибинах від кожної області та щурів. Результати виражаються як кількість Т-лімфоцитів на мм довжини області ШКТ.
Статистичний аналіз
Тучні клітини
На очному дні було виявлено численні тучні клітини в підслизовій оболонці та в циркулярному м’язовому шарі з високими індивідуальними варіаціями, незалежно від лікування (рис. 4А та В). У клубовій кишці та товстій кишці тучні клітини знаходили лише у підслизовій оболонці, без різниці між групами (рис. 4C та D).
Кількість тучних клітин, що аналізуються в (A) SM та (B) CM на очному дні, та в SM (клубової кишки) (D) товстої кишки між щурами, обробленими сольовим розчином або бусереліном. Підрахунок клітин проводили на поперечно-поздовжньо вирізаних ділянках цілої стіни. С = 8 щурів і В = 11 щурів. Результати представлені як окремі дані та медіани. Для аналізу використовували U-тест Манна-Уітні. СМ, підслизова оболонка; СМ, циркулярний м’язовий шар; С, контроль, оброблений фізіологічним розчином; B, бусерелін.
Еозинофіли
Обговорення
У щурів, які отримували бусерелін, було виявлено зменшену кількість міентеріальних нейронів в клубовій кишці та товстій кишці порівняно з контролем у цьому довготривалому дослідженні. Лікування бусереліном призвело до зниження маси тіла в кінці дослідження, тоншого кругового м’язового шару в клубовій кишці, тоншого поздовжнього м’язового шару в товстій кишці, збільшення кількості еозинофілів у підслизовій оболонці клубової кишки та більшої кількості Т-лімфоцити в підслизовій оболонці очного дна та циркулярних м’язових шарах очного дна та товстої кишки порівняно з контролем.
Через шістнадцять тижнів після останнього сеансу лікування, на 32 тижні дослідження, у щурів, які отримували бусерелін, спостерігалася втрата міентеріальних нейронів в клубовій кишці і товстій кишці, як це було описано в попередніх дослідженнях, де щурів забивали незабаром після закінчення лікування (4, 10). Відповідно до попередніх досліджень, втрата нейронів була більш вираженою в клубовій кишці та товстій кишці, ніж на очному дні, та в міентеріальних нейронах, ніж у підслизових нейронах (4,10). Можлива регенерація кишкових нейронів та гліальних клітин, оскільки були ідентифіковані тканиноспецифічні клітини-попередники (16,17), а дослідження на мишах показали регенерацію нейронів після пошкодження кишечника (18). Однак величина втрати міентерального нейрону була такою ж, як визначена в попередніх дослідженнях (4,10), навіть незважаючи на те, що справжні щури жили ще 16 тижнів довше.
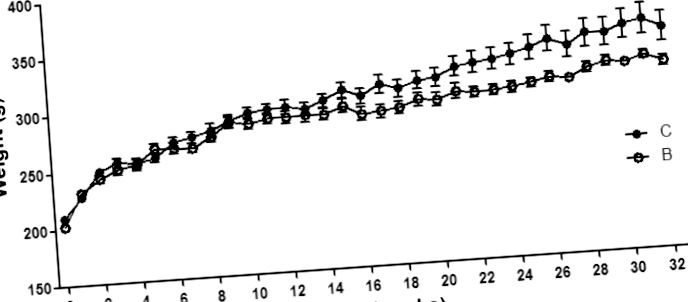
Різниця у масі тіла між групами розпочалася на 23 тижні і не спостерігалась у короткотермінових дослідженнях, що закінчились на 16 та 18 тижнях (4,10), що свідчить про те, що пошкодження, які виникають під час лікування, зрештою призводять до недоїдання. Кишково-кишкова нервова система (ENS) впливає на травлення та всмоктування поживних речовин, зокрема вуглеводів та жиру (19,20), і спостерігається підвищений вміст жиру в калі після лікування бусереліном (10). Таким чином, кишкова нейропатія може призвести до недоїдання як у щурів, так і у пацієнтів (3,9). Статеві гормони стимулюють збільшення споживання їжі, і, як показано, низький рівень естрадіолу в плазмі крові призводить до зменшення споживання їжі (21). У попередньому дослідженні не виявлено різниці у масі тіла; однак рівень естрадіолу в плазмі крові був підвищений, а м’язовий шар матки потовщений після лікування бусереліном (10). Незмінна товщина міометрію в цьому дослідженні свідчить про нормалізований рівень статевих гормонів після припинення лікування, а негативні наслідки невропатії на засвоєння кишкових поживних речовин не можуть бути протиставлені підвищеним апетитом та споживанням їжі, вторинним до підвищеного рівня статевих гормонів, як передбачуване пояснення зниженому вага тіла під час довготривалого спостереження.
На закінчення слід зазначити, що тривале спостереження за індукованою бусереліном кишковою нейропатією на моделі щурів демонструє незворотну втрату міентеріальних нейронів. Взаємоз цим, гістопатологічні зміни шлунково-кишкового тракту з часом посилювались, і щури мали більш тонкі м’язові шари та збільшували кількість еозинофілів та Т-лімфоцитів. Крім того, збільшення маси тіла з часом зменшується. Подальші механістичні дослідження необхідні для того, щоб пояснити патофізіологію, яка лежить в основі кишкової нейропатії, та пов'язані з цим зміни.
Подяка
Фонд короля Густава V та королеви Вікторії Вільного масона, Розвиток регіону Сконе, Фонд Бенгта Іре, Фонд Лундстрема та Королівське фізіографічне товариство в Лунді. Автори висловлюють подяку Анні Темнер Перссон за технічну допомогу.
- Довготривале спостереження за програмою зниження ваги телемоніторингу “Активне управління тілом”
- Багато жінок мають довгострокову втрату ваги після підтяжки живота, повідомляє про пластичну та реконструктивну хірургію
- Вплив розподілу жиру в організмі на довгострокові клінічні результати після імплантації стента, що елюює ліки
- Подальші поради щодо способу життя покращують глікемічний контроль, окисно-відновний та запальний статус у пацієнтів із
- Чи є довгострокове схуднення безнадійним; Світанок Маклафлін, доктор філософії