Трансплантація гемопоетичних стовбурових клітин молодих донорів на основі мобілізації продовжує тривалість життя мишей
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Департамент епідеміології та біостатистики, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Департамент епідеміології та біостатистики, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Основна установка проточної цитометрії, UT Health, Сан-Антоніо, Сан-Антоніо, Техас, США
Департамент клітинних систем та анатомії, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра патології та лабораторної медицини, Медична школа Перельмана, Університет Пенсільванії, Філадельфія, Пенсільванія, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра клітинної та інтегративної фізіології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра фармакології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра клітинної та інтегративної фізіології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра фармакології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Листування
Сенлін Лі, кафедра медицини, UT Health, Сан-Антоніо, 7703 Floyd Curl Drive, Сан-Антоніо, Техас, 78229, США.
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Департамент епідеміології та біостатистики, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Департамент епідеміології та біостатистики, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Основна установка проточної цитометрії, UT Health, Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра клітинних систем та анатомії, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра патології та лабораторної медицини, Медична школа Перельмана, Університет Пенсільванії, Філадельфія, Пенсільванія, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра клітинної та інтегративної фізіології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра фармакології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра клітинної та інтегративної фізіології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Кафедра медицини, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Інститут досліджень довголіття та старіння Баршоп, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Кафедра фармакології, UT Health Сан-Антоніо, Сан-Антоніо, Техас, США
Служба досліджень, Система охорони здоров'я ветеранів Південного Техасу, Сан-Антоніо, Техас, США
Листування
Сенлін Лі, кафедра медицини, UT Health, Сан-Антоніо, 7703 Floyd Curl Drive, Сан-Антоніо, Техас, 78229, США.
Інформація про фінансування:
Підтримку надав Фонд медичних досліджень Вільяма та Елли Оуенс, грант Огляду заслуг від Департаменту біомедичних лабораторних досліджень та розробок у справах ветеранів (2I01BX000737), Проточної цитометрії в UT Health San Antonio (за підтримки фондів університету та NIH) грант P30 CA054174), ударний центр Сан-Антоніо Натан (грант NIH P30AG013319) та премія за клінічну та трансляційну науку (грант NIH TL1 TR001119). За вміст несуть виключну відповідальність автори та не обов'язково відображають офіційні погляди фінансових установ.
Анотація
1. ВСТУП
Більшість HSC проживають у спеціалізованих нішах кісткового мозку, хоча деякі HSC залишають ці ніші та мігрують у кров,
1% –5% від загальної кількості HSC щодня (Bhattacharya et al., 2009). Мобілізація HSC в периферичну кров може бути досягнута шляхом введення G-CSF (Teipel et al., 2015), ефект, який різко збільшується, коли G-CSF вводять у комбінації з іншими мобілізаторами, такими як AMD3100 (Pusic & DiPersio, 2010). Ця мобілізаційна стратегія HSC становить основний механізм збору стовбурових клітин донорів периферичної крові в клініці. Критично важливо, що ця посилена мобілізація також створює тимчасово порожні ніші в кістковому мозку, відкриваючи вікно можливостей для приживлення донорських клітин. Тут ми використовуємо нову процедуру HSCT на основі мобілізації, щоб дослідити переваги, пов’язані зі здоров’ям, від заміни HSC від старих реципієнтів HSC для молодих донорів. Крім того, ми використовуємо властивості, що зберігають нішу цього HSCT на основі мобілізації, щоб дослідити вплив сигналізації застарілої ніші на низький відсоток HSC молодих донорів.
2 РЕЗУЛЬТАТИ
2.1 Довготривалий донорський химеризм був досяжний після мобілізаційних умов
Щоб зменшити несприятливий вплив цитотоксичних кондиціонуючих речовин, ми розробили мобілізаційну процедуру кондиціонування, усунувши необхідність опромінення, з подальшою трансплантацією донорських HSC. G-CSF та AMD3100 (додаткові мобілізуючі агенти) використовувались для мобілізації HSC у мишей віком десяти тижнів. Після пікової мобілізації (5-й день) мишам трансплантували 2,0 × 10 6-негативний за віком, GFP + клітини кісткового мозку (рис. S1). Всього було проведено сім циклів трансплантації для кожного реципієнта, причому химеризм донорів (GFP +) збільшувався з кожним циклом трансплантації, досягаючи
90% через 1 місяць після 7-го циклу та стабілізація при
77% до 4 місяців після трансплантації (таблиця 1).
| 1 | 26,9 ± 4,9 | 25,9 ± 7,9 |
| 2 | 36,8 ± 5,3 | 36,6 ± 4,1 |
| 3 | 48,9 ± 4,0 | 42,2 ± 4,0 |
| 4 | 61,9 ± 5,5 | 50,0 ± 1,9 |
| 5 | 69,1 ± 4,6 | 56,8 ± 7,1 |
| 6 | 80,2 ± 2,6 | 68,1 ± 9,3 |
| 7 | 90,4 ± 2,9 | 76,6 ± 7,0 |
- N = 3/група. Дисперсія = стандартне відхилення середнього значення. Жодна тварина не була виключена з дослідження.
2.2 Нетоксичне відновлення кровотворення з молодими HSC збільшує тривалість життя вікових мишей-реципієнтів
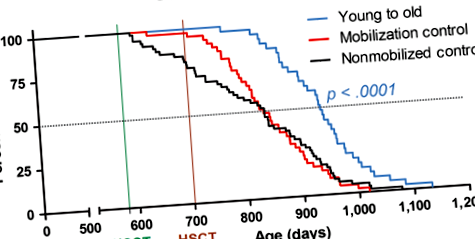
Далі ми використали цей новий метод HSCT для дослідження впливу заміни вікових (19-місячних) HSC на молодих донорських (2-місячних) HSC. На малюнку 1 зображені криві виживання для попередньо відведених самок мишей C57BL/6NIA, заснованих на загальній кількості 144 тварин, реципієнтів, які отримали загалом вісім циклів HSCT (рис. 2а). У таблиці S2 підсумовується вік кожної групи з 50% виживання та максимальним виживанням (середній вік найстарших 10%), а також перераховується вік найстаршого вижилого. Одержувачі HSC молодих донорів отримували коефіцієнт ризику (HR) для смерті 0,33 (95% ДІ: 0,199–0,537, стор + реципієнти, які отримують GFP - HSC для молодих донорів - збільшення середньої тривалості життя та HR на 17% - 0,14 (95% ДІ, 0,054 - 0,348, стор
Для моніторингу донорського химеризму реципієнти-жінки, які відповідали віку (19 місяців), отримували 2-місячний GFP + молоді жінки-донори HSC паралельно із літніми реципієнтами HSC молодих донорів. Оскільки лише LT-HSC здатні тривалий час відновлюватися і постійно сприяти гемопоезу через чотири місяці після трансплантації (Dykstra et al., 2007), ми отримували зразки периферичної крові як через один, так і через чотири місяці після трансплантації для оцінки донорського химеризму та тривалості термін відновлення донорських клітин. Порівняно з клітинами GFP + (рис. 2г), донорський химеризм досягав 91,2 ± 1,6% через 1 місяць після останнього циклу HSCT і стабілізувався на рівні 74,8 ± 2,6% через 4 місяці після трансплантації, порівняно з донорським химеризмом, який спостерігався у реципієнтів HSCT на основі опромінення (80,3 ± 5,6%, малюнок 2д).
2.3 Нетоксичне відновлення кровотворення затримує накопичення дефіциту, пов’язаного зі здоров’ям, у мишей-реципієнтів
2.4 Заміна застарілих HSC клітинами молодих донорів усуває вікові перекоси лінії похилого віку у реципієнтів
2.5 Клітини молодих донорів підтримують молодий розподіл підтипів клітин LSK у вікових реципієнтів
3 ОБГОВОРЕННЯ
Важливо зазначити, що це дослідження включає перше успішне ТГСК, при якому важкі побічні ефекти, такі як швидке зниження маси тіла (Duran-Struuck & Dysko, 2009; Iestra, Fibbe, Zwinderman, Staveren, & Kromhout, 2002) та знижують виживання (Гість, Ilic, Scrable, & Sell, 2015) не спостерігались. Одержувачі, які проходили цю процедуру HSCT на основі мобілізації, не вимагали додаткового догляду - наприклад, антибіотиків, кислої води або частих змін клітини - для запобігання смертності, пов’язаної з HSCT (Duran ‐ Struuck & Dysko, 2009). У постійному дослідженні для цього методу порівнюють профілі токсичності із звичайними процедурами HSCT (дані не наведені). Інші розробляють схеми трансплантації, які обмежують токсичність, виключаючи використання опромінення або хіміотерапевтичних препаратів, однак ці методи вимагають виснаження ендогенних HSC (Chhabra et al., 2016; Palchaudhuri et al., 2016). У поточних дослідженнях ми спостерігали незначні відмінності у всіх досліджуваних параметрах здоров'я або в межах будь-якої лінії клітин, що досліджувались у периферичній крові або кістковому мозку у мишей, які отримували мобілізаційні фактори з подальшою підставною трансплантацією, що дало вагомі докази відсутності довгострокових побічних ефектів, незважаючи на потенційну проліферацію мієлоїдних клітин (Knudsen et al., 2011).
4 ЕКСПЕРИМЕНТАЛЬНІ ПРОЦЕДУРИ
4.1 Миші
Усі процедури на тваринах виконувались відповідно до керівних принципів Національного інституту охорони здоров’я (NIH) та були затверджені Інституційним комітетом з догляду та використання тварин Наукового центру охорони здоров’я Техаського університету в Сан-Антоніо (UTHSCSA). Засновники колоній (C57BL/6J, GFP - миші) були отримані від Національного інституту старіння (NIA, Бетесда, Меріленд), що походять із колонії річки Чарльз. Засновники колоній (C57BL/6J, GFP +) були отримані з власного запасу мишей C57BL/6J (C57BL/6-Tg (CAG-EGFP) 131Osb/LeySopJ) з лабораторії Джексона. Донорські миші були розміщені та вирощені в лабораторії тваринницьких ресурсів UTHSCSA у стандартних умовах: 12-годинний цикл світло/темрява, 20–22 ° C, доступ до їжі (Purina Lab Chow) та води у вентильованих стелажах із пластиковими клітинами вистелена підстилкою з подрібненого або поголеного дерева. Воду міняли, клітини оновлювали щотижня. Розмноження самок однобітків відбулося досить довго, щоб задовольнити потреби клітин донорів при співвідношенні донора до мишей-реципієнтів за цикл трансплантації (тобто 20 мишей-донорів на кожних 10 мишей-реципієнтів за цикл трансплантації). Усі процедури миші наведені на малюнках 2a та S4a.
4.2 Кондиціонування на основі мобілізації HSC
4.3 Кондиціонування на основі опромінення
Тільки для дослідження порівняння химеризму (рис. 2д) мишам-реципієнтам було дано 1050 сантиграїв (cGy, 123 Cs γ-променів) загального опромінення тіла (
80 сГр/хв). Вісімтижневі GFP + негативні донорські клітини (5,0 × 10 6) були трансплантовані в кожну опромінену реципієнтну мишу шляхом ін'єкції хвостової вени. Гентаміцин в кінцевій концентрації 1,0 мг/мл додавали до питної води, починаючи за тиждень до опромінення і продовжуючи до чотирьох тижнів після трансплантації. Клітки міняли через день. Загальний стан здоров’я опромінених реципієнтів контролювали двічі на день на предмет крайньої втрати ваги та оцінки поганого стану тіла. Тварин, які мають слабкі ознаки здоров'я, було вилучено з дослідження.
4.4 Збір донорських клітин
Усі миші-донори, які використовувались під час збору клітин, відповідали за статтю (самки) та генотипу (похідні NIA) з реципієнтами. Молоді, жіночі миші-донори GFP + (віком 8–10 тижнів) були отримані з нашої власної колонії самок мишей C57BL/6J, заснованих на тваринах, отриманих спочатку з лабораторії Джексона. Молоді, жіночі, миші-донори GFP (віком 8–10 тижнів) були виведені від засновників колоній, отриманих спочатку з NIA. У день трансплантації донори були евтаназовані через вивих шийки матки перед збором клітин кісткового мозку шляхом видалення та промивання гомілок, стегнових кісток, плечових кісток та кісток стегна за допомогою модифікованого середовища Дульбекко Іскове (IMDM), що містить 0,5% гепарину. Після лізису червоних кров'яних клітин та центрифугування клітини, від'ємні від лінії крові, виділяли за допомогою набору Lineage Cell Depletion Kit (Miltenyi Biotec Inc.) відповідно до протоколу виробника.
4.5 Оцінка довголіття
4.6 Вікова специфіка смертності
Миттєвий рівень смертності в кожному віці обчислювали за допомогою кусково-поліноміальної моделі небезпеки B-сплайну, припускаючи розподіл Пуассона (Lambert & Eilers, 2005), використовуючи bshazard пакет (Rebora, Salim, & Reilly, 2014).
4.7 Кількісна оцінка вікового дефіциту здоров'я
4.8 Оцінка споживання їжі
Починаючи з 19-місячного віку, середнє споживання їжі розраховували для кожної групи мишей щомісяця до закінчення терміну дії тварин. Середнє споживання їжі вимірювали, реєструючи початкову загальну масу їжі, що міститься в клітці, з подальшим вимірюванням маси їжі, що залишилася через двадцять чотири години. Різницю в масі між початковою наявною їжею та їжею, що залишилася через двадцять чотири години, ділили на загальну кількість мишей, присутніх у клітці, перед усередненням з мишами з усіх клітин, виміряних у кожній групі. Масу їжі вимірювали за допомогою компактної шкали CS200 (Ohaus). Крім того, перед кожним записом клітини перевіряли на наявність харчових крихт. Крихти очищали з кліток під час первинного вимірювання їжі. Крихти, знайдені через двадцять чотири години після первинного вимірювання, додавали до загальної кількості їжі, щоб забезпечити точний запис споживання їжі. Якщо термін дії миші закінчився протягом двадцяти чотирьох годинного вікна, в якому вимірювали їжу, розрахунок відкидали і починали нове вимірювання з новою кількістю доступних мишей.
4.9 Оцінка маси тіла
Починаючи з 19-місячного віку, середню масу тіла розраховували для кожної групи мишей щомісяця до закінчення терміну дії тварин. Масу тіла вимірювали, реєструючи масу окремих мишей за допомогою компактної шкали CS200 (Ohaus), і усереднювали для всіх мишей у кожній групі. Вимірювання проводили приблизно в один і той же час кожного місяця.
4.10 Аналіз периферичної крові
Зразки крові (40 мкл) відбирали у мишей через обрізання хвоста в пробірки для мікрофуг, що містять 40 мкл поточного буфера (PBS + 2,0% FBS) та гепарин при об'ємному співвідношенні 3: 1 (запас 1000 одиниць USP/мл). Після лізису еритроцитів (буфер лізису еритроцитів, Sigma-Aldrich) зразки інкубували з блокаторами Fc-рецепторів, специфічними для миші CD16/32, та наступними антитілами (розведення 1: 100) на льоду протягом 20 хв: Ghost Dye ™ Violet 510, анти-Cd45R/B220-PE, анти-Cd3e-Тихоокеанський синій, анти-CD11b-PerCP-Cy5.5, анти-Ly-6G/Ly-6C-APC-Cy7 (Gr-1), анти-CD4-BV605, та анти-CD8-Alexa Fluor 647. Клітини центрифугували, повторно суспендирували та фільтрували безпосередньо перед аналізом у проточному цитометрі BD LSRII (BD BioSciences).
4.11 Аналіз гемопоетичного попередника
Весь кістковий мозок збирали шляхом промивання гомілок, стегнових кісток, плечових кісток та кісток стегна. Після лізису еритроцитів, негативні за лінією клітини виділяли за допомогою набору Lineage Cell Depletion Kit (Miltenyi Biotec Inc.) відповідно до інструкцій виробника. Негативні клітини пофарбовували на льоду блокаторами Fc-рецепторів, специфічними для миші CD16/32 (BD Pharmingen ™) та відповідними коктейлями з антитілами, щоб визначити відсоток кожного відділу попередника. Клітини LT-HSC, ST-HSC та MPP фарбували анти-Sca-1-V-500-Ly 6A/E, анти-c-Kit-BV421-CD117, anti-Flk-2-PE-CF594-CD135 та анти-CD34 ‐ Alexa ‐ Fluor 647 протягом 20 хв. Клітини центрифугували, повторно суспендували в поточному буфері (PBS + 2,0% фетальної бичачої сироватки), а потім пропускали через фільтр 40 мкм безпосередньо перед аналізом у проточному цитометрі BD LSRII (BD BioSciences).
4.12 Статистичний аналіз
ПОДЯКІ
Ми вдячні Е. Крайгу та М. Язвінському за допомогу та поради щодо цього проекту.
КОНФЛІКТ ІНТЕРЕСІВ
Автори заявили, що додаткового конфлікту інтересів не існує.
ВНОСИ АВТОРА
M.J.G., R.A.F., K.M.G., C.J.C та S.L. розроблені дослідження та проаналізовані дані. J.A.G. та R.J.S. надав критичну наукову, статистичну та технічну інформацію. M.J.G. проводив усі експериментальні роботи за допомогою C.C., A.B. та G.G. S.L., J.F.N. та R.A.C. керував проектом. М.Г. написав рукопис за допомогою J.A.G., Y.L., J.F.N., R.S., P.J.S., R.A.C. та S.L., R.A.C., C.C. та M.J.G. подали попередню заявку на патент.
ЕТИЧНЕ Схвалення
Процедури всіх експериментів на тваринах були розглянуті та затверджені Інституційним комітетом з догляду та використання тварин (IACUC) Техаського університету охорони здоров'я Сан-Антоніо.
Відкрите дослідження
Усі дані, пов’язані з цим дослідженням, містяться в роботі або в додаткових матеріалах.
Зверніть увагу: Видавець не несе відповідальності за зміст або функціональність будь-якої допоміжної інформації, наданої авторами. Будь-які запити (крім відсутнього вмісту) слід направляти до відповідного автора статті.
- Новий спосіб активізації стовбурових клітин для росту волосся - ScienceDaily
- Наночастинки плюс стовбурові клітини дорослих руйнують наліт, дослідження виявили - ScienceDaily
- Молочний інгредієнт для схуднення у мишей
- Гормон бореться з жиром та жиром. Орексин запобігає ожирінню у мишей, активуючи спалюючи калорії коричневий жир
- Іоноселективні датчики на основі лазерного індукованого графену для оцінки рівня гідратації людини за допомогою