Транскрипційна дисрегуляція аутофагії жирових тканин при ожирінні
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Національний інститут біотехнологій в Негеві, Університет Бен-Гуріона в Негеві, Беер-Шева, Ізраїль; і
Національний інститут біотехнологій в Негеві, Університет Бен-Гуріона в Негеві, Беер-Шева, Ізраїль; і
Кафедра мікробіології та імунології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Національний інститут біотехнологій в Негеві, Університет Бен-Гуріона в Негеві, Беер-Шева, Ізраїль; і
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Кафедра клінічної біохімії та фармакології, Університет Бен-Гуріона, Негев, Беер-Шева, Ізраїль;
Національний інститут біотехнологій в Негеві, Університет Бен-Гуріона в Негеві, Беер-Шева, Ізраїль; і
Анотація
Зростає інтерес до розуміння того, як нерегульована аутофагія може сприяти патогенезу захворювання. Найчастіше хворобливі стани асоціюються зі зниженою аутофагією, що в основному пояснюється генетичними варіаціями в генах аутофагії та/або дисфункціональними механізмами посттранскрипції. У жировій тканині людини (АТ) при ожирінні експресія генів аутофагії підвищується, і аутофагія, ймовірно, активується, пов’язуючи це з жировою дисфункцією. У цьому огляді досліджується нова роль транскрипційних механізмів, що регулюють аутофагію АТ при ожирінні.
Аутофагія - це еволюційно збережений клітинний процес, який націлений на внутрішньоклітинні компоненти для дезодації лізосом. Основними його цілями є переробка поживних речовин із існуючих клітинних компонентів в умовах дефіциту поживних речовин та усунення пошкоджених або непотрібних органел та білків. Таким чином, аутофагія служить механізмом ведення домашнього господарства і в основному причетна до захворювань, коли її активність низька. Однак надмірне споживання клітинних компонентів внаслідок надмірно активованої аутофагії може також порушити клітинні функції та сприяти патогенезу. Дійсно, аутофагія може амбівалентно підтримувати або загибель клітин, або виживання, залежно від делікатного, залежного від контексту регулювання (8). Таким чином, клітинний гомеостаз залежить від ретельної регуляції аутофагії, і як його ослаблення, так і надмірна активація можуть сприяти патогенезу різних захворювань.
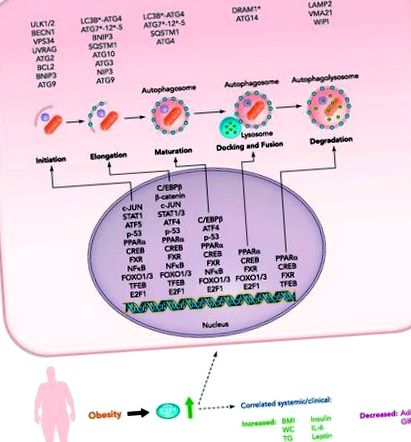
ФІГУРА 1.Транскрипційна регуляція аутофагії жирової тканини передбачуваними та підтвердженими (E2F1) факторами транскрипції при ожирінні
Нещодавно накопичені дані свідчать про те, що аутофагія регулює ліпідний обмін, доповнюючи його участь у деградації глікогену та білка (31, 32, 38, 61, 63). Показано, що ліпофагія, автофагічне поглинання та гідроліз цитозольних крапель ліпідів, функціонує як метаболічний шлях для розпаду крапель ліпідів та мобілізації ліпідів, створюючи тим самим альтернативний/додатковий шлях до «класичного ліполізу» цитозольними ліпазами (70). . Однак це в основному вивчали в неадипоцитах, залишаючи в основному невивчену роль аутофагії у основному типі клітин, відповідальних за зберігання та вивільнення ліпідів у всьому тілі, особливо в умовах грубих змін у зберіганні ліпідів, як при ожирінні. Розвиток і диференціація жирової тканини (АТ) тепер реалізується в залежності від інтактної аутофагії: генетичні підходи для втручання в процес (наприклад, вибивання генів аутофагії ATG5 в преадипоцитах або специфічна для адипоцитів делеція ATG5 або ATG7) призводять до неможливість завершити диференціацію адипоцитів і при AT, що нагадує коричневий жир (1, 11, 64).
До недавнього часу вважалося, що аутофагія в основному регулюється білково-білковими взаємодіями АТГ та їх посттрансляційними модифікаціями, зокрема фосфорилюванням (21, 28). Однак тепер зрозуміло, що контроль транскрипції генів аутофагії також жорстко регулюється зростаючою кількістю факторів транскрипції, більшість з яких також відомі як регулятори генів, що беруть участь в інших клітинних шляхах, включаючи обмін речовин, реакцію на стрес і клітинний цикл (13, 15). Як і в інших аспектах аутофагії, такі механізми можуть бути в значній мірі залежними від клітинного типу та контексту, специфічність, яка може лежати в основі деяких суперечливих повідомлень у літературі. При AT при ожирінні особливо заслуговують на увагу кілька міркувань/попереджувальних приміток.
1) Ожиріння - це хронічний стан надлишку поживних речовин. Класично, як деградаційний/катаболічний шлях, в основному відомо, що аутофагія активується шляхами, які опосередковують дефіцит поживних речовин/низький енергетичний стан. Сюди входять низька активність мішені ссавців комплексу рапаміцину 1 (mTORC1) та активованої АМФ-активованої протеїнкінази (АМРК). І навпаки, аутофагія гальмується сигналами про надлишок поживних речовин (як інсулін). Дійсно, перше дослідження, яке повідомляло про активацію аутофагії в адипоцитах, припустило, що основним механізмом є низька активність mTOR, результат інсулінорезистентності (46). Регулювання рівня транскрипції може запропонувати вхід для активації аутофагії іншими тригерами, більше пов'язаними з перевантаженням поживних речовин, такими як різні реакції на стрес/реакційні шляхи [стрес, окислювальний та ендоплазматичний ретикулум (ER), запалення та ін.].
2) Хоча механізми розвитку походження ожиріння у дорослих представляють великий інтерес, ожиріння часто виникає у стані після розвитку. Таким чином, це зрілі адипоцити, а не диференціюючі попередні адипоцити, в яких аутофагія активується при ожирінні. Сучасні генетичні моделі мишей не дають уявлення про те, як активована аутофагія у зрілих адипоцитах змінює їх функцію. Тим не менше, транскрипційна регуляція аутофагії в таких клітинах, ймовірно, залучає фактори транскрипції, виражені у зрілих адипоцитах.
3) AT складається з різноманітної популяції клітин, яка включає адипоцити, судинні клітини та різні імунні клітини, особливо при ожирінні. На моделях мишей, які можуть перебільшити стійкість асоційованого із ожирінням запалення АТ порівняно із ожирінням людини, макрофаги, за оцінками, становлять до 50% популяції клітин тканини. Специфічність клітинного типу регуляції аутофагії вимагає ретельного врахування, коли мова йде про АТ при ожирінні: Як уже згадувалося раніше, зміни цілої тканини можуть затуляти унікальну регуляцію аутофагії в конкретній популяції клітин АТ та/або можуть відображати зміни клітинного стану, пов’язані з ожирінням склад тканини.
У цьому огляді розглядаються транскрипційні регуляторні механізми аутофагії в адипоцитах та АТ при ожирінні шляхом узагальнення недавньої інформації з цієї теми. По-перше, ми коротко повідомляємо про результати, що свідчать про E2F1, на даний момент єдиний транскрипційний фактор, експериментально пов’язаний з експресією гена активованої АТ-аутофагії. Потім ми розглядаємо кілька ймовірних механізмів регуляції транскрипції АТ-аутофагії, розглядаючи фактори транскрипції, які, як відомо, регулюють аутофагію в інших тканинах, але які, як відомо, експресуються та регулюють експресію генів в адипоцитах та/або неадипоцитарних клітинах, присутніх в АТ. Нарешті, ми розглядаємо потенційні механізми, за допомогою яких нерегульована аутофагія АТ може призвести до жирової дисфункції та сприяти серцево-метаболічній захворюваності, пов’язаній з ожирінням.
У AT людини нещодавно ми показали, що рівень білка E2F1 та рівня мРНК підвищується при ожирінні, що корелює з підвищеною експресією ATG5 та LC3B (19) (ФІГУРА 1). Це було особливо очевидним при сальниковій, а не підшкірній AT пацієнтів із ожирінням, у яких ожиріння асоціюється з високим ризиком серцево-метаболічної захворюваності. Додатково обґрунтовуючи цей зв’язок на молекулярному рівні, аналіз хроматину-імунопреципітації (ChIP), оптимізований для використання зі свіжими експлантатами цілого людського AT (20), виявив підвищене зв’язування E2F1 з передбачуваним сайтом зв’язування E2F1 в промоторі LC3B у людей із ожирінням (19, 20 ). Цікаво, що експресія AT E2F1 не корелювала з маркерами проліферації, такими як маркер проліферації Ki-67 (Mki67), зв'язування E2F1 зі своїм класичним цільовим клітинним циклом E2F1 (циклін D1) не збільшувалось при ожирінні, а підвищена експресія E2F1 сприяла головним чином адипоцитарною (нібито непроліферуючою) клітинною фракцією.
РИСУНОК 2.E2F1-опосередкована транскрипційна регуляція MAP1LC3B (LC3) та аутофагія
мРНК (A) і білка (B) експресія E2F1 та MAP1LC3B (LC3) у двох парних депо жирової тканини людини [підшкірному (Sc) та сальниковому (Om)]. Дані отримані з двох раніше описаних когорт (Лейпциг, n = 437; Пиво Шева, n = 69) у небідних (ІМТ 2) та осіб із ожирінням (ІМТ ≥ 30 кг/м 2). Суттєва різниця Om та Sc в тій самій групі ІМТ: **P ## P ### P ### Істотна різниця ОМ ожирілих та Ом Нобебез (P # Істотна різниця між вмістом TNF E2F1 та вмістом E2F1 (P
У наступному розділі описані вибрані можливі регулятори експресії AT ATG. Ми розглядаємо їх правдоподібну участь у регуляції аутофагії AT на основі двох критеріїв: 1) опублікував роль автофагії-регулятора цих факторів транскрипції в клітинах нежирової тканини; 2) їх неавтофагічні функції в біології АТ. Додаткові потенційні регулятори транскрипції АТ-аутофагії, які не детально описані в тексті, коротко представлені в таблиці 1.
- Фізіологічна та патофізіологічна роль таурину в жировій тканині щодо ожиріння
- Специфічний клітинний тип транскриптома в жировій тканині людини та вплив ожиріння на адипоцит
- Вплив старої АРТ на перерозподіл жирової тканини та ризик ССЗ може бути
- Втрата ваги та супутня жирова аутофагія у мишей з обмеженим ожирінням метіоніном не залежить
- Роль вісцеральної жирової тканини в патогенезі безалкогольної жирної хвороби печінки