Тонкі плівки ДНК-платина для використання в дослідженнях хіміопроменевої терапії
Мохаммад Резі
Групи наук про радіацію, Департамент медицини та радіобіології, Факультет медицини та науки Санта, Університет Шербрук, Шербрук, КК, Канада J1H5N4
Елахе Алізаде
Групи наук про радіацію, Департамент медицини та радіобіології, Факультет медицини та науки Санта, Університет Шербрук, Шербрук, КК, Канада J1H5N4
Дарель Полювання
Групи наук про радіацію, Департамент медицини та радіобіології, Факультет медицини та науки Санта, Університет Шербрук, Шербрук, КК, Канада J1H5N4
Леон Санче
Групи наук про радіацію, Департамент медицини та радіобіології, Факультет медицини та науки Санта, Університет Шербрук, Шербрук, КК, Канада J1H5N4
Анотація
1. Вступ
10 нм) LEE у біологічних речовинах, такі дослідження необхідно проводити на дуже тонких плівках ДНК подібної товщини. Тонкі плівки Pt-ДНК можуть надати експериментальний підхід для дослідження безпосереднього впливу вторинних електронів та інших частинок короткого діапазону (або вторинних видів) на ДНК в присутності сполук Pt. Такі дослідження можуть розкрити механізми, що лежать в основі синергетичного ефекту між опроміненням та препаратом, що може мати наслідки для оптимізації протоколів у ЕПТ, а також для розробки та розробки нових хіміотерапевтичних та радіосенсибілізуючих препаратів [14].
Такі сполуки Pt, як цисплатин і карбоплатин, зв'язуються з атомом N7 пуринових основ і продукують аддукти Pt-ДНК, включаючи переважно внутрішньоланцюгові зшивки, міжрядові зшивки та монофункціональне зв'язування з гуаніном [24]. Аддукти спотворюють конформацію ДНК і знижують структурну стабільність ДНК [24, 25]. Більше того, ДНК повинна переносити умови інкубації, необхідні для реакції з сполуками Pt. У більшості досліджень in vitro розчин ДНК змішують з розчином сполук Pt при 37 ° C протягом 24 або 48 годин [26–30]. Ці умови впливають на цілісність ДНК в результаті процесів дедуринації та окислення [31]. Щоб максимізувати кількість сполук Pt, зв’язаних з ДНК, зберігаючи при цьому ДНК цілою, всі параметри, що беруть участь у підготовці плівок, повинні бути відомі та ретельно контролюватися. Зокрема, мають бути визначені експериментальні умови реакції сполук Pt з ДНК, а також вплив хімічного зв’язку сполук Pt на стабільність ДНК.
У цьому дослідженні ми досліджуємо параметри сполук Pt та реакції платинування на цілісність ДНК при приготуванні плівок цисплатин/ДНК та карбоплатин/ДНК. Визначено оптимальні експериментальні умови для збереження високої частки перекрученої форми плазмідної ДНК у плівках Pt-ДНК.
2. Експериментальна секція
2.1. Підготовка плазмідної ДНК
ДНК плазміди (pGEM-3Zf (-), 3197 пар основ, приблизно 1968966 а. М. На плазміду) витягували з Escherichia coli JM109 та очищали набором плазміди HiSpeed Maxi (QIAGEN) [32]. Очищена плазмідна ДНК складалася з 96% суперспіральованих, 2% канкатемерних та 2% круглих форм. Потім розраховували концентрацію ДНК та відносну кількість білків у розчині плазмідної ДНК, вимірюючи співвідношення ультрафіолетового (УФ) поглинання ДНК та білка при 260 нм та 280 нм відповідно за допомогою спектрофотометра Synergy HT-I. Співвідношення становило 1,98, що відповідає чистоті понад 85% [33]. ТЕ-буфер (Tris-EDTA: 10 мМ – 1 мМ) відокремлювали від ДНК гель-фільтрацією із середовищем Sephadex G-50 [34]. Таким чином, кінцевий розчин складався з ДНК і ddH2O після фільтрації. Для оцінки впливу Tris на зв'язування сполук Pt з ДНК були підготовлені дві різні групи розчинів ДНК. У першій групі до розчину ДНК додавали буфер Тріс у співвідношенні однієї молекули трису на нуклеотид, а у другій групі розчин ДНК готували лише з ddH2O. Концентрація ДНК була однаковою в обох групах. У кожній групі контрольні зразки витримували при температурі -20 ° C і визначали кількісно для аналізу температурного впливу на ДНК.
2.2. Платифікація плазмідної ДНК
2.3. Аналіз зв'язування платини і ДНК
Концентрацію платини в розчинах вимірювали методом мас-спектроскопії плазми Elan DRC II з індуктивно зв'язаною плазмою (ICPMS, від Perkin Elmer), яка використовувалася як придатний метод для вимірювання платини у багатьох біомедичних програмах [37, 38]. Крім того, три контрольні зразки, що складаються із сполук Pt, розчинених у ddH2O у відомих концентраціях, також були підготовлені для калібрування вимірювань ICPMS зразків Pt-ДНК. Концентрацію ДНК вимірювали за допомогою спектрофотометрії. Його визначали з оптичної щільності ДНК у розчині, виміряної поглинанням УФ на довжині хвилі 260 нм. Концентрацію ДНК розраховували за еталонною оптичною щільністю.
2.4. Приготування плівки субстрату, ДНК та Pt-ДНК
2.5. Кількісне визначення плівок ДНК та Pt-ДНК
2.6. Статистичний аналіз
Для статистичного та математичного аналізу використовувалось програмне забезпечення OriginPro 8.1 SR1 (OriginLab Corporation). Парним t-критерієм був статистичний тест, в якому ймовірність 0,05 (5%) вважалася значущою.
3. Результати та обговорення
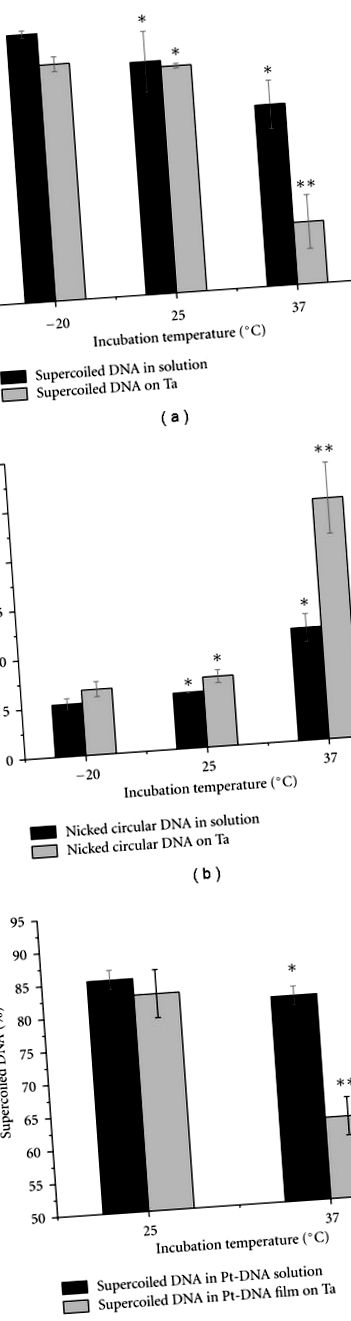
3.1. Вплив температури інкубації на зразки ДНК та Pt-ДНК
3.2. Кінетика зв'язування сполук Pt з ДНК
Кінетика зв'язування сполук Pt з плазмідною ДНК. Сполуками Pt є: (а) цисплатин з початковим співвідношенням у розчині 20: 1, (b) 200: 1 та (c) карбоплатин з початковим співвідношенням 40: 1 та (d) 200: 1. криві показують кількість зв’язаних сполук Pt на молекулу ДНК за різного часу інкубації при 25 ° C. Дані в (а) - (г) є засобами трьох вимірювань; Похибки відображають стандартні відхилення. Неперервні чорні лінії експоненціально відповідають даним.
Оскільки сполуки Pt можуть реагувати з більшістю буферів [42], їх концентрація також є важливим параметром у процесі платинування ДНК (тобто буфери конкурують з ДНК за зв'язування сполук Pt). Тріс широко використовується як буфер, особливо для розчинів нуклеїнових кислот. Він також реагує із сполуками Pt, утворюючи цис- [Pt (NH3) 2 (N-Tris) (OH)] + та цис- [Pt (NH3) 2 (N, O-TrisH − 1)] + [43]. Гістограми на малюнку 3 показують порівняння зв’язаних сполук Pt із співвідношеннями ДНК для трьох різних часів інкубації при 25 ° C для двох різних розчинів: (i) суміші ДНК, цисплатину та ddH2O та (ii) суміші ДНК, цисплатин, ddH2O та трис із співвідношенням концентрацій нуклеотиду 1: 1. Початкове відношення концентрації цисплатину до ДНК у розчинах становило 20: 1. Результати демонструють, що відношення зв’язаного цисплатину до ДНК більш ніж подвійне, коли реакція платинування відбувається в розчині ddH2O без молекул трису.
Вплив трису на реакцію платинування ДНК. Співвідношення Pt-ДНК у розчинах цисплатин-ДНК, інкубованих протягом 45, 90 та 180 хвилин при 25 ° C, порівнюють за наявності та відсутності трису. Дані є засобами трьох вимірювань; Похибки відображають стандартні відхилення.
3.3. Вплив часу інкубації на плівки ДНК та Pt-ДНК
Стовпчасті графіки на малюнку 4 показують порівняння відсотка суперспіральованих зразків ДНК та Pt-ДНК, які інкубували при 25 ° C протягом 2, 4 та 8 годин. Аналізи проводили для зразків, які були вилучені (i) з розчину, відразу після інкубації (рис. 4 (а)), (ii) з плівок, нанесених на Ta (рис. 4 (б)). Зразки Pt-ДНК готували або з цисплатином, або з карбоплатином. Початкове відношення концентрації сполук Pt до ДНК становило 200: 1, а буфера ТЕ - три органічні іони на нуклеотид. Як видно з малюнка 4, більше 90 відсотків ДНК у зразках, витриманних протягом 2 годин, знаходиться у суперспіральній формі. Частка суперспіральної форми зменшується, коли зразки інкубують протягом 4 годин і більше. Зменшення є статистично значущим у всіх зразках, крім зразка чистого розчину ДНК. Як і слід було очікувати, зменшення є більшим у плівках Pt-ДНК, ніж у зразках ДНК. Таким чином, можна приготувати плівки Pt-ДНК з високою часткою перевитої ДНК при різних співвідношеннях зв'язаного Pt до ДНК, змішуючи ДНК з високими концентраціями розчину Pt-з'єднання і обмежуючи тривалість інкубації менше 2 годин, якщо температура інкубації не перевищує 25 ° C.
Порівняння відсотків суперспіральованих форм у зразках ДНК, цисплатину-ДНК та карбоплатину-ДНК (a) у розчині та (b) на підкладці Ta після інкубації протягом 2, 4 та 8 годин при 25 ° C. Дані є засобами трьох вимірювань; Похибки відображають стандартні відхилення. * позначає значення P> 0,05, ** позначає значення P На малюнку 5 (a) показано міграцію різних форм цисплатину-ДНК в гелі для електрофорезу. Рухливість обрізаних кругових, какатемерних та суперспіральованих смуг змінюється зі збільшенням кількості зв'язаних молекул Pt на нуклеотид (R b). Зміна зумовлена спотворенням різних форм ДНК цисплатином, оскільки відомо, що зшивки Pt-ДНК викликають конформаційні зміни в ДНК, включаючи вкорочення (згинання) та розмотування [44, 45]. Спотворення стає більшим залежно від кількості зв’язаних молекул Pt. На рисунку 5 показана залежність рухливості суперспіральованих, прорізаних кругових та канкатемерних форм зразків цисплатин-ДНК як функція відношення R b в 1% агарозному гелі. Рухливість кожної форми Pt-ДНК нормалізується до тієї ж форми немодифікованого зразка ДНК (рисунок 5 (b)). Як видно з рисунка 5 (b), міграція конфігурацій кругової та надвитої конфігурації, як правило, збільшується із зростанням R b. Однак рухливість круглої форми, що розрізається, збільшується швидше, ніж у суперспіральної форми. Рухливість канкатемерної конфігурації зменшується із зростанням R b до 0,009, а потім збільшується для більш високого R b.
Рухливість молекул цисплатин-ДНК в агарозному гелі. (а) Міграція різних конфігурацій молекул цисплатин-ДНК, розділених електрофорезом. Доріжка 1 призначена для зразка ДНК, а смуги 2–5 - для зразків цисплатину-ДНК із кількістю зв’язаних молекул цисплатину на нуклеотид R b 0,0057, 0,008, 0,0091 та 0,0219 відповідно. (b) Нормалізована рухливість обрізаних кругових, суперспіральних і какатемерних форм зразків Pt-ДНК при різних R b в гель-електрофорезі.
Оскільки кількість молекул Pt на плазміду, ймовірно, представляє розподіл Пуассона для кожного співвідношення Pt-ДНК, це, як очікується, зменшить роздільну здатність агарозних гелів за рахунок збільшення дисперсії в кожній смузі (тобто ширини смуги). Лінійна плазмідна смуга лежить між прорізаними круговими та канкатемерними смугами; таким чином, збільшення ширини смуги може перешкоджати точному кількісному визначенню лінійної смуги, яка зазвичай слабша за інші. Крім того, розрізнені кругові та канкатемерні смуги зливаються внаслідок збільшення ширини смуги і утворюють одну смугу при R b = 0,022. Наші результати показують, що зміни рухливості суттєві для R b, що перевищує 0,005.
4. Висновок
Записуючи кінетику зв'язування сполук Pt з ДНК, можна екстраполювати різні співвідношення Pt-ДНК із кривих кінетики. Ми виявили, що частка суперспіральної ДНК становить більше 90% у плівці Pt-ДНК, коли реакцію платинування ДНК проводять при 25 ° C менше 2 годин у розчинах, що містять сполуку Pt, з кількістю менше 3 × 10 -2 молекули Pt на нуклеотид та мінімальна концентрація трис-буфера (одна молекула трису на нуклеотид). За цих умов електрофорез у агарозному гелі є точним методом кількісного визначення пошкодження ДНК. Ми також визначили, що максимальна кількість пов'язаного Pt-з'єднання на нуклеотид становить приблизно 5 × 10-3 за наших оптимальних умов. Цей коефіцієнт на порядок вищий за показники, виявлені в біологічних дослідженнях та клінічному застосуванні [46]. Однак ці високі співвідношення корисні для механістичних досліджень in vitro, в яких потрібні значні кількості продукту. Отже, ми виявили, що регулюючи початкову концентрацію сполук Pt у розчині, можна отримати плівки Pt-ДНК, що мають відоме контрольоване співвідношення платинових хіміотерапевтичних засобів до ДНК, зберігаючи цілісність ДНК.
Подяка
Фінансову підтримку цій роботі надали Канадський інститут досліджень охорони здоров’я (CIHR) та міжнародна програма вступних стипендій Марії Кюрі. Автори хочуть подякувати доктору Ендрю Д. Басу, містеру П'єру Клутьє та пані Соні Жиру за їхні корисні коментарі та пропозиції.
- Чи можете ви вважати себе тонким, чому ваш розум має значення для схуднення?
- Глікемічний індекс (GI) та глікемічне навантаження (GL) для житнього хлібця, середнє з 4 досліджень
- Електротерапія Як працює наша програма схуднення; Тонка терапія
- Лікування Карбоссі - лікувальний контур для тіла
- Діуретична терапія - огляд тем ScienceDirect