Тиреоїдит Хашимото погіршує імплантацію ембріонів, порушуючи морфологію ендометрія та маркери сприйнятливості у мишей з еутиреозом
Анотація
Передумови
Хоча вважається, що дисфункція щитовидної залози, спричинена тиреоїдитом Хашимото (ХТ), пов’язана з відмовою імплантації через недорозвинення сприйнятливої матки, невідомо, чи пошкоджує сама ХТ навіть у еутиреоїдному стані імплантацію ембріонів, пов’язану з дефектами сприйнятливості ендометрія. Для вирішення питання, чи може сам НТ впливати на сприйнятливість ендометрія, що супроводжується змінами імплантації, у мишей була встановлена модель еутиреоїдної НТ.
Методи
Самки мишей NOD двічі імунізували тиреоглобуліном та ад'ювантом для індукції експериментальної моделі НТ. Через чотири тижні після другої обробки мишей нормально спарювали, а вагітних жертвували у вікні імплантації для вимірювання параметрів щитовидної залози та стероїдних гормонів за допомогою електрохімілюмінесцентного імунологічного аналізу та імуноферментного аналізу та обчислення кількості місць імплантації шляхом поглинання барвника Chicago Blue . Крім того, певні морфологічні особливості сприйнятливості ендометрія спостерігали за допомогою фарбування гематоксилін-еозином та скануючої електронної мікроскопії, а експресію інших маркерів сприйнятливості аналізували за допомогою імуногістохімії, RT-qPCR або Western Blot.
Результати
Миші HT виявляли внутрішньотиреоїдну інфільтрацію моноцитів та підвищений рівень аутоантитіл до щитовидної залози без дисфункції щитовидної залози, що визначається як HT еутиреозу у людей. Еутиреоїдна НТ призвела до невдалої імплантації, зменшення кількості піноподів, відсталого дозрівання піноподів та пригнічення експресії маркерів сприйнятливості: рецептора естрогену α (ERα), інтегрину β3, фактора, що інгібує лейкемію (LIF), та молекули адгезії клітини-1 (ICAM-1). Цікаво, що, незважаючи на цю компрометовану реакцію сприйнятливості ендометрія, статистичних відмінностей у рівнях естрадіолу та прогестерону в сироватці крові між групами не виявлено.
Висновки
Ці висновки першими вказують на те, що ГТ індукує нерецептивне середовище ендометрія в еутиреоїдному стані, що може лежати в основі згубного впливу самого ГТ на імплантацію ембріонів.
Вступ
Для перевірки цієї гіпотези в цьому дослідженні побудована класична модель миші НТ [28], в якій самок мишей NOD активно імунізували свинячим тиреоглобуліном (pTg) і досліджували, чи змогла сама НТ вплинути на морфологію ендометрію та молекулярну експресію ендометрія гени, пов’язані зі сприйнятливістю, що супроводжуються компрометованою імплантацією ембріона у вікні імплантації.
Матеріали і методи
Реактиви та хімічні речовини
Свинячий тиреоглобулін (pTg), повний ад’ювант Фрейнда (CFA) та неповний ад’ювант Фрейнда (IFA) були від Sigma Chemical Co. (Сент-Луїс, Міссурі, США). Набір TSH ELISA був від Cloud-Clone Corp. (Ухань, Хубей, Китай). Набори E2 та P ELISA були від Cusabio Biotech Co., Ltd. (Ухань, Хубей, Китай). Комплект виявлення SPlink був від ZSGB-Bio (Пекін, Китай). Антитіла до рецепторів естрогену α, інтегрину β3 та GAPDH були від Abcam (Кембридж, штат Массачусетс, США). Антитіла до рецепторів прогестерону, LIF, ICAM-1 були від компанії Bioss, Inc. (Пекін, Китай). Реагент TRI був отриманий від Molecular Research Center, Inc. (Цинциннаті, Огайо, США). Набори без дезоксирибонуклеази, що не містять рибонуклеази (ДНКаза, що не містить РНКази), та набори зворотної транскрипції (RT) у режимі реального часу отримували від Promega Corporation (Медісон, Вісконсин, США). Light Cycler® 480 SYBR Green I Master Mix від Roche Diagnostics GmbH (Базель, Швейцарія). Всі інші реагенти були придбані у Sigma або як зазначено в Методах.
Тварини
Миші NOD (4 тижні, самки мишей: 10
13 г; самці мишей: 12
16 г) були придбані у Нанкінському біомедичному дослідницькому інституті Нанкінського університету (номер дозволу: 15–0001). Після 7 днів карантину всіх мишей утримували у специфічних умовах, вільних від патогенів, з вільним доступом до води та їжі в лабораторному центрі тварин Медуніверситету Аньхоя (номер дозволу: 17–006). Всі процедури на тваринах проводили відповідно до керівних принципів, встановлених Центром лабораторних наук про тварин та Асоціацією лабораторних наук про тварин при Медичному університеті Аньхої.
Імунізація та експериментальне проектування
Електрохімілюмінесцентний імуноаналіз (ECLIA)
Усі зразки сироватки та тканини зберігали при - 80 ° C до використання. Крім того, тканини ендометрію гомогенізували в 10 мкл/мг PBS, а потім супернатанти збирали центрифугуванням при 15000 × g протягом 15 хв при 4 ° C. Концентрації вільного трийодтироніну (FT3), вільного тетрайодтироніну (FT4), TPO-Ab та Tg-Ab у сироватці та супернатантах гомогенату ендометрія визначали за допомогою електрохімілюмінесцентного імунологічного аналізу (ECLIA) за допомогою аналізатора клінічної хімії Cobas e411 (Roche, Mannheim, Німеччина) . Набори безкоштовного трийодтироніну, FT4, TPO-Ab та Tg-Ab ECLIA були придбані у компанії Roche Applied Science. Процедури для ECLIA були докладно описані в інших місцях [29]. Результати визначали за допомогою калібрувальної кривої, яка була спеціально створена приладом за допомогою двоточкового калібрування, та головної кривої, наданої через штрих-код реагенту. Дані виражаються як міжнародні одиниці пікомолярів на грам гормону та на міліграм білка тканини ендометрія. Усі зразки проводили у двох примірниках, а середнє значення використовували як остаточне значення аналізу для кожного зразка. Коефіцієнти варіації для аналізів цих профілів щитовидної залози становили від 7,38 до 14,22%.
Імуноферментний аналіз (ІФА)
Решту зразків сироватки розморожували до кімнатної температури (18–25 ° C) для визначення кількості ТТГ, Е2 та Р кожного місяця, використовуючи їх відповідні набори ІФА згідно з інструкціями виробника. Для значення оптичної щільності (OD) поглинання кольору в пластинах вимірювали при 450 нм за допомогою зчитувача BioTek (Biotek Winooski, Вермонт, США). Дані виражаються як пікограми або нанограми на мілілітр гормону сироватки. Всі зразки проводили у двох примірниках, а середнє значення використовували як остаточне значення аналізу для кожного зразка. Коефіцієнти варіації для аналізів на стероїдні гормони та ТТГ становили від 7,24 до 9,84%.
Фарбування гематоксиліном та еозином (ВІН) та імуногістохімія (IHC)
Щойно зібрані щитовидної залози та матки фіксували у 4% параформальдегіді протягом 24 годин на шейкері, а потім вносили у парафіновий віск. З кожної тканини, вкладеної у парафін, послідовно розрізали коронкові зрізи (товщиною 3 мкм). Зразки щитовидної залози, забруднені гематоксиліном та еозином (ВІН), визначали кількісно для зони інфільтрації мононуклеарних клітин щитовидної залози відповідно до попереднього дослідження [30]: 0 = відсутність інфільтрації; 1 = один або два фолікулярних інтерстиції, накопичені запальними клітинами; 2 = одне або два запальних клітинні ураження, що досягають фолікулярних розмірів; 3 = 10–40% запальна інфільтрація клітин; 4 = більше 40% запальної інфільтрації клітин. Крім того, фарбування ВІН ендометрію аналізували для морфологічного спостереження за допомогою мікроскопа Olympus DP80 (Olympus, Токіо, Японія). У кожній матці випадковим чином було обрано принаймні 3 несуміжні ділянки для обчислення кількості залоз (збільшення 40 ×).
Імуногістохімію (ІГХ) проводили за допомогою набору для виявлення SPlink. Зрізи матки товщиною п’ять мікрометрів були встановлені на предметних стеклах, депарафіновані та регідратовані через ксилол та сортовий спиртовий ряд. Після кожного кроку зрізи промивали 3 рази PBS (по 3 хв). Після гасіння активності ендогенної пероксидази 3% -ним перекисом водню протягом 10 хв, пошук антигену проводили шляхом пропарювання зрізів 0,01 М цитратним буфером (pH 6,0) протягом 20 хв. Неспецифічні сайти зв'язування блокували 5% нормальною козячою сироваткою протягом 30 хв до появи специфічних первинних антитіл проти ERα (ab96867, 1: 250) та PR (bs23376R, 1: 500), протягом ночі при 4 ° C. Слайди інкубували протягом 30 хв з біотинільованим козячим анти-кролячим IgG з подальшою інкубацією 45 хв з міченим пероксидазою хрону комплексом авідин-біотину. Імунофарбування було розроблено із застосуванням діамінобензидину. Предметні стійки були забарвлені гематоксиліном, зневоднені та змонтовані за допомогою монтажного середовища.
Скануюча електронна мікроскопія (SEM)
Для оцінки морфології піноподів три матки в день E5 у кожній групі розрізали поздовжньо для оголення просвіту матки епітелієм, після чого обережно промивали поверхню зразка PBS і швидко фіксували в 2,5% глутаральдегіду. Закріплені зразки промивали 3 рази (по 15 хв.) В 0,1 М PBS, після фіксації в 1% тетроксиду осмію протягом 90 хв. Без світла, а потім промивали, як і раніше. Потім 3-мм 2 тканинні блоки зневоднювали через градуйований спиртовий ряд (30, 50, 70, 80, 90, 95, 100%) та 3% ацетону 3 рази (по 10 хв кожен), сушили рідким діоксидом вуглецю в сушарку для критичних точок (Quorum K850, Великобританія) та покритий паладієвим золотом за допомогою іонного розпилювача (IXRF MSP-2S, США) протягом 30 с. Скануючі мікрофотографії були отримані з трьох випадково вибраних поверхневих полів епітелію ендометрія на зразок для аналізу ефекту НТ на піноподи за допомогою скануючої електронної мікроскопії (Gemini SEM 500, Zeiss, Німеччина). Зафіксовано кількість піноподів на мікроскопічне поле (збільшення 5000 ×).
Зворотна транскрипція-кількісна ланцюгова реакція полімерази (RT-PCR)
Вестерн-блот
Статистичний аналіз
Усі дані представлені як середнє значення ± SEM, якщо не зазначено інше. Непарний двосторонній t-тест Стьюдента проводили для порівняння змінних між групами. Поширеність вагітності оцінювали за точним тестом Фішера. Місця імплантації та показник тиреоїдиту порівнювали за допомогою тесту Манна-Уітні. Всі графіки були зроблені з використанням програмного забезпечення GraphPad Prism версії 7.0 (GraphPad Software, Inc., CA, USA). Вестерн-блот і слайди імуногістохімії були відскановані, а кількість оцінена кількісно за допомогою Image-Pro Plus (Media Cybernetics, Inc., MD, США). Всі кількісні дані були проаналізовані за допомогою SPSS версії 16.0 (IBM, Armonk, Нью-Йорк, США). стор-значення
Результати
Створення моделі миші з еутиреоїдною HT на день E4.5
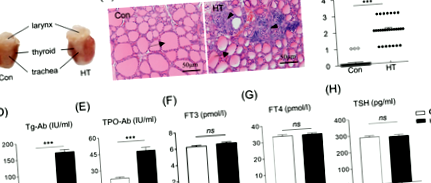
Як показано на рис. 1а, миші, імунізовані Tg, виявляли виражене дифузне збільшення щитовидної залози порівняно з контролем. Зрізи щитовидної залози, пофарбовані ВІН, показали, що у мишей Con є інтактні фолікули щитовидної залози і майже відсутні інфільтрація мононуклеарних клітин у тканині щитовидної залози. Тим часом миші HT знищили фолікули щитовидної залози та очевидну запальну інфільтрацію клітин у тканинах щитовидної залози (рис. 1b). Подальший підрахунок ступеня інтратиреоїдної запальної клітинної інфільтрації показав, що тяжкість тиреоїдиту у мишей HT була значно більшою, ніж у контрольної групи (P Рис. 1
Для підтвердження моделі мишей еутиреоїдної HT ми також проаналізували концентрації Tg-Ab та TPO-Ab, параметри функції щитовидної залози в сироватці крові. У моделі миші HT на день E4.5 рівні Tg-Ab і TPO-Ab в сироватці крові були значно вищими, ніж у контрольних мишей (165,54 ± 7,92 МО/мл проти 12,90 ± 0,34 МО/мл, n = 28, P Рис.2
Еутиреоїд HT порушує імплантацію ембріонів мишам
Спочатку ми дослідили, чи може еутиреоїдний ГТ вплинути на імплантацію ембріонів мишам. Макроскопічним видимим доказом успішної імплантації є локалізовані місця імплантації, які можна візуалізувати як сині вузлики шляхом поглинання 0,1 мл 1% розчину барвника Chicago Blue у день E4,5. На рис. 3а показані репрезентативні матки з місцями імплантації ембріонів (чорні стрілки) в обох групах. Контрольні миші мали щільні зародкові вузлики з рівномірним розподілом у тканинах матки. На відміну від цього, миші HT мали менше ембріональних вузликів, з нерегулярним розподілом і більшим ембріональним інтервалом, і навіть не мали ембріонів у розі матки. Подальший кількісний аналіз шляхом обчислення синіх вузликів у кожному розі матки показав, що кількість життєздатних імплантацій ембріонів на день E4,5 у групі НТ (13,22 ± 0,32) була меншою, ніж у контрольній групі (15,70 ± 0,56; стор = 0,002) (рис. 3б). Порівняно з контролем (100%, 10/10), група НТ продемонструвала тенденцію до зниження рівня поширеності вагітності (90%, 9/10) (рис. 3в).
Euthyroid HT індукує порушену морфологію ендометрія у мишей
Оскільки вищезазначені результати вказували на те, що еутиреоїдна НТ знижувала компетенцію імплантації ембріонів, ми потім оцінили вплив еутиреоїдної НТ на морфологію ендометрія в день E4,5 як показник сприйнятливості матки за допомогою спостереження ВН та СЕМ.
(1) Еутиреоїд HT викликає зміни в гістології ендометрія мишей
На малюнку 4А (а, в) видно, що ендометрій складався з просвіту епітелію, залозистого епітелію та строми. Як показано на рис. 4А (b, d), контрольні миші демонстрували нормальну децидуалізацію з акуратним і повноцінним просвітнім епітелієм, великим обсягом великих і розсіяних стромальних клітин, а також великими та розширеними залозами з секрецією в стромі. На противагу цьому, миші HT виявили невдалу децидуалізацію з відкритим і нерегулярним просвітом матки, неповний розвиток просвітного епітелію, щільних стромальних клітин і меншої кількості залоз. Нещодавнє дослідження з використанням моделі миші показало, що маточні залози відіграють важливу роль у своєчасній імплантації та децидуалізації, забезпечуючи тим самим життєздатність ембріона та успішність вагітності [32]. Тут кількісне визначення кількості ендометріальної залози/перерізу (N/CS) у матках показало, що еутиреоїдна НТ призвела до значного зменшення (53,33 ± 6,64 N/CS) порівняно з контрольною маточкою (22,33 ± 6,94 N/CS, n = 3, стор = 0,032) (рис. 4Б).
(2) Еутиреоїд HT впливає на розвиток піноподів ендометрія у мишей
Потім ми проаналізували просвітні епітелії маток, оброблених FA- і Tg, на наявність піноподів за допомогою SEM. Як показано на фіг. 5А (а, в), поверхня ендометрія контрольних мишей демонструвала відносно високу щільність піноподів, тоді як просвітня поверхня мишей НТ демонструвала значне зменшення кількості піноподів. Малюнок 5A (b, d) додатково ілюструє повністю розвинені піноподи з характерними куполоподібними кінцевими кінцями у мишей Con. Однак миші з НТ показали аномальні піноподи зі зморшкуватою або напівсферичною поверхнею в апікальній мембрані та рідкісним розподілом зрілих піноподів. Статистичний аналіз показав, що кількість піноподів у кожному мікроскопічному полі (N/EMF) у групі HT значно зменшилася (43,18 ± 5,39 N/EMF) порівняно з контрольною групою (94,45 ± 5,96 N/EMF, стор Рис.5
Еутиреоїд НТ не змінює сироваткової концентрації E2 або P у мишей
Встановлення сприйнятливості ендометрія координується за допомогою стероїдів естрадіолу (Е2) та прогестерону (Р). У цьому дослідженні ми вимірювали рівні E2 і P в сироватці крові вранці дня E4.5. Як показано на рис. 6а, ми не спостерігали значної різниці в сироватковій концентрації Е2 між групами. Концентрації Р також були подібними (рис. 6б).
Вплив еутиреоїдного НТ на сироваткові рівні E2 та P у мишей. a Вплив еутиреоїдного НТ на концентрацію Е2 у сироватці крові. b Вплив еутиреоїдного НТ на концентрацію Р в сироватці крові. Дані представлені як середнє значення ± SEM; n = 28, ns, не значуще, проти Con
Вплив Euthyroid HT на ендометрій ERα та експресію PR у мишей
Для вивчення впливу еутиреоїдного НТ на сприйнятливість ендометрія аналіз IHC показав, що імунозабарвлення ERα в групі НТ було імунопозитивним і суттєво зниженим в ядрі епітеліальних та стромальних клітин. Цікаво, що рівень ядерного PR ендометрія в стромальних клітинах був порівнянним між контрольною та НТ групами (рис. 7а). Відповідно до аналізу IHC, вестерн-блот-аналіз показав, що порівняно з контролем еутиреоїдний HT знижує регуляцію білка ERα (стор Рис.7
Еутиреоїд HT інгібує експресію інтегріну β3, ICAM-1 та галектину-3 в ендометрії миші
Для подальшого дослідження впливу еутиреоїдного НТ на сприйнятливість ендометрія у вікні імплантації аналізували експресію інтегріну β3, LIF та ICAM-1. Результати RT-PCR продемонстрували, що кількість мРНК інтегрину β3, LIF та ICAM-1 суттєво зменшилася у мишей HT порівняно з контролем (стор = 0,031, стор = 0,012, стор = 0,025 відповідно; 8а). Результати вестерн-блоттінгу підтвердили цей результат, і порівняно з контролем, кількість інтегрину β3, LIF та ICAM-1 в ендометрії в день E4.5 була знижена у мишей HT (стор = 0,017, стор = 0,016, стор Рис.8
Обговорення
Висновки
На закінчення ми дослідили вплив самої ГТ на репродукцію з точки зору імплантації ембріонів, яка є критичним етапом вагітності. Наші результати припустили, що еутиреоїдна НТ порушує імплантацію ембріонів через індукцію дефектів сприйнятливості ендометрія, включаючи змінену морфологію та порушену експресію ERα, інтегрину β3, LIF та ICAM-1 в ендометрії. Отримані нами результати могли б стати корисною основою для вивчення еутиреоїдного НТ при втраті вагітності. Крім того, це дослідження було зосереджене на сприйнятливій матці, яка є одним із основних факторів успішної імплантації ембріонів. Інші основні фактори, що мають відношення до регулювання імплантації ембріонів, такі як компетентні бластоцисти, слід вивчити в подальших дослідженнях.
- Тиреоїдит Хашимото у підлітків; дотикENDOCRINOLOGY
- Чи добре Кето для Хашимото; s Хвороба; Капітан подорожей
- Як запої погіршує загоєння зламаних кісток - ScienceDaily
- Ссавці не єдині тварини, які годують ембріон під час виношування плоду - ScienceDaily
- Тривале споживання дієти з високим вмістом жиру погіршує рухову координацію, не впливаючи на загальне