Сульфід водню пом’якшує тривожні, рухові та когнітивні дисфункції у щурів із гіпергомоцистеїнемією матері за рахунок пом’якшення окисного стресу.
Ольга Яковлєва
Ксенія Богатова
Рената Мухтарова
Олексій Яковлєв
Вікторія Шахматова
Олена Герасимова
Гузель Зіятдінова
2 Кафедра аналітичної хімії Казанського федерального університету, вул. Кремлевська, 18, 420008 Казань, Росія; ur.liam@gavonidtayiz
Антон Герман
3 Департамент біологічних наук, Університет Зальцбурга, Зальцбург 5020, Австрія; [email protected]
Гузель Ситдікова
Пов’язані дані
Анотація
1. Вступ
Сірководень (H2S), створений як третій газотрансмітер разом з оксидом азоту та оксидом вуглецю, ендогенно продукується в різних тканинах і опосередковує численні фізіологічні та патофізіологічні процеси [1,2]. У центральній нервовій системі H2S сприяє індукції довготривалого потенціювання [3], покращує пам'ять про страх у літніх щурів [4], модулює збудливість нейронів [5,6], підвищує рівень внутрішньоклітинного Са 2+, генерує хвилі Са 2+ в астроцитів [7], і бере участь у генерації та проведенні соматичного та вісцерального болю [8,9]. Недавні дослідження вказують на нейропротекторну роль H2S у різних неврологічних патологіях [10,11], включаючи хворобу Альцгеймера та [12] хвороба Паркінсона [13], епілепсію [14] або мозкову травму після ішемічного інсульту [15] через антиоксидантні особливості H2S [2,16].
Кілька авторів повідомили, що у виробництві H2S задіяні чотири ферментативні шляхи: β-синтаза цистатіоніну (CBS), γ-ліаза цистатіоніну (CSE) та 3-меркаптопіруват сульфуртрансфераза (3MCT) у поєднанні з цистеїн амінотрансферазою (CAT) і 3MCT в поєднанні з D-амінокислотною оксидазою (DAO) [2,11,17,18,19]. CBS та CSE є ферментами, залежними від 5-фосфату (PLP), що знаходяться в цитозолі, тоді як незалежний від PLP 3-MST в основному генерує H2S в мітохондріях. Експресія ферментів, що продукують H2S, є специфічною для тканини. CBS та 3-MST знаходяться переважно в центральній нервовій системі, хоча ці ферменти також присутні в периферичних тканинах, тоді як CSE рясно зустрічається в печінці та судинних та несудинних гладких м'язах [2,11,17,18,19].
Підвищений рівень гомоцистеїну впливає на концентрацію H2S та експресію/активність ферментів, що генерують H2S, in vitro та in vivo [11,20]. Інтрацеребровентрикулярна ін’єкція гомоцистеїну знижувала експресію CBS та CSE у гіпокампі щурів та призводила до дисфункцій навчання та пам’яті [35,36]. У нашому попередньому дослідженні введення донора H2S самкам щурів з hHcy під час вагітності відновлювало порушення розвитку потомства протягом перших 3 тижнів після народження [28]. Метою цього дослідження є оцінка впливу донора H2S на тривожність, рухову та когнітивну поведінку, рівень окисного стресу в тканинах мозку, концентрацію H2S та активність/експресію CBS у дорослих щурів з материнською hHcy.
2. Матеріали та методи
2.1. Тварини
Експерименти проводились із використанням щурів Wistar відповідно до Директиви ЄС 2010/63/EU для експериментів на тваринах та Місцевого етичного комітету Казанського федерального університету (протокол № 8 від 5 травня 2015 р.). Тварин розміщували в клітинах з поліпропілену (32 × 40 × 18 см) при контрольованій температурі (22–24 ° C), із світловим графіком 12:12 L/D (світло вмикається о 6:00) та вільним доступом до їжі води.
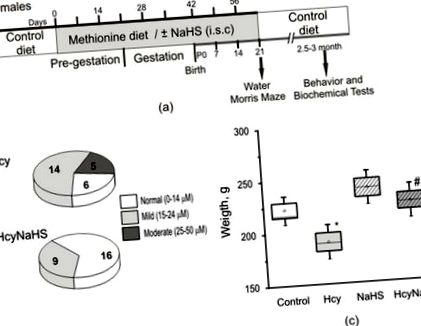
Вагітних щурів розподілили на чотири групи наступним чином: одну групу годували ad libitum контрольною дієтою (n = 7), друга група (n = 11) отримувала щодня метіонін (7,7 г/кг маси тіла) з їжею, починаючи з 3 тижнів до і під час вагітності та годування груддю до відлучення від грудей P21 [29,37]. Третя група (n = 4) отримувала донора H2S, гідросульфід натрію (NaHS) за три тижні до і протягом вагітності за наступним протоколом: 7 днів ін’єкцій чергували з 7 днями адаптації [28]. Щури четвертої групи (n = 4) отримували щоденно метіонін та ін'єкції NaHS згідно з вищезазначеними протоколами (рис. 1а). NaHS розводили у стерилізованому фізіологічному розчині та вводили підшкірно (внутрішньовенно) в дозі 3 мг/кг.
Тестування поведінки, аналіз окисного стресу та рівня H2S, активності та експресії ЦБС у тканинах мозку проводили у віці P72–90, за винятком тесту на лабіринт Morris Water, який проводили при P21–22 (рис. 1, а). Оскільки не було зареєстровано суттєвих відмінностей між самцями та самками щурів, дані були об’єднані для подальшого аналізу
2.2. Тестування поведінки
2.2.1. Відкрите поле
Рухову активність та тривожність аналізували за допомогою тесту на відкритому грунті. Щурів окремо розміщували на квадратній арені розміром 100 × 100 см зі стіною висотою 36 см, розділеною на 25 квадратів 20 × 20 см (Open Science, Москва, Росія), обладнаній відеосистемою. Щура помістили в центр відкритого поля і дозволили досліджувати апарат протягом 3 хв з відстеженням квадратних схрещувань, вирощування, догляду, дефекації та активності зони центра [38]. Кожній тварині була надана оцінка загальної рухової активності, обчислена як сума квадратних схрещувань та кількості тилів. Після кожного випробування відкрите поле очищали 70% етиловим спиртом і давали йому висохнути між випробуваннями.
2.2.2. Витривалість м’язів
Витривалість м’язів оцінювали за допомогою тесту на витривалість лапи (PaGE) [39]. Щурів клали на дротяну сітку і обережно струшували, щоб спонукати щура схопити сітку. Сітку було перевернуто догори дном над кліткою корпусу та утримували на
0,45 м над відкритим дном клітки. Оцінювали час (-і), проведений (-і) у сітці до падіння. Для аналізу було використано найбільше значення з трьох окремих досліджень.
2.2.3. Тест Ротарода
Тест Ротарода був використаний для оцінки рухової координації передніх і задніх кінцівок та рівноваги (Neurobotix, Москва, Росія) [40]. Кожного щура поміщали на стержень із швидкістю обертання десять обертів на хвилину (об/хв) і вимірювали час падіння та дистанцію бігу. Тварин піддають трьом послідовним тестовим сесіям (випробуванням) з інтервалом 20–30 хв. Зафіксовано найкращу затримку падіння з обертового стрижня [41].
2.2.4. Завдання насіння соняшнику та тест на обробку вермішелі
Завдання насіння соняшнику та тест на обробку вермішелі використовували для оцінки тонкого моторного контролю. У завданні насіння соняшнику була оцінена здатність тварин використовувати кінцівки та пальці під час споживання насіння соняшнику [42]. Тварин тренували три дні поспіль, а на четвертий день поведінку реєстрували та знімали на відео. Під час випробування щура поміщали в прозорий оргскло (50 × 50 × 50 см) з п’ятьма насінням соняшнику в кутку ящика. Було зафіксовано загальну кількість часу, яке щур витрачав на маніпуляції, розкриття та споживання насіння, а також кількість залишків шкаралупи. Експериментатор починав вимірювати час, коли тварина торкнулася першого насіння, і зупиняв таймер кожного разу, коли тварина відволікалася.
Під час випробування вермішелі щурам давали сирі вермішелі (довжиною 7 см і діаметром 1,5 мм) і спостерігали узгоджені асиметричні схеми руху лап і рота. Найчастіше щури тримають довгий шматок в обох лапах і рухають його в рот, використовуючи узгоджений асиметричний малюнок тримання, коли однією лапою утримують шматок цілим захопленням лапи, а іншою - для введення шматка в рот, часто підказки щодо цифр [43]. Атипові моделі поведінки оцінювали згідно з попередніми дослідженнями [43,44] і включали такі закономірності: (1) Лапи симетричні (без чіткого розділення функцій) при вживанні довгих макаронних виробів; (2) перемикання функцій лап з провідного на захоплення під час їжі; (3) одна з лап не контактує з макаронами під час їжі, лише для регулювання шматка макаронних виробів; (4) шматок макаронних виробів опускається під час їжі; (5) рот використовується для протягування шматка макарони через лапи; (6) згорблена поза, коли щур нахиляється над шматочком макаронних виробів і рухає ротом вниз, поки шматок стає менше. Тест складався з трьох випробувань із шматочками макаронних виробів, що давались по одному за кожне випробування. Щура поміщали в прозору оргскло і випробування знімали на відео для аналізу.
2.2.5. Двостороння тактильна стимуляція
Двосторонній тест на тактильну стимуляцію або видалення адгезиву був розроблений для оцінки асиметрій руху/сенсора через одностороннє пошкодження нігростріату або порушення, пов'язані з інсультом [45]. Щура поміщали в прозору оргскло і витримували протягом 1 хв. Потім щура підняли і на черевний бік кожної лапи поклали шматок стрічки (довжиною 1 см і шириною 3 мм). Потім щура помістили назад у коробку і дозволили йому видалити кожен шматок стрічки за допомогою зубів. Середній час видалення для кожного стимулу був розрахований із використанням середнього значення для трьох досліджень.
2.2.6. Тест "Світло-темна коробка"
Для оцінки занепокоєння щурів використовували світло-темний тест. Апарат світло-темної коробки ("Укриття", "Open Science", Москва, Росія) складається з двох однаково з'єднаних відділень - світлого та темного. Гризуни віддають перевагу темній зоні і водночас прагнуть досліджувати нове середовище. Ці дві суперечливі емоції призводять до помітної тривоги, як симптоми. Щура поміщали у світлий відсік і дозволяли досліджувати апарат протягом 3 хв. Вимірювали кількість входів та час перебування у світлому відсіку [46].
2.2.7. Т Лабіринт
Т-лабіринт був використаний для оцінки просторової робочої пам’яті в процесі спонтанного чергування [47]. Лабіринт виготовлений з невідбиваючого та стійкого до запаху матеріалу, оснащеного системою відеоспостереження (Open Science, Москва, Росія). У першому досліді щура поміщали у вихідну точку (стартову руку внизу «Т») і дозволяли досліджувати праву або ліву ворота протягом 3 хв. Після того, як щур увійшов до певного цільового плеча перехрестя “Т” між стартовим плечем та плечем ворота суперника було закрито. Щура залишали в лабіринті на 30 с для вивчення цільової руки, а потім поміщали на стартову руку на 30 с, перш ніж повторити біг. «Чергування» розглядалося, якщо щур потрапляв у протилежну руку порівняно з попереднім циклом. За 10 хв перерви було проведено ще два випробування з двома пробігами. Чергування в кожному дослідженні вважалося 33,3%, а у разі вибору протилежної руки в трьох дослідженнях щур набирав 99,9%.
2.2.8. Морріс Водний лабіринт
Водний лабіринт Морріса - широко використовуваний метод вивчення навчання та просторової пам’яті [48]. Водний лабіринт складається з круглого басейну (діаметром 1 м і глибиною 0,4 м), наповненого водою 26 ° C, куди додавали нежирне сухе молоко, щоб зробити воду непрозорою. Евакуаційна платформа була розміщена в одному із секторів басейну. Щуру дозволялося плавати і шукати платформу максимум 180 с. Тварину обережно опустили у воду. На початку щур плавав навколо краю басейну і шукав виходу. Зрештою тварина навчилася знаходити платформу і залізло на неї. Час, витрачений на пошук платформи та траєкторію плавання, оцінювали за допомогою системи відеоспостереження. Навчання оцінювалось за часом пошуку на платформі (затримка втечі), швидкістю плавання та дистанцією протягом шести послідовних випробувань. Для вимірювання просторової пам'яті для попереднього розташування платформи випробування зондів, при яких платформа була вилучена з пулу, проводились через 1 год та 24 год після останнього навчального випробування. Ми оцінили час, необхідний для досягнення цільового квадранту, де знаходилась платформа, і відносну кількість щурів, що плавали в цій області.
Траєкторію плавання аналізували вручну та визначали чотири основні типи поведінки: тигмотаксис, де тварина проводить більшу частину часу біля стіни; цільове сканування - сканування регіону навколо платформи; вторгнення, коли тварина все ще торкається стіни, але починає рухатися всередину і сканує, де проводяться пошуки в центральних районах арени [49].
2.3. Біохімічний аналіз
2.3.1. Вимірювання рівня гомоцистеїну в плазмі
Загальний рівень гомоцистеїну в плазмі визначали за допомогою електрохімічного виявлення з використанням модифікованих нановуглецем електродів, як описано раніше [50,51].
2.3.2. Аналіз покоління H2S
Загальний сульфід як відносний маркер концентрації H2S та аналізів генерування H2S проводили за допомогою методу N, N-диметил-р-фенілендіамінсульфату (NNDPD) [52]. Тканини мозку щурів Р72–90 гомогенізували у фосфатно-забуференному крижаному 0,15 М розчині NaCl. Гомогенат (10%, 860 мкл) змішували з ацетатом цинку (1%, 500 мкл) і 0,15 М NaCl (140 мкл) при кімнатній температурі. Трихлороцтову кислоту (10%, 500 мкл) додавали для зупинки реакції та ацетат цинку (1%, 500 мкл) для уловлювання H2S. Для оцінки швидкості вироблення H2S гомогенат зонда (10%, 860 мкл) змішували з L-цистеїном (10 мМ, 40 мкл), 5-фосфатом піридоксалю (2 мМ, 40 мкл) та фізіологічним розчином (60 мкл) і інкубували при 37 ° С протягом 60 хв. Для уловлювання продукованого H2S вводили трихлороцтову кислоту та ацетат цинку.
В обох випадках зонди змішували з NNDPD (20 мМ, 266 мкл) в 7,2 М HCl і FeCl3 (30 мМ, 266 мкл) в 1,2 М HCl і поглинання аликвот отриманого розчину (600 мкл) вимірювали при 670 нм за спектрофотометрія (PE-5300VI, ECOHIM, Санкт-Петербург, Росія). Загальні концентрації сульфіду розраховували на основі калібрувальної кривої NaHS. Активність синтезу H2S виражається як мкМ H2S, що продукується 1 г тканини на хвилину (мкМ/хв/г).
2.3.3. Перекисне окислення ліпідів та активність глутатіонпероксидаз
Зразки мозкової тканини заморожували та гомогенізували в буферному розчині (0,15 М NaCl з фосфатним буфером, співвідношення 1:10) для подальшого аналізу. Малондіальдегід (MDA) вимірювали спектрофотометрично за методом Ohkawa et al. 1979 [53]. Гомогенати мозкової тканини змішували з 20% трихлороцтовою кислотою та 0,03 М 2-тіобарбітуровою кислотою у співвідношенні 2: 2: 1. Суміш нагрівали протягом 45 хв при 95 ° C і центрифугували протягом 10 хв при 10000 g. За цієї умови MDA легко бере участь у реакції нуклеофільного приєднання з 2-тіобарбітуровою кислотою, утворюючи червоний, флуоресцентний аддукт MDA 1: 2. Поглинання супернатанту контролювали при 532 нм (εTBA-MDA = 1,55 мМ -1 см -1) за допомогою спектрофотометрії (PE-5300VI, ECOHIM, Санкт-Петербург, Росія). Рівні MDA виражали у мкг/г тканин.
Антиоксидантний потенціал визначали шляхом вимірювання активності глутатіонпероксидази (GPx), оціненої за зниженням рівня відновленої форми глутатіону (GSH) із використанням трет-бутилу в якості субстрату [54]. Один мл розчину глутатіону змішували з 1 мл гомогенату мозку; суміш розділили на дві пробірки для центрифуг (випробувальну та контрольну) та інкубували протягом 5 хв. У пробірку додавали розчин гідропероксиду трет-бутилу (5 мкМ, 0,02 мл). Через 10 хв 0,2 мл холодної 10% трихлороцтової кислоти вливали в пробірки та контрольні пробірки. Зразки центрифугували протягом 15 хв при 10 000 г, 0,1 мл супернатанту з контрольної та пробірки переносили в хімічні пробірки і додавали і перемішували 2 мл фосфатного буфера (рН 8,0) і 0,05 мл реагенту Еллмана. Оптичну щільність контрольних та досліджуваних зразків вимірювали при 412 нм за допомогою спектрофотометра (PE-5300VI, ECOHIM, Санкт-Петербург, Росія). Активність GPx виражалася у мкг/г тканин на хв.
2.4. Вестерн-клякса
2.5. Статистичний аналіз
3.2. Вплив материнської hHcy та NaHS на поведінку в тесті на відкритих полях
Локомоторну та дослідницьку діяльність оцінювали під час випробувань на відкритому грунті. Горизонтальна активність (квадратне схрещування) була значно вищою у групі Hcy порівняно з контрольною та групами NaHS (рис. 2а). Кількість схрещених квадратів щурів із групи NaHS не відрізнялася від контрольної групи (рис. 2а). Активність вирощування та вертикальної активності щурів не відрізнялася у всіх групах (8,7 ± 1,2 у контролі; 11,1 ± 0,6 у Hcy; 8,4 ± 0,9 у NaHS; 9,6 ± 1,1 у групах HcyNaHS), проте загальна рухова активність була значно вищою у Hcy-група порівняно з контрольною та NaHS-групами (малюнок 2 b).
3.3. NaHS знижує рівень тривожності, виміряний у світлому темному полі у щурів з материнською щільністю
Тест на світлий темний ящик створює конфліктну ситуацію для тварини, яка прагне дослідити незнайому ділянку, і час перебування в темному відділенні корелює з рівнем тривожності [46]. У контрольній групі час перебування у світлому відділенні становив 88,4 ± 7,1 с (n = 25) і суттєво зменшився у групі Hcy (62,5 ± 8,4 с, n = 25, рисунок 3 а). У групах NaHS та HcyNaHS цей параметр суттєво не відрізнявся від контрольної групи. Подібні результати були отримані щодо кількості переходів між камерами (Рисунок 3 b).
Вплив пренатальної терапії hHcy та NaHS на тривожність, виміряну у світлому темному вікні. Час перебування в лайтбоксі (a) та числа переходів між камерами (b) щурів порівняно з контрольною (білі колонки), Hcy (сірі колонки), NaHS (пунктирні колонки), HcyNaHS (сірі пунктирні колонки). * p # p Рисунок 4 а). У групі Hcy цей час був значно нижчим порівняно з контрольною групою (44,1 ± 5,8 с, p Малюнок 4 а). Рухову координацію оцінювали в тестах Ротарода, де вимірювали час падіння та дистанцію бігу [41]. Подібні зміни спостерігались у групі Hcy для відстані Ротарода під час експериментальних сесій (рис. 4, б). Значне зменшення часу, проведеного на Ротароді, спостерігалось у групі Hcy порівняно з контрольною групою (рис. 4 в). Обробка NaHS відновлена як до контрольних значень (Малюнок 4 b, c).
- Більш низький рівень гнилого яєчного газу (сірководню) в крові пов'язаний із ожирінням, діабетом 2 типу та
- Надмірне харчування матері викликає довготривалий когнітивний дефіцит у кількох поколінь - PubMed
- Ожиріння матері, пов’язане з нижчим IQ, когнітивною функцією у дітей
- Вживання харчових поживних речовин у матері та ризик передчасних пологів
- Листова зелень пов'язана з повільнішим віковим когнітивним спадом Національний інститут старіння