Системне лікування мезенхімальними стовбуровими клітинами, заготовленими інтерлейкіном-1, сприяє одужанню після інсульту
Анотація
Передумови
Мезенхімальні стовбурові клітини (МСК) мають великий потенціал як терапія інсульту, і раніше було показано, що вони сприяють відновленню на доклінічних моделях ішемії мозку. МСК секретують широкий спектр факторів росту, хемокінів, цитокінів та позаклітинних везикул - спільно названих секретомом. У цьому дослідженні ми вперше оцінили ефективність секретованого MSC-похідного секрету IL-1α на травму мозку та функціональне відновлення після ішемії головного мозку.
Методи
Інсульт індукували у самців мишей C57BL/6, використовуючи модель внутрішньосвітлової нитки оклюзії середньої мозкової артерії. Кондиціоноване середовище з грунтованих IL-1α MSC або носія вводили під час реперфузії або через 24 год після інсульту шляхом підшкірної ін’єкції.
Результати
Грунтоване лікування ILC-1α, отримане MSC, під час інсульту призвело до розвитку
Зменшення обсягу ураження на 30% через 48 годин і було пов’язано зі скромним поліпшенням збільшення маси тіла, 28-бальною неврологічною оцінкою та побудовою гнізда. Введення кондиціонованого середовища, отриманого від MSC, через 24 год після інсульту призвело до поліпшення побудови гнізда та неврологічного балу, незважаючи на відсутність різниці в обсязі ураження на 2 день після інсульту.
Висновки
Наші результати вперше показують, що введення кондиціонованого середовища з грунтованих IL-1α MSC призводить до поліпшення результатів поведінки незалежно від нейропротекції.
Передумови
Інсульт є значною глобальною проблемою охорони здоров'я, що призводить до приблизно 6,7 мільйона смертей щорічно [1]. Для 33 мільйонів людей, які живуть з інсультом, можливості лікування дуже обмежені і не повністю полегшують спричинену інвалідність [2]. Звідси великий попит на регенеративні терапії, що сприяють відновленню та покращенню інвалідності після ішемічного інсульту.
Було досліджено ряд стратегій попереднього кондиціонування in vitro для підвищення секретності MSC, включаючи 3D-культуру [15] та гіпоксичну попередню підготовку [16]. У нашій попередній роботі ми чітко демонструємо, що грунтування інтерлейкіном-1 альфа (IL-1α) веде секретом MSC до більш протизапального та протрофічного фенотипу, що може перетворитися на кращу терапію ішемічного інсульту [17]. В даний час ефект таких стратегій попереднього кондиціонування MSC не вивчений широко в доклінічних моделях інсульту. Дійсно, наскільки нам відомо, існує лише одне таке дослідження, яке оцінювало ефективність КМ, отриманого із зумовлених гіпоксією МСК [13], щодо відновлення моторики та нейропротекції на моделі ішемічного інсульту у щурів. Наші раніше опубліковані дані in vitro наочно демонструють, що грунтування IL-1α спонукає МСК до прорепаративного фенотипу. Отже, важливо підтвердити перевагу праймування IL-1α у відповідній парадигмі in vivo з детальною характеристикою поведінкового репертуару після інсульту, як це досліджувалося тут на мишій моделі оклюзії середньої мозкової артерії.
Методи
Характеристика MSC
Для характеристики MSC фарбували за допомогою набору аналізу hMSC BD Stemflow ™ (BD Biosciences, Великобританія) відповідно до інструкцій виробника. Потім клітини аналізували на проточному цитометрі FACSVerse (BD Biosciences, Великобританія) на позитивну експресію поверхневих маркерів CD73, CD90 і CD105 та негативну експресію CD11b, CD19, CD34, CD45 та HLA-DR, як визначено Міжнародним товариством клітинних Терапія як мінімальний критерій для МСК [18] (Додатковий файл 1: Рисунок S1). Позитивні ворота встановлювали за допомогою флуоресценції мінус один контроль. Мультипотентність MSC також оцінювали за допомогою комерційно доступного набору (R&D Systems, Великобританія). Коротше кажучи, МСК культивували протягом 21 дня в диференційованих середовищах із зміною середовища кожні 2–3 дні. Адипоцити фарбували маслом червоного O (Millipore, Великобританія), а остеоцити - алізарином червоного (Millipore, Великобританія). Гранули хрондоцитів розрізали на зрізи по 30 мкм за допомогою мікротома для заморожування на санях (Bright Instruments, Великобританія), потім фарбували толуїдиновим синім (Sigma-Aldrich, Великобританія). Зображення отримували за допомогою перевернутого мікроскопа (Olympus CK X31) та камери Moticam 2300, підключеної до програмного забезпечення Motic Images Plus 2.0 ML (Motic, Гонконг).
Культура мезенхімальних стовбурових клітин
Для всіх експериментів використовували пасаж 5–6 MSC, отриманих з кісткового мозку людини від 22-тижневого донора плода (3H Biomedical, Швеція). МСК культивували як моношар у колбах для культури тканин (Корнінг, Великобританія) в середовищі MesenPRO RS (Invitrogen, Великобританія), доповненій 1% пеніциліном/стрептоміцином та 2 мМ глютаміном. Ростове середовище змінювали кожні 4–5 днів, поки клітини не злилися на 70–80%. Потім MSC дисоціювали з 0,5% трипсином-ЕДТА (Sigma-Aldrich, Великобританія) і підраховували. Для препарату CM (αCM) з грунтовкою IL-1α MSC висівали в 6-лункові планшети (Корнінг, Великобританія) при щільності 1,75 × 10 5 клітин/лунку та інкубували протягом 24 годин. Потім MSC обробляли 10 нг/мл людського рекомбінантного IL-1α (R&D Systems, Великобританія) протягом 5 хв. Клітини двічі промивали PBS, після чого додавали безсироваткову середовище MesenPRO RS (без добавки). Через 24 год збирали αCM, клітинний залишок видаляли за допомогою шприцевих фільтрів 0,22 мкМ (Millipore, Великобританія) та 10 разів концентрували за допомогою відцентрових концентраторів 3000 MWCO Vivaspin (Generon, UK) згідно з інструкціями виробника. Для транспортного засобу безсироваткове середовище MesenPRO RS також концентрували в 10 разів. Для всіх експериментів in vivo 400-мкл кондиціонованих обробок, отриманих із 3,5 × 105 клітин, готували заздалегідь і зберігали при - 80 ° C.
Експерименти in vivo
Тварини
Усі процедури для тварин проводились відповідно до переглянутого Закону про тварини (про наукові процедури) 1986 року за ліцензією проекту Міністерства внутрішніх справ (Великобританія) та схвалено місцевою Комісією з етичного контролю за захистом тварин. Тварин групували в клітинах Sealsafe Plus Mouse з індивідуальною вентиляцією (Techniplast, Італія) при 21 ± 1 ° C, вологості 55 ± 10% при 12-годинному циклі світло-темно. Усі клітки були забезпечені гніздовим матеріалом Sizzle Nest (Datesand Ltd., Великобританія) та картонними збагачувальними трубками (Datesand Ltd., Великобританія). Миші мали вільний доступ до стандартної дієти для гризунів (SDS, Великобританія) та води. Мишей привчали до закладу принаймні за 1 тиждень до початку експериментальних робіт.
Оклюзія середньої мозкової артерії (MCAO)
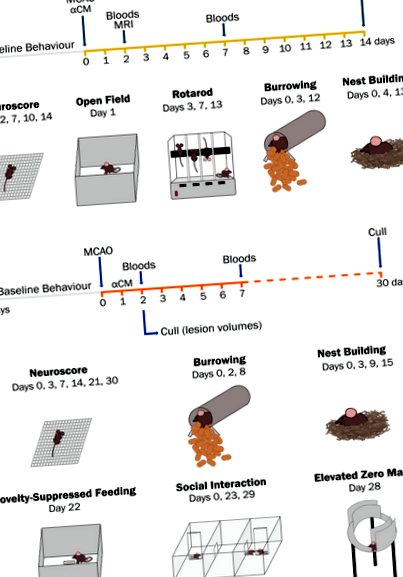
Короткий зміст термінів дослідження інсульту та поведінкових тестів. У першому дослідженні кондиціоновану середу з мезенхімальних стовбурових клітин, заснованих на IL-1α, вводили під час реперфузії підшкірною ін’єкцією, потім мишей відновлювали протягом 14 днів (a). У другому дослідженні кондиціоноване середовище вводили через 24 год після інсульту (b). Потім мишей відновлювали протягом 30 днів, щоб полегшити оцінку тривоги після інсульту та депресивної поведінки в пізні моменти часу. За винятком відкритого поля, придушене годування новинками та оцінка поведінки з початковим рівнем нульового лабіринту проводились перед хірургічним втручанням
400-мкл 10 × концентрованого лікування αCM або MesenPRO (носій) вводили підшкірною ін’єкцією під час реперфузії в дослідженні 1 та через 24 години після MCAO у дослідженні 2. Тварин виключали з досліджень, якщо оклюзія не була успішною (визначено як 0.
Ніяких маніпуляцій з гніздовим матеріалом
Немає очевидного місця гніздування (більшість гніздових матеріалів не містяться в одному квадранті клітки)
Гніздо присутнє, але плоске
Гніздо має підняті стінки у висоту ≤ 30 мм
Гніздові стінки висотою 31–49 мм
Стінки гнізда ≥ 50 мм у висоту
Фотографії були зроблені на камеру смартфона (Xiaomi, Китай). Кожен квадрант гнізд оцінював спостерігач, засліплений групою, і час, який потім усереднювали. Осліплення було проведено шляхом прохання незалежного дослідника перейменувати файл.
Піднесений нульовий лабіринт
Апарат піднятого нульового лабіринту (Сан-Дієго Інструментс, США) складався з сірої пластикової кільцевої злітно-посадкової смуги діаметром 600 мм, піднятої на 600 мм над підлогою. Це поділено на чотири квадранти: два закритих плеча з 15-мм стінками та два відкритих плеча. Мишей вводили в одну із закритих рук і дозволяли досліджувати протягом 5 хв. Будь-яке програмне забезпечення з лабіринтом було знову використано для відстеження в реальному часі.
Пригнічене годування новинками
Пригнічене новизною годування широко використовується для оцінки тривожності та виявлення нових антидепресантів [25]. Цей тест вимірює гіпонефагію, гальмування годування у відповідь на нові умови. Апарат складався з квадратної арени Perspex (450 × 200 × 450 мм) з 35-міліметровою тарілкою (Корнінг, Великобританія), що містила в центрі 1 г підсолодженого згущеного молока (Aldi, Німеччина). Мишей вводили в кут і дозволяли досліджувати протягом 5 хв. Цифрова камера USB 2.0 CMOS (Stoelting, США), розташована безпосередньо над апаратом, підключеним до ноутбука з БУДЬ-ЯКИМ лабіринтом версії 6.0 (Stoelting, США), використовувалася для відеозйомки та відстеження в прямому ефірі. Затримка наближення до їжі відстежувалася вручну із відеозаписів спостерігачем, засліпленим до точки часу та групи лікування. Блюдо зважували після тестування для розрахунку маси з’їденої їжі.
Тест на соціальну взаємодію та соціальну перевагу
Магнітно-резонансна томографія
Через 48 годин після інсульту тваринам у дослідженні 1 знеболювали 4% ізофлураном, а сканування, зважене за Т2, проводили на консолі Bruker Advance III (Bruker Biospin Ltd., Великобританія) за допомогою 7-Т магніту. Всього було придбано 14 серійних зрізів товщиною 1 мм. Обсяги уражень вимірювали за допомогою ImageJ і виправляли з набряків.
Кількісне визначення обсягу ураження
Через 48 годин підгрупу тварин у дослідженні 2 перфузували внутрішньосерцево 0,9% фізіологічним розчином, а потім 4% параформальдегіду (PFA) в 0,1 М фосфатному буфері (PB). Мозок видаляли і фіксували в 4% PFA протягом 24 годин, потім переносили в 30% сахарозу перед тим, як швидко заморозити в ізопентані. Зрізи вирізали товщиною 30 мкм за допомогою мікротома для заморожування санок і встановили на предметних предметних стеклах, покритих желатином. Потім зрізи фарбували крезил-фіолетовим кольором і покривали губкою монтажним середовищем DPX (Sigma-Aldrich, Великобританія). Потім обсяги уражень вимірювали за допомогою ImageJ та коригували на набряки.
Імуногістохімія
Для імунофлуоресценції після вилучення антигену, як описано вище, предметні стекла інкубували в первинному Ki67 (1: 200, BD550609) та NeuN (1: 1000, ab177487) при 4 ° C протягом ночі. Потім предметні стекла інкубували в біотинільованому проти миші (1: 500, Vector Laboratories, Великобританія) та Alexa Fluor ™ 647 проти кролика (1: 500) протягом 1 год 30. Для посилення використовували супербустерний набір тираміду (B40933). Сигнал Ki67 згідно з протоколом виробника. Зрізи були забарвлені за допомогою DAPI (1 мкг мл -1, 10 хв, D9542) і змонтовані за допомогою антимікробного монтажу ProLong® Gold (Thermo Fisher, Великобританія). Зображення були зібрані на вертикальному мікроскопі Zeiss Axioimager.D2 із використанням об'єктива Planch 20 × 0,8 Planchromat та зафіксовані за допомогою камери Coolsnap HQ2 (Photometrics) за допомогою програмного забезпечення Micromanager v1.4.23. Потім зображення обробляли та аналізували за допомогою ImageJ експериментатором, засліпленим для групи лікування.
Дані та статистичний аналіз
Усі дані виражаються як середнє значення ± стандартне відхилення (SD). Для досліджень інсульту був проведений розрахунок потужності первинного показника продуктивності в завданні поведінки заривання з попередньо отриманими даними за допомогою Інтернет-калькулятора (https://jackauty.com/power-calculator/). Використовуючи середнє значення 81,2, SD 25,9, альфа 0,05 та потужність 0,8, an n з 8 було розраховано для виявлення поліпшення на 60%. Враховуючи 30% швидкості зносу, n з 12 було обрано. Статистичний аналіз проводився у RStudio версії 1.1.463 (https://www.rstudio.com) з використанням пакетів car, lme4 та lsmeans. Припущення оцінювались графічно, а при необхідності дані трансформувались. Багаторівневе моделювання було використано для аналізу маси тіла, нори і ротарод даних. Якщо була досягнута статистична значимість (стор
Результати
Лікування кондиціонованим середовищем під час інсульту має нейропротекторну дію та сприяє покращенню показників самопочуття
У дослідженні 1 двох мишей із групи інсульт + αCM було виключено через субарахноїдальний крововилив, а одна перевищила гуманну кінцеву точку> 20% втрати маси тіла і була рано вибракована. У групі інсульт + транспортний засіб одну мишу було вибрано достроково через втрату ваги, а двох виключено через рис. 2
На 14 день MCAO асоціювався із підвищеною експресією мікрогліального маркера Iba1 як в іпсилатеральній корі, так і в смугастому тілі (стор Рис.3
На 30 день MCAO асоціювався із збільшенням експресії мікрогліального Iba1 як в іпсилатеральній корі, так і в смугастому тілі (стор Рис.4
Результативність у тестах на тривожність та депресивну поведінку в пізні терміни після інсульту. Латентність вживання їжі (a) і маса з'їденої їжі (b) у пригніченому завданням годування на 22 день після інсульту. Час, проведений у розпростертих обіймах (c) та загальна відстань, пройдена в підвищеному нульовому лабіринті за день 28 (d). Дані були виражені як середнє значення ± SD. Підробка + транспортний засіб, n = 12; фіктивний + αCM, n = 11; удар + транспортний засіб, n = 8; удар + αCM, n = 9
Обговорення
У цьому дослідженні ми пропонуємо детальне дослідження in vivo ефективності попереднього кондиціонування як стратегії посилення терапевтичного потенціалу МСК. Більш конкретно, ми вперше демонструємо, що підшкірне введення IL-1α ґрунтованого MSC, отриманого МСК (αCM) під час реперфузії, мало значний нейропротекторний ефект і забезпечило незначні покращення показників добробуту на миші моделі вогнищева ішемія головного мозку. Потім ми далі показуємо, що затримка введення αCM до 24 годин після інсульту призвела до поліпшення функціонального відновлення, про що свідчить збільшення показників у будівництві гнізд на 9 день та суттєве покращення неврологічних показників з 7 дня, незалежно від нейропротекції. Загалом, наша робота вказує на те, що закріплений IL-1 секретом MSC може бути корисною новою безклітинною терапією інсульту.
Тут ми повідомляли, що MCAO спричиняє поведінку, подібну до тривоги, починаючи з 22-го дня після інсульту. Це підтверджує попереднє дослідження, яке показало підвищену затримку прийому їжі у пригніченому новизною тесті годування через 14 тижнів після інсульту на моделі миші MCAO та через 19 днів після індукованого ендотеліном префронтального ураження кори [45]. Хоча ми повідомляли про збільшення часу перебування у відкритому плечі піднятого нульового лабіринту на відміну від того, що повідомлялося раніше [45,46,47], це могло бути пов'язано з гіперактивністю. Гіперактивність спостерігалася вже через 8 тижнів після MCAO у мишей [48].
Висновки
Підводячи підсумок, наші результати вперше демонструють, що системне введення СМ від грунтованих IL-1α MSC сприяє поліпшенню відновлення на мишачій моделі церебральної ішемії незалежно від нейропротекції. Хоча є багато досліджень, які потребують повного з’ясування механізмів дії та визначення того, які медіатори є важливими для сприяння репарації, закріплений IL-1 секрет МСК має великий потенціал як позаклітинна терапія для лікування ішемічного інсульту.
- Лікування ожиріння за допомогою стовбурових клітин - тема найбільш відвідуваного випуску новин 2013 року на EurekAlert!
- Стовбурові клітини здоровіші при втраті ваги
- Стовбурові клітини та схуднення Денвер Колорадо Втрата ваги
- Огляд пацієнта про лікування стовбурових клітин при РС в московській клініці Swiss Medica
- Огляд нехірургічного та хірургічного лікування та роль інсуліносенсибілізуючих агентів у