Споживання дієти у дорослих із ризиком розвитку хвороби Хантінгтона
Від імені дослідницької групи Хантінгтона
Із відділів неврології та психіатрії, Інститут досліджень хвороби Альцгеймера та старіння мозку Тауба, Центр Гертруди Х. Сергієвського (К.М.), Колумбійський університет, Нью-Йорк, Нью-Йорк; Департамент епідеміології та біостатистики (H.Z.), Техаський науково-медичний центр A&M, Коледж-Стейшн; Кафедри біостатистики (S.E., D.O.) та неврології (I.S.), Рочестерський університет, Нью-Йорк; та Інститут Паркінсона (C.M.T.), Саннівейл, Каліфорнія.
Анотація
Завдання:
Для вивчення споживання калорій, дієтичного складу та індексу маси тіла (ІМТ) у учасників Проспективного спостережного дослідження Хантінгтона (PHAROS).
Методи:
Споживання калорій та склад макроелементів вимірювали за допомогою опитувальника частоти продуктів харчування Національного інституту раку (FFQ) у 652 учасників із ризиком розвитку хвороби Хантінгтона (HD), які не відповідали клінічним критеріям HD. Логістична регресія була використана для вивчення взаємозв'язку між макроелементами, ІМТ, калорійністю та генетичним статусом (CAG Бджола = базальні витрати енергії; ІМТ = індекс маси тіла; FFQ = Анкета частоти їжі; HD = Хвороба Хантінгтона; АБО = коефіцієнт шансів; PD = Хвороба Паркінсона; ФАРОС = Перспективне дослідження спостереження за Хантінгтоном; Трійник = загальні витрати енергії; UHDRS = Єдина шкала оцінки хвороб Хантінгтона.
Особи, які страждають на хворобу Хантінгтона (HD), мають нижчий індекс маси тіла (ІМТ), ніж вікові контролі, 1–5, і ці відмінності зростають із зростанням HD. 1,3 Втрата ваги ≥1 кг/рік була пов'язана з більш серйозними руховими порушеннями та дедалі важкою хореєю у 927 випадках HD у подальшому протягом 3,4 років, тоді як збільшення ваги частіше спостерігалося у тих, у кого коротша тривалість захворювання (0–2 років). 2 Втрата ваги при HD може бути багатофакторною і пов’язана зі зниженням споживання калорій через дисфагію, збільшенням витрат енергії внаслідок фізичних навантажень (наприклад, хорея та дистонія), 6,7 або системним метаболічним дефектом, що призводить до гіперметаболічного стану. 8,9
У 2 дослідженнях 6,7, які досліджували цілодобові витрати енергії та фізичну активність із використанням непрямої калориметрії, загальні витрати енергії були на 11% –14% більшими у випадках ранньої та середньої стадії HD порівняно з контролем та пояснювались збільшенням фізичної активності під час неспання годин. Подібні дослідження не проводились на попередньо проявленому HD. Дослідження з використанням напівкількісної відкритої анкети показало значно вищий добовий рівень споживання калорій та нижчий ІМТ у 15 безсимптомних випадках HD порівняно з 21 контролем. 8
Ми оцінили взаємозв'язок між ІМТ та дієтою шляхом проведення напівкількісного опитувальника частоти їжі (FFQ) 10,11 особам, які брали участь у Проспективному спостережному дослідженні Хантінгтона (PHAROS). 12 Нашими цілями було порівняти учасників із розширеною CAG та без неї, щоб визначити 1) чи існують відмінності у споживанні макроелементів (білків, вуглеводів, жирів), загальному споживанні калорій та ІМТ; 2) залежність між тривалістю повторення CAG, ІМТ, і калорійність.
МЕТОДИ
Предмети.
Дієтична оцінка.
Загалом 675 осіб спочатку закінчили Національний інститут раку FFQ, що було доведено надійним та дійсним. 11 FFQ вводили в середньому через 30 місяців після базового обстеження. Двадцять три особи були виключені з представлених тут аналізів, оскільки вони були визначені як такі, що мають клінічно визначену ХД до або під час проведення FFQ, або через відсутність даних CAGn. Аналізи зосереджуються на цій першій дієтичній оцінці та ІМТ під час цього візиту або найближчого візиту, якщо FFQ не був завершений під час візиту. Найближчим візитом було визначено 180 днів до FFQ або протягом 14 днів після FFQ. Сімдесят дев'ять відсотків випробовуваних виконали FFQ протягом 2 днів після відвідування, а 95% випробовуваних мали відвідування, яке потрапляло в зазначене вікно.
Статистичний аналіз.
Нарешті, тривалість повторення CAG корелювала з ІМТ, споживанням калорій та оціненою фізичною активністю в групі CAG ≥37 з багаторазовою лінійною регресією з використанням значень квартилів (1, 2, 3, 4) як безперервних змінних та з урахуванням віку, статі, та освіта. Крім того, для ІМТ ми скоригували для споживання калорій, а для споживання калорій - для ІМТ. Ми також розрахували прогнозовану 5-річну ймовірність клінічного початку HD 15,16, використовуючи модель на основі CAG, розроблену з використанням даних близько 3000 осіб. Вищевказану лінійну регресію проводили з використанням прогнозованої 5-річної ймовірності початку як змінної результату.
Всі аналізи повторювались, виключаючи всіх осіб, у яких на дієтичному інтерв’ю бракувало більше 10 предметів, а також жінок з калорійністю 3500 ккал на добу та чоловіків з калорією 4000 ккал на день.
РЕЗУЛЬТАТИ
У дослідженні PHAROS взяли участь 1001 учасник дослідження. FFQ було виконано 675 особами (441 CAG 17 (12,9 [0,4] проти 13,0 [0,2]) та за кожним з когнітивних показників на UHDRS. Показники хореї та брадикінезії були значно вищими серед некомплектних.
Сім осіб, які пройшли FFQ, під час базового обстеження отримали оцінку 4 (відповідає клінічним критеріям HD) і були виключені з цього аналізу. Ще 15 осіб отримали оцінку 4 до або на момент проведення FFQ і були виключені з аналізу загалом 22 особи. Також була виключена одна особа, яка не мала даних повторної CAG.
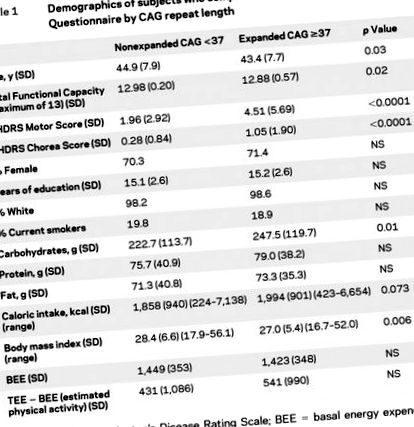
Демографічні характеристики та зведені показники FFQ у 435 осіб із таблицею CAG 1. Загальний моторний показник UHDRS та показник хореї були значно вищими серед тих, у кого розширений повтор CAG. Ми вивчили різницю між ТЕЕ (оцінюється за загальним споживанням калорій) та БДЕ як показник розрахункової фізичної активності. Через наявність викидів для дієтичних змінних, розподіл цих змінних за квартилями порівнювали для осіб з таблицею CAG 2). Калорійність була значно вищою в групі CAG ≥37 (р для тренду = 0,01). ІМТ та оцінювана фізична активність незначно відрізнялися, тоді як БДЕ не відрізнялись суттєво. Споживання вуглеводів було значно вищим у розширеній групі повторних CAG (р для тренду = 0,02).
Таблиця 1 Демографічні показники досліджуваних, які заповнили опитувальник частоти їжі за повторною довжиною CAG
Таблиця 2 Розподіл дієтичних змінних та індексу маси тіла для суб'єктів із таблицею 3 CAG. Як внаслідок некорегованого, так і скоригованого аналізу шанси членства в групі CAG ≥37 збільшувались приблизно вдвічі для кожного квартиля (другий, третій та четвертий) споживання калорій порівняно з найнижчим квартилем (перший) (еталон) (p для тенденції 0,05). Найвищі шанси були для другого квартиля порівняно з еталонними, і шанси зменшувались із збільшенням споживання калорій (рисунок). Коли загальний руховий бал був включений як коваріативний, цей зв'язок послаблювався лише у найвищому квартилі (четвертий). Вищі оціночні фізичні навантаження були пов'язані із збільшенням шансів на членство в групі CAG ≥37 після корекції віку, статі та освіти (p для тенденції 0,02). Коли загальний руховий бал з UHDRS був включений як коваріативний, зв’язок між загальною оціненою фізичною активністю та членством у групі послаблювався, як і слід було очікувати, оскільки загальний руховий бал є мірою фізичної активності. Зв'язок ІМТ та генетичного статусу не досяг значущості. Коригування для дихотомізованого балу хореї (0 проти> 0) дало результати, подібні до результатів, отриманих шляхом регулювання дихотомізованого моторного балу (дані не наведені).
Таблиця 3 Некореговані та скориговані коефіцієнти шансів (ОП) порівняння суб'єктів із CAG ≥37 до суб'єктів із таблицею 4 CAG. Очікувалося збільшення одиниці CAG на 0,26 одиниці для кожної одиниці збільшення ккал квартилі. Подібним чином, ми оцінюємо збільшення на 2,4% імовірності початку 5-річного періоду для кожної одиниці збільшення ккал квартилі. ІМТ не корелював із тривалістю повторення CAG після корекції віку, статі, освіти та споживання калорій.
Таблиця 4 Скориговані коефіцієнти регресії тривалості повторення CAG та 5-річна ймовірність початку хвороби Хантінгтона (HD) у суб'єктів із CAG ≥37
ОБГОВОРЕННЯ
Це найбільше дослідження дієтичних факторів серед осіб, які перебувають у групі ризику розвитку HD, які не знали про свій генетичний статус. Особи з розширеною CAG (≥37) повідомили про подібне споживання калорій, але мали нижчий ІМТ порівняно з тими, у кого не було розширеного CAG (5, як ми також повідомляємо в некорегованому аналізі (таблиця 1). Поздовжні дослідження допоможуть визначити, чи є зміни в макроелементи та енергетичні потреби, оскільки деякі особи в цій когорті розвивають HD.
Втрата ваги серед носіїв генів HD може бути пов’язана з надмірними мимовільними рухами, труднощами з ковтанням або порушенням всмоктування. Ми не можемо виключити ймовірність збільшення витрат енергії внаслідок руху; однак ми вважаємо, що ми значно зменшили можливість того, що збільшені витрати енергії будуть обумовлені виключно незначним мимовільним рухом, усунувши 22 особи, які отримали клінічний діагноз HD на початковому рівні або в будь-який час аж до адміністрування FFQ. У дослідженні 517 пацієнтів із ранньою стадією HD зниження ІМТ протягом 3-річного періоду було пов'язане із збільшенням тривалості повторень CAG, але не з яким-небудь конкретним компонентом UHDRS (руховим, когнітивним або поведінковим). 18 Коли ми скоригували лише загальний моторний бал та хорею, зв’язок між споживанням калорій та членством у категорії CAG ≥37 зменшився, але не зник.
Використовуючи базу даних дослідницької групи Хантінгтона щодо виявлених випадків ХВ порівняно з контролем за віком (1: 5), ми повідомили про значно нижчий ІМТ у 361 симптоматичному випадку ХВ на самій ранній стадії захворювання (загальна функціональна здатність> 11 [0–13; 13 нормальних], показник хореї або дистонії ≤2 та тривалість ІМТ 4 була нижчою, ніж повідомлялося в поточному дослідженні доманіфестованих осіб, хоча бали за хореєю та дистонією були подібними, припускаючи, що особи в попередньому дослідженні були більше Оскільки учасники цього дослідження не знали про свій генетичний статус, будь-яке збільшення споживання калорій не могло бути віднесено до цієї інформації. Крім того, якщо утруднення ковтання пояснюється втратою ваги, можна очікувати зменшення, а не збільшення споживання калорій у групі CAG ≥37.
Обмеження поточного дослідження включають той факт, що дієтичні оцінки були самостійними звітами, і не було можливості перевірити дієтичне споживання. Крім того, всі опитування заповнювались приватно. Не було виправлень та запитів щодо відсутніх даних. Третина учасників не виконала FFQ. Ці особи мали значно гірший результат на когнітивній частині UHDRS і повідомляли про більше симптомів депресії та функціональних скарг; однак частка носіїв розширеного повторення CAG не суттєво відрізнялася між тими, хто пройшов опитування, і тими, хто цього не зробив. У нас не було конкретних питань щодо дисфагії. Нам вдалося наблизити TEE лише через те, що непряма калориметрія не була отримана. Ми також не мали вимірюваних показників фізичної активності, щоб визначити, наскільки ТЕЕ було обумовлено фізичною активністю. Цінними були б непрямі дослідження калориметрії та точне вимірювання фізичної активності у цій популяції попередньо проявлених осіб.
Ці дані додають до збіжних доказів як мишачого, так і людського HD про підвищений метаболічний (прокатаболічний) стан, який може виникнути до розвитку явних рухових проявів HD. 9,19,20 Метаболомічний (метаболіт малих молекул) профіль, що складається із змін продуктів розпаду жирних кислот, посиленого розщеплення нуклеїнових кислот та порушення регуляції метаболізму амінокислот, був пов’язаний із прокатаболічним станом як на мишачих моделях, так і на людській HD у порівнянні з контролем . 20 У мишачих моделей та людей метаболічні ознаки різнилися між преманіфестним та клінічно маніфестним станами, що свідчить про зміну з прогресуванням захворювання. Дослідження 15 випадків перед-маніфестації HD із використанням 1 Н ЯМР-спектроскопії показало, що низькі рівні амінокислот з розгалуженим ланцюгом у плазмі відрізняли пре-маніфест випадків HD від контролю, і ці рівні корелювали із втратою ваги та тривалістю повторення CAG. 8
Втрата ваги може передувати руховим проявам у трансгенних мишей HD (R6/2 та N17182Q). Висловлювалось припущення, що зниження HAP-1, який сильніше зв'язується з мутантним Huntingtin, ніж звичайний білок huntintin і є стимулюючим білком для годування, може бути пов'язане зі зниженням ваги при HD. 9 нокаутованих мишей HAP-1 демонструють як зниження ваги, так і дегенерацію гіпоталамуса. 21
Незрозуміло, чи є зміни в ТЕЕ та ІМТ суворо попередніми чи відбуваються в умовах слабовиникаючої хвороби. При хворобі Паркінсона (БП) втрата ваги в умовах підвищеного споживання калорій відбувалася за 2-4 роки до діагнозу 22 та зростала із прогресуванням захворювання. Жодної різниці в ІМТ не було помічено серед чоловіків, які брали участь у дослідженні Гарвардських випускників, у яких розвинувся інцидент ПД (n = 106), коли ІМТ обстежувався до вступу до коледжу та при базовій оцінці; однак, ті, хто втрачав 0,5 кг за десятиліття між коледжем та базовим рівнем, мали підвищений ризик розвитку ПД. В іншому популяційному дослідженні ІМТ> 23 у віці 25–59 років асоціювалося з подвійним збільшенням ризику розвитку ПД. 24 Ці дослідження свідчать про те, що, хоча високий абсолютний ІМТ середнього віку може бути пов’язаний із підвищеним ризиком розвитку БП, зменшення ІМТ з часом також може становити ризик розвитку інциденту.
Кореляція споживання калорій, але не ІМТ, із більшою тривалістю повторення CAG та збільшеною передбачуваною ймовірністю настання HD через 5 років свідчить про те, що люди можуть споживати більше калорій, щоб підтримувати свою вагу протягом періоду до прояву, але в кінцевому підсумку можуть бути не в змозі для компенсації та збереження енергетичного балансу. Ранні та середні стадії HD, забезпечені достатнім споживанням калорій у контрольованому середовищі, могли підтримувати позитивний енергетичний баланс. Однак у вільних умовах життя повторне 24-годинне відкликання дієти було більш мінливим у цих пацієнтів із ГД, ніж контроль, а мінливість збільшувалась зі стадією захворювання (загальна функціональна спроможність) 7, що може пояснити, чому деякі пацієнти з ГД худнуть. Очікується, що взаємозв'язок між споживанням їжі та показниками тяжкості захворювання буде з'ясовано шляхом поздовжньої оцінки когорти PHAROS.
ВНОСИ АВТОРА
Статистичний аналіз, проведений докторами медицини. Чжао та Оукс та С. Еберлі.
ПОДЯКІ
Автори дякують своїм комітетам, консультантам та спонсорам, а також учасникам дослідження PHAROS та їхнім родинам.
РОЗКРИТТЯ
ДОДАТОК
Примітки
Надішліть запити на листування та передрук до доктора Карен Мардер, 630 W. 168th St. Unit 16, Коледж лікарів та хірургів Колумбійського університету, Нью-Йорк, Нью-Йорк 10032 ude.aibmuloc@1msk
* Співрозслідувачі PHAROS перелічені в додатку.
Розкриття інформації: Розкриття інформації про автора подано в кінці статті.
Отримано 2 вересня 2008 р. Прийнято в остаточній формі 1 травня 2009 р.
- Дієтичні добавки та ризик смерті від конкретної причини, серцево-судинних захворювань та раку - протокол
- Харчове споживання білка, дефіцит енергії та баланс азоту у дорослих з нормальною вагою рандомізовані
- Вживання дієтичних добавок та споживання поживних речовин серед дітей у Південній Кореї - ScienceDirect
- Повна стаття Споживання мікроелементів серед дорослих датських користувачів та некористувачів дієтичних добавок
- Шлуночкова тахікардія, пов’язана з фізичними вправами, не є ризиком для здорових людей похилого віку - ScienceDaily