Спланхнічна вазодилатація та синдром гіпердинамічного кровообігу при цирозі
Основна порада: При цирозі портальна гіпертензія зумовлена підвищенням внутрішньопечінкового опору та спланхнічним кровотоком. Останнє є вторинним щодо артеріального спланхнічного розширення судин і відкриття колатерального кровообігу. Хоча підвищення внутрішньопечінкової резистентності є найбільш раннім і найважливішим компонентом, на сьогодні єдині режими лікування, доступні для контролю портальної гіпертензії при цирозі печінки, тобто., неселективні бета-адреноблокатори, октреотид та терліпресин, діють на спланхнічний динамічний компонент. Отже, розуміння механізмів, що призводять до спланхнічної вазодилатації та до синдрому гіпердинамічного кровообігу, є важливим для лікування ускладнень портальної гіпертензії.
- Цитування: Болоньєсі М, Ді Пасколі М, Верардо А, Гатта А. Спланхнічна вазодилатація та синдром гіпердинамічного кровообігу при цирозі. Світ J Gastroenterol 2014; 20 (10): 2555-2563
- URL:https://www.wjgnet.com/1007-9327/full/v20/i10/2555.htm
- DOI:https://dx.doi.org/10.3748/wjg.v20.i10.2555
Портальна гіпертензія - це клінічний синдром, відповідальний за виникнення серйозних клінічних ускладнень, таких як утворення та розрив варикозу стравоходу та/або шлунка, асцит та печінкова енцефалопатія.
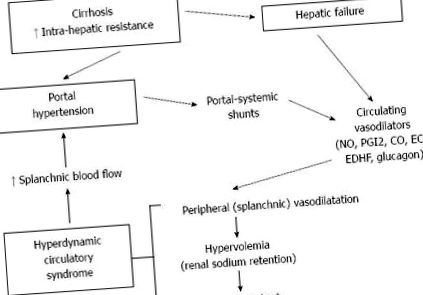
При цирозі головним механізмом, що відповідає за підвищення портального тиску, є підвищення внутрішньопечінкової резистентності до портального відтоку крові.
Основним механізмом, що відповідає за підвищений опір при цирозі, є відкладення колагену в печінковому ацинусі зі звуженням просвіту синусоїди та, як наслідок, зменшення загальної площі перерізу печінкових синусоїд. Подальшою структурною зміною, що відповідає за збільшення внутрішньопечінкового портального опору, є стиснення центрилобулярних венул шляхом регенерації вузликів, гранульом та портального запалення. Основна роль таких анатомічних змін у визначенні збільшення портального тиску підтверджується залежністю між товщиною перегородки, малою вузликовістю, ригідністю печінки та портальним тиском [1, 2] .
Окрім структурного компонента, у підвищенні печінкової резистентності бере участь також вазоактивний, потенційно оборотний компонент [3]. При цирозі підвищується скорочувальний тонус клітин гладких м’язів та міофібробластів, що походять із зірчастих клітин, навколо синусоїд та печінкових венул [4]. Норадреналін, речовина Р, тромбін, ангіотензин II [5], ендотелін (ЕТ) [6] та простаноїди [7] підвищують скоротливий тонус міофібробластів і, отже, портальну стійкість. Тим не менше, дисфункція ендотелію є основним джерелом динамічного збільшення внутрішньопечінкового портального опору [8]. Знижена біодоступність оксиду азоту (NO) у синусоїдах [8 - 11] та збільшене виробництво циклооксигенази (ЦОГ), отриманих простаноїдами, такими як простагландин Н2 та тромбоксан А2 [7, 12], здається, є головними гравцями ендотелію дисфункція при цирозі.
Незважаючи на те, що вони мають вирішальне значення для розвитку гемодинамічних змін при цирозі, механізми, що відповідають за підвищення внутрішньопечінкової резистентності, не будуть детально аналізовані в цьому огляді, оскільки вони виходять за межі його мети.
Через збільшення внутрішньопечінкової резистентності при портальній гіпертензії можна очікувати зменшення об'єму портального кровотоку. Однак, хоча виявляється дилатація ворітної вени та зменшення швидкості портальної крові [13], ці пацієнти характеризуються чистим збільшенням притоку воріт, селезінки та брижі.
Відкриття портально-системного обігового забезпечення бере участь у збільшенні притоку порталів. Однак також може спостерігатися первинне розширення судинної артерії, з посиленим кровотоком селезінки та брижі.
Портальний тиск виникає внаслідок залежності між об’ємом кровотоку, що надходить у портальну систему, та опором відтоку портальної крові. Математичний вираз цього співвідношення наведено формулою Ома: P = Q * S, де P являє собою зміну тиску вздовж судини, Q являє собою кровотік і R опір потоку.
Збільшення опору портальному потоку є головним фактором, що визначає портальну гіпертензію при цирозі [14, 15], але збільшення притоку порталу також відіграє певну роль. Таке збільшення загального спланхнічного припливу [16, 17] спостерігалось у хворих на цироз і продемонстровано на експериментальних моделях портальної гіпертензії [18, 19] .
У печінці з нормальним опором зміна портального потоку не змінює портальний тиск [20] через високу судинну відповідність печінкової судини. Коли опір портального відтоку збільшується, а судинна комплаєнс знижується, збільшення портального потоку відповідає за збільшення портального тиску. При цирозі збільшення притоку порталу, що викликається збільшенням опору портальному потоку (див. Нижче), підтримує та погіршує портальну гіпертензію [21] .
Кілька терапевтичних стратегій при портальній гіпертензії спрямовані на зниження портального тиску шляхом зменшення притоку порталів, таким чином висвітлюючи патогенну роль портального притоку.
Механізмом, що пояснює підтримку високого притоку порталу при портальній гіпертензії, є відкриття портально-системних засобів забезпечення, викликане збільшенням опору відтоку з портальної системи.
Розкриття колатеральної циркуляції відбувається через реперфузію та дилатацію вже існуючих судин, а також через утворення нових судин, як це було продемонстровано експериментальними дослідженнями, що показують роль ангіогенетичних факторів, таких як судинний ендотеліальний фактор росту (VEGF), у патогенезі колатеральний кровообіг у щурів портальної гіпертензії [22, 23] .
Портально-системні шунти відповідають за шлунково-кишкові крововиливи (здебільшого через розрив варикозу стравоходу або шлунка) і забезпечують доступ до системного кровообігу речовин, які зазвичай виводяться печінкою. Вони відіграють роль у патогенезі гіпердинамічного кровообігу, асциту та печінкової енцефалопатії [24] .
При цирозі з портальною гіпертензією посилення спланхнічного кровотоку зумовлене розширенням судин артеріальних судинних судин як у селезінкових, так і в мезентеріальних судинних руслах. В останні роки були широко досліджені механізми, що відповідають за зниження мезентеріальної артеріальної резистентності при цирозі. В якості можливих медіаторів запропоновано численні речовини та системи: глюкагон [24 - 26], простациклін (PGI2), кишковий вазоактивний пептид, гістамін, речовина Р, естрогени, колецистокінін, аміак, ендотоксини, аденозин, жовчні кислоти [24], NO [ 27 - 29], пептид, пов'язаний з геном альфа-кальцитоніну [30], адреномедулін [31, 32], VEGF [33], окис вуглецю (CO) [34, 35], ендогенні канабіноїди (ЕК) [24, 28]. Ендотеліальні фактори, безумовно, відіграють важливу роль [36] .
Про роль NO у спланхнічній вазодилатації хворих на цироз та портальну гіпертензію висували гіпотезу більше 20 років тому [37], і в даний час він вважається ключовим фактором, що бере участь у зниженні мезентеріальної резистентності цирозу. NO має дуже короткий період напіввиведення (20-30 с), він вільно дифундує крізь клітинну мембрану і діє головним чином за рахунок збільшення продукції цГМФ гуанілатциклазою з подальшим розслабленням клітин гладкої мускулатури. Біодоступність NO підвищується у пацієнтів з цирозом та портальною гіпертензією [38], здебільшого через підвищену активність конститутивної форми NO-синтази (eNOS).
Активність NOS підвищена у верхній брижовій артерії та грудній аорті портальних гіпертонічних щурів [39]. Посилення регуляції eNOS можна виявити навіть на ранніх стадіях захворювання у щурів портальної гіпертензії [35]. Здається, кілька механізмів відповідають за таке збільшення активності eNOS. Запальні цитокіни, VEGF та механічні сили, такі як напруга зсуву, спонукають сигнальні каскади активувати Akt та білок теплового шоку 90 (Hsp90), які, в свою чергу, активують eNOS [40]. Транслокація бактерій з кишечника в мезентеріальні лімфатичні вузли є ще одним раннім механізмом збільшення фактора некрозу пухлини-альфа, кофактору eNOS тетрагідробіоптерпіну та одержуваного eNOS NO [41] .
При декомпенсованому цирозі також індукована форма NOS (iNOS) регулюється в мезентеріальних артеріях [42, 43], хоча його активна роль у підвищеній біодоступності NO у мезентеріальному судинному руслі чітко не продемонстрована. NO також є ангіогенним фактором, і він може відігравати роль у підвищеному спланхнічному ангіогенезі, що характеризує портальних гіпертонічних щурів [44]. При експериментальному цирозі з портальною гіпертензією посилений мезентеріальний ангіогенез може бути скасований хронічним пригніченням утворення NO [45] .
Однак NO/eNOS - не єдина система, яка бере участь у брижовій вазодилатації цирозу. Дійсно, хронічне введення інгібітора NOS у асцитичних циротичних щурів лише частково коригує мезентеріальну вазодилатацію [35, 43], впливаючи тим самим на інші вазоактивні системи у зниженні мезентеріальної резистентності. PGI2, ендогенний вазодилататор, що продукується судинними ендотеліальними клітинами, підвищений у пацієнтів з цирозом [46]. У портальних гіпертензивних щурів було показано посилену експресію ЦОГ-1 у верхній брижовій артерії [47]. Інгібування ЦОГ індометацином знижує портальний тиск, покращує гіпердинамічну циркуляцію [48, 49] і зменшує спланхнічний кровотік [47] .
Було помічено, що у верхній брижовій артерії циротичних щурів, які отримували як інгібітори NOS, так і COX, гіперполяризуючий фактор, отриманий ендотелієм (EDHF), може замінити NO та PGI2, індукуючи артеріальну дилатацію [50]. Точна природа EDHF суперечлива; однак метаболіти арахідонової кислоти, катіон K + та перекис водню є основними потенційними кандидатами [51]. Дослідження, проведене нашою групою, припустило, що при цирозі підвищена залежність від NO/PGI2 вазодилатації мезентеріальних артерій обумовлена, принаймні частково, надмірною реакційною здатністю до 11,12-епоксиеікозатрієнової кислоти через підвищену експресію міоендотеліальних щілинних з’єднань [52] .
ЕК - це всюдисущі ліпідні сигнальні молекули, які визначають центральний та периферичний ефекти за допомогою специфічних рецепторів CB1 та CB2. Експериментальні дані свідчать про те, що ЕК сприяють розвитку спланхнічної вазодилатації та портальної гіпертензії шляхом надмірної активації рецепторів CB1 у мезентеріальній судинці [51, 57 - 59]. Ефекти ЕК на спланхнічні судини, здається, зумовлені як збільшенням вироблення NO [57], так і механізмом, що не залежить від NO, оскільки в ізольованих брижових артеріях від циротичних щурів денудація ендотелію не скасовує судинорозширювальний ефект [60]. .
У пацієнтів із хронічними захворюваннями печінки також спостерігалась вегетативна дисфункція, і периферична вазодилатація, ймовірно, також є наслідком зниження реактивності на судинозвужувальні системи, такі як симпатична нервова система [61], вазопресин, ангіотензин II та ЕТ-1. Вегетативна дисфункція часто пояснюється пов'язаною з алкоголем невропатією, проте можуть бути задіяні й інші механізми, оскільки нейропатія частіше зустрічається у хронічних зловживаючих алкоголем з пошкодженням печінки, ніж у їхніх аналогах без ураження печінки [62]. Зниження регуляції або зниження спорідненості рецепторів до судинозвужувальних препаратів може пояснити стійку системну та спланхнічну вазодилатацію, яка відбувається, незважаючи на активацію судинозвужувальних систем. Нарешті, знижена регуляція або порушення судинозвужувальної активації Rho-кінази можуть представляти подальший механізм, що сприяє дефектній скоротливості при цирозі [63] .
При цирозі з портальною гіпертензією збільшення мезентеріального кровотоку не є єдиним фактором, що визначає збільшення притоку крові в порталі, оскільки кровотік селезінки також посилюється [64]. Дійсно, було помічено, що у пацієнтів з цирозом та портальною гіпертензією кровотік в селезінці збільшується в більшій мірі, ніж мезентеріальний [65, 66]. У той час як у здорових суб'єктів селезінка сприяє портальному кровотоку лише приблизно на 40% [24], у хворих на цироз селезінка становить більше 50% портального притоку [67]. Це збільшення кровотоку селезінки спостерігалося у пацієнтів з цирозом та спленомегалією [64, 68]. Більше того, існує кореляція між розміром селезінки та діаметром ворітної вени [69, 70], кровотоком селезінки [71, 72] та ворітним кровотоком [69, 73] .
Ці дані свідчать про те, що при цирозі застій селезінки не є пасивним явищем, і селезінка активно сприяє підтримці портальної гіпертензії, перевантажуючи портальну систему [17] .
При цирозі гіпердинамічний кровообіг характеризується збільшенням серцевого викиду та частотою серцевих скорочень та зниженням системного судинного опору при низькому артеріальному артеріальному тиску [74, 75]. Основною причиною появи синдрому є системна та спланхнічна вазодилатація, яка з часом призводить до відхилень в роботі серцево-судинної системи та декількох регіональних судинних русел. Хронічне введення інгібітора NOS у асцитичних циротичних щурів повністю нормалізувало параметри гіпердинамічної циркуляції [76], але лише частково коригувало мезентеріальну вазодилатацію [35, 43]. Нейропептид Y, симпатичний передавач норадреналіну, мав виражений портальний гіпотензивний ефект та покращував гіпердинамічну циркуляцію через виражену звуження звуження судин і зменшення планхнічного кровотоку у циррозних щурів з асцитом [77]. .
Колатеральний кровообіг сприяє розвитку гіпердинамічного синдрому як безпосередньо, зменшуючи периферичний опір, так і опосередковано, дозволяючи кишковим вазоактивним речовинам обходити печінку і досягати системного кровообігу. Нейрогенні, біохімічні та місцеві механізми також беруть участь у прогресуванні синдрому [21]. Навіть якщо загальний периферичний та спланхнічний судинний опір помітно знижений, зниження резистентності спостерігається не у всіх судинних руслах [78]. Зниження кровотоку спостерігали в нирках [79 - 82], мозку [83 - 86] та в м’язах [87]. Чим сильніше погіршуються захворювання печінки та розширення судин, тим більше приплив крові до інших органів зменшується [78]. Ниркова вазоконстрикція є наслідком ефективної гіповолемії та активації нейрогуморальної системи, забезпечуючи обгрунтування поліпшення ниркового кровотоку не за допомогою ниркових судинорозширювальних засобів, а за допомогою інфузії альбуміну та плазматичних судинозвужувальних засобів, таких як терліпресин або октреотид [88 - 91] .
У хворих на цироз печінки більший серцевий викид незалежно пов'язаний з вищим градієнтом печінкового венозного тиску та печінковим кровотоком [101]. Незважаючи на збільшення вихідного серцевого викиду, систолічна та діастолічна реакція шлуночків на стрес притупляється разом із гіпертрофією або дилатацією шлуночків та електрофізіологічними відхиленнями, такими як тривалий інтервал QT. У розвитку циротичної кардіоміопатії, здається, беруть участь такі механізми: змінений β-адренергічний сигнал [102, 103], дисфункція мембрани кардіоміоцитів та активація кардіодепресивних речовин, таких як NO, цитокіни та ЕК [104]. .
Кілька терапевтичних стратегій ускладнень портальної гіпертензії спрямовані на зниження портального тиску шляхом зменшення притоку порталу, таким чином висвітлюючи патогенну роль спланхнічної вазодилатації та синдрому гіпердинамічного кровообігу.
На останній конференції Бавено (травень 2010 р.) Терапевтичні рекомендації щодо неселективних β-адреноблокаторів включали первинну профілактику кровотеч із варикозно-шлунково-кишкового варикозу та профілактику повторних крововиливів [105]. Ефективність неселективних бета-блокаторів у пацієнтів з портальною гіпертензією зумовлена тим, що вони підвищують спланхнічну резистентність та зменшують серцевий викид, зменшуючи тим самим приплив порталів [106] .
При цирозі підвищення портального тиску, яке відповідає за виникнення таких ускладнень, як шлунково-кишкові крововиливи, асцит, печінкова енцефалопатія, гепато-нирковий синдром, гепато-легеневий синдром та спонтанний бактеріальний перитоніт, зумовлене не тільки посиленням внутрішньопечінкової стійкості до портальний відтік крові, але також до збільшення припливу спланхнічної крові до портальної судинної системи.
Збільшення спланхнічного кровотоку визначається судинорозширенням артеріальних судинних судин як у селезінковому та брижовому судинних руслах, так і шляхом розвитку колатерального кровообігу. Збільшення вироблення NO у судинному руслі спланхнічного каналу вважається головним фактором, що сприяє вазодилатації спланхнозу. Однак деякі інші молекули, такі як PGI2, EDHF, CO та EC, також відіграють свою роль. Спланхнічна вазодилатація призводить до розвитку синдрому гіпердинамічного кровообігу, який характеризується збільшенням серцевого викиду та частоти серцевих скорочень та зниженням системного судинного опору при низькому артеріальному артеріальному тиску. Розуміння патофізіології спланхнічної вазодилатації та синдрому гіпердинамічного кровообігу має важливе значення для профілактики та лікування ускладнень портальної гіпертензії.
P- Рецензенти: Xie F, Kanda T, Singh V, Toso C S- Редактор: Cui XM L- Редактор: A E- Редактор: Wang CH
- Ризик збільшення лівого передсердя у пацієнтів із ожирінням із синдромом гіповентиляції, спричиненим ожирінням, проти
- Пояснення щодо НАЖХП, НАСГ та цирозу та жирової печінки
- Псевдотуморний синдром Церебрі з вирішенням після припинення дієти з високим вмістом вітаміну А
- Фактори, що сприяють гіповентиляції ожиріння - RTSleepWorld
- Синдром Ремхельда - FindZebra