Слюда, що входить до складу слюди, має хіміопрофілактичний потенціал через зупинку G1 та інгібування проліферації та рецептора 2 судинного ендотеліального фактора росту в клітинах HCT колоректального раку
Сун-Юн Чо
1 Науково-дослідний центр з питань профілактики раку, Коледж корейської медицини, Університет Кюн Хі, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Сеул, Південна Корея
Хе-Чонг Лі
1 Науково-дослідний центр з профілактики ракових захворювань, Коледж корейської медицини, Університет Кюн Хі, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Сеул, Південна Корея
Сон-Мі Чо
1 Науково-дослідний центр з питань профілактики раку, Коледж корейської медицини, Університет Кюн Хі, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Сеул, Південна Корея
Бонглі Кім
1 Науково-дослідний центр з питань профілактики раку, Коледж корейської медицини, Університет Кюн Хі, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Сеул, Південна Корея
Йон Квон Юнг
2 SeoBong Biobestech Co, 831 Yeoksam-dong, Gangnam-gu, Ltd.Hye Cheon Bldg # 401, 135-080, Сеул, Республіка Корея
Сун Хун Кім
1 Науково-дослідний центр з питань профілактики раку, Коледж корейської медицини, Університет Кюн Хі, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Сеул, Південна Корея
Анотація
Передумови
Незважаючи на те, що слюда, тонкий і схожий на мінерали, мінерал, використовувалася як мінеральне ліки для лікування кровотеч, дизентерії та запалення в традиційній медицині, включаючи Аюрведу, біологічні докази слюди дотепер чітко не з'ясовані. Таким чином, у цьому дослідженні протипухлинний механізм слюди, що має частки (STB-HO), вивчався при раку прямої кишки.
Методи
Голим мишам з атимічної залози інокулювали клітини раку товстої кишки HCT116 і перорально вводили STB-HO щодня протягом 41 дня, а клітини HCT116 та ендотеліальні клітини пуповинної вени (HUVEC) обробляли STB-HO протягом 0
24 години для проведення імуноблотингу, аналізу цитотоксичності, аналізу FAC та вимірювання секреції матриксної металопротеїнази 9 (MMP-9) та інших експериментів. Значущі відмінності всіх дат оцінювали за допомогою t-критерію Стьюдента та багаторазового тесту Туреччини-Крамера.
Результати
STB-HO суттєво пригнічував об'єм та вагу пухлини у мишей з голими тимами, інокульованих клітинами HCT116 у дозі 100 мг/кг. Таким чином, протипухлинний механізм STB-HO in vivo також повинен був з'ясуватись in vitro. STB-HO виявив цитотоксичність у клітинах раку прямої кишки HCT116, SW620 та HCT15. Крім того, STB-HO збільшував популяцію клітин G1 залежно від часу та концентрації, посилював експресію p21, p27, p53 як інгібіторів циклінозалежної кінази (CDK), послаблював експресію проліферуючих клітинних ядерних антигенів (PCNA) та циклін D1 та також зменшила продукцію судинного ендотеліального фактора росту (VEGF) та матричної металопротеїнази 9 (MMP-9) у клітинах HCT116. Послідовно STB-HO пригнічував фосфорилювання VEGFR2 у клітинах HCT116, SW620 та HCT15. Крім того, STB-HO інгібував опосередковану VEGF проліферацію, а також послаблював фосфорилювання VEGFR2 та Akt в ендотеліальних клітинах пуповинної вени людини (HUVEC).
Висновки
У сукупності ці висновки свідчать про те, що STB-HO має хіміопрофілактичний потенціал через зупинку G1 та інгібування проліферації та VEGFR2 у клітинах колоректального раку HCT116.
Передумови
Колоректальний рак (КРР) є однією з провідних причин смертності в західному світі. Хіміотерапія, що включає терапію 5-фторурацилом (5-FU) та хірургічну резекцію, є добре відомими методами лікування раку товстої кишки [1]. Однак побічні ефекти викликаються хіміотерапією, такою як мукозит порожнини рота, діарея, нейропатія, анемія та алопеція [2]. Так, нещодавно повідомлялося, що природні продукти [3] та сполуки [4-6] мають протипухлинний ефект при колоректальному раку як окремо, так і в поєднанні з протипухлинними засобами [7] з низькою токсичністю. Також Ху та співавт. припустили, що серед чоловіків та жінок, які приймали вітамінно-мінеральні добавки більше 5 років, значні зворотні асоціації з раком товстої кишки були найбільш вираженими серед жінок з дистальним раком товстої кишки [8]. Подібним чином є дані, що мінеральний селен має протипухлинну активність при раку товстої кишки [9-12].
Група слюди листових силікатних мінералів, як правило, класифікується як триоктаедрична слюда, включаючи біотіт, лепідоліт, московіт, флогопіт, цинвальвальд і дефіцит проміжних слюд [13]. Слюда використовується для прикраси та лікування кровотеч, дизентерії та запалення в традиційній медицині, включаючи Аюрведу, протягом століть. Насрін та ін. не виявив токсичності Хондрокола Рош, традиційного металевого аюрведичного препарату, що включає різні обсмажені метали (Hg та Cu), неметали (сірка та слюда) та лікарські трави [14]. Також було відомо, що слюда захищає слизову шлунка шляхом поліпшення кровотоку та запальної реакції [15], а також пригнічує рак шлунка за допомогою регулювання р16 та Bcl-2 у щурів [16], що вказує на те, що слюда може використовуватися як ліки [17]. Таким чином, у цьому дослідженні протипухлинний механізм слюди (STB-HO) досліджували in vitro при колоректальному раку HCT116 та ендотеліальних клітинах пуповинної вени людини (HUVEC) та атимічних оголених мишах, інокульованих клітинами HCT116.
Методи
Хімічні речовини та реактиви
Культура клітин
SW620 (ATCC CCL-227 ™), HCT116 (ATCC CCL-247 ™) та клітини HCT15 (ATCC CCL-225 ™) висівали на 100-міліметрові пластини Falcon при 2 × 10 6 клітин/мл у RPMI 1640, доповнену 10% FBS і 1% пеніциліну/стрептоміцину. Клітини культивували при температурі 37 ° С у зволоженій атмосфері, що містить 5% СО2 до 60–80% злиття, а потім використовували для вестерн-блот-аналізу. STB-HO обробляли різними клітинами раку товстої кишки людини протягом 24, 48, 72 та 96 годин. HUVEC підтримували в M199 плюс 20% інактивованої фетальної бичачої сироватки (FBS), 3 нг/мл bFGF, 5 одиниць/мл гепарину, 100 одиниць/мл антибіотико-антимікотичного розчину (повний M199) в 0,1% колбах, покритих желатином, та інкубували при 37 ° C у зволоженій атмосфері, що містить 5% CO2. Після злиття клітини відокремлювались розчином трипсину-ЕДТА і використовувались в експериментах з третього по шостий пасажі.
Аналіз цитотоксичності
Цитотоксичність STB-HO оцінювали за допомогою аналізу 3- (4,5-диметилтіазол-2-іл) -2,5-дифеніл тетразолію броміду (МТТ). Коротко кажучи, HUVEC висівали на 0,1% покриті желатином 96-лункові мікропланшети при щільності 5 × 10 3 клітин на лунку та обробляли різними концентраціями STB-HO (0, 15,63, 31,25, 62,5 125, 250, 500 або 1000 мкг/мл) протягом 48 год. Після зазначеного часу інкубації розчин МТТ (1 мг/мл) (Sigma Chemical Co., Сент-Луїс, Міссурі) додавали протягом 2 год, а потім додавали буфер для лізису МТТ (20% SDS і 50% диметилформаміду) протягом ночі. Оптичну щільність (OD) вимірювали за допомогою зчитувача мікропланшетів (TECAN, Австрія) при 570 нм. Життєздатність клітин розраховували як відсоток життєздатних клітин у групі, обробленій STB-HO, порівняно з необробленою контрольною групою, дотримуючись рівняння.
Аналіз розповсюдження
Проліферацію клітин у клітинах HCT116 із STB-HO оцінювали, як описано за допомогою набору ELISA для клітинної проліферації (Roche, Swiss) відповідно до інструкцій виробника. Коротко, після 48 годин обробки STB-HO клітини додавали 10 мкл/лунку розчину бромодезоксиуридину (BrdU) і повторно інкубували протягом 2 годин при 37 ° C. Потім розчин BrdU видаляли і в кожну лунку додавали 200 мкл FixDenat. Після інкубації протягом 30 хв при кімнатній температурі розчин FixDenat видаляли і до кожної лунки додавали 100 мкл робочого розчину anti-BrdU-POD. Після триразового промивання PBS до кожної лунки додавали 100 мкл розчину субстрату і вимірювали оптичну щільність при 450 нм за допомогою зчитувача мікропланшетів (Molecular Devices Co., Саннівейл, Каліфорнія, США). Всі зразки готували у трьох примірниках і аналіз повторювали принаймні три рази.
Аналіз клітинного циклу
Клітини HCT116 обробляли STB-HO (250 та 500 мкг/мл) протягом 24, 48 та 72 год. Клітини фіксували в 75% етанолі при -20 ° C і обробляли РНКазою А (10 мг/мл) протягом 1 год при 37 ° C, фарбували йодидом пропідію (PI) (50 мкг/мл) та аналізували на ДНК вміст FACSCalibur (Becton – Dickinson, Franklin Lakes, NJ, USA) з використанням програмного забезпечення CellQuest (BD Bio-Sciences, Сан-Хосе, Каліфорнія, США).
Вестерн-блот
Клітини (5 × 10 6 клітин), оброблені STB-HO, лізували за допомогою буфера для лізису (50 мМ Tris – HCl, рН 7,4, 300 мМ NaCl, 0,5% Triton X-100, 0,1% SDS, 5 мМ EDTA та протеази інгібіторний коктейль). Екстракти інкубували на льоду протягом 30 хв, а потім центрифугували при 13000 × g протягом 30 хв при 4 ° C і супернатанти збирали для вестерн-блот. Концентрації білка визначали за методом Бредфорда (Bio-Rad), а рівні кількості білків (30 мкг) відокремлювали електрофорезом додезилсульфат натрію в поліакриламідному гелі (SDS-PAGE) і переносили на мембрани PVDF (Amersham Biosciences, Piscataway, NJ, США). Мембрани блокували 5% знежиреного молока в солі, забуференному Трис, що містить 0,1% Твін 20, протягом 2 год при кімнатній температурі. Мембрани досліджували протягом ночі при 4 ° C за допомогою мишачого анти-людського β-актину (1: 1000; Sigma Aldrich, Сент-Луїс, Міссурі, США), анти-людського pAKT, AKT, p21, p27, p53, pp53, циклін D1, PCNA та PI3K (1: 1000; сигналізація клітин, Danvers, MA, США), VEGFR2 проти людини та pVEGFR2 (1: 500; Біотехнологія Санта-Крус, Каліфорнія, США) з подальшим промиванням та інкубацією з кон'югованим HRP вторинним антитілом ( AbD Serotec, Ролі, Північна Кароліна, США). Імунореактивні смуги візуалізували за допомогою системи ECL (Amersham-Pharmacia, Сеул, Корея).
Вимірювання виробництва VEGF та MMP-9 методом ІФА
Рівні VEGF та MMP-9 у клітинах HCT116, оброблених STB-HO, вимірювали за допомогою набору VEGF та MMP-9 ELISA (Invitrogen, Карлсбад, Каліфорнія, США) відповідно до інструкцій виробника. Коротко, культуральний супернатант додавали на 96-лункову мікропланшет і інкубували протягом 2 годин при кімнатній температурі. Потім планшет чотири рази промивали промивним буфером і 100 мкл кон'югату біотину поміщали в кожну лунку на 1 год при кімнатній температурі. Після чотириразового промивання промивним буфером по 100 мкл стабілізованого хромогену поміщали в кожну лунку та інкубували протягом 30 хв при кімнатній температурі в темряві. Нарешті, до кожної лунки додавали 100 мкл стоп-розчину і вимірювали оптичну щільність при 450 нм за допомогою зчитувача мікропланшетів (Molecular Devices Co., Саннівейл, Каліфорнія, США).
Модель ксенотрансплантата HCT116
Аналіз даних
Дані були показані як середні значення ± SE. Значущі відмінності оцінювали за допомогою t-критерію Стьюдента та багаторазового порівняльного тесту Туреччини-Крамера.
Результати
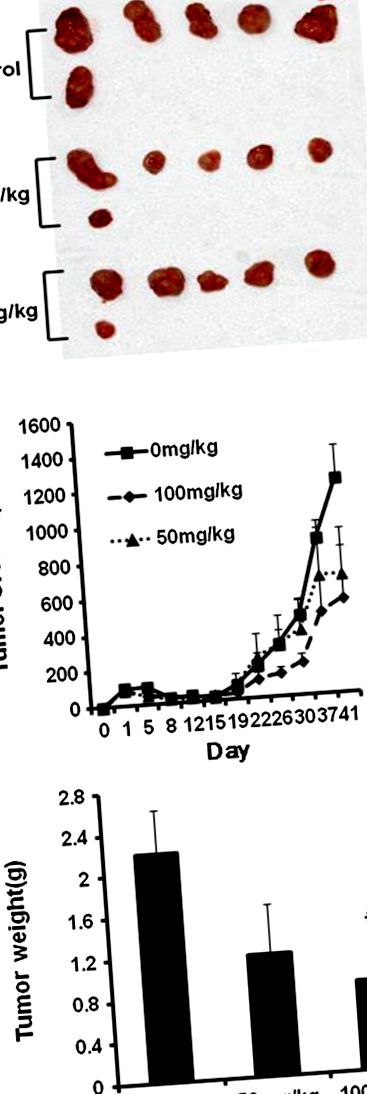
STB-HO пригнічує ріст пухлини в моделі ксенотрансплантата HCT116
Як показано на малюнку 1 B, STB-HO пригнічував ріст ракових клітин HCT116, інокульованих у мишей BALB/c атимічних оголених у дозах 50 і 100 мг/кг, не впливаючи на масу тіла (дані не наведені). Послідовно, лікування STB-HO зменшувало вагу пухлини залежно від дози порівняно з необробленою групою після жертвоприношення тварин, але статистичну значимість було визнано лише між контрольною групою та групою, яка отримувала STB-HO (100 мг/кг) (Рисунок 1 A, C ).
Вплив STB-HO на масу пухлини та ріст у мишей-голих атимусів, інокульованих клітинами HCT116. Через три дні після інокуляції клітин HCT116 STB-HO (50 та 100 мг/кг маси тіла) вводили перорально щодня. (A) Фотографії розсічених пухлин у мишей. (B) Зростання пухлини в часі. (C) Кінцева вага пухлини в кінці експерименту. Значення були середніми ± SD, n = 6. * p 2 A, STB-HO суттєво пригнічує проліферацію клітин у клітинах раку товстої кишки людини. Зокрема, придушення проліферації клітин шляхом лікування STB-HO було більш ефективним у ракових клітинах HCT 116 порівняно з іншими раковими клітинами прямої кишки, такими як клітини SW620 та HCT15. Послідовно, аналіз BrdU показав, як показано на малюнку 2 B, проліферація клітин HCT116 була зменшена залежно від концентрації шляхом лікування STB-HO, що означає, що STB-HO інгібує проліферацію колоректальних ракових клітин.
Вплив STB-HO на морфологію клітин HCT116, SW620 та HCT15 та проліферацію клітин HCT116. (A) STB-HO обробляли клітинами HCT116, SW620 та HCT15 протягом 96 год, а зображення клітин знімали за допомогою мікроскопа (X200). (B) Клітини HCT116 обробляли STB-HO протягом 48 годин, а проліферацію клітин вимірювали за допомогою набору ELISA для проліферації BrdU (Roche, Swiss).
STB-HO викликає зупинку G1 у клітинах колоректального раку HCT116
Аналіз клітинного циклу проводили, щоб з’ясувати вплив STB-HO на ракові клітини HCT116. STB-HO суттєво збільшив популяцію G1 у клітинах HCT116 залежно від часу (рис. 3 А). Через день після лікування STB-HO експресія p21, p27 та pp53 як інгібіторів CDK значно збільшилася в клітинах HCT116 (рис. 3 B). Крім того, STB-HO пригнічував експресію цикліну D1 та PCNA, які регулюють клітинний цикл (рис. 3 Б). Ці дані вказують на те, що STB-HO індукує зупинку G1, що має вирішальне значення для пригнічення проліферації та індукції апоптозу в клітинах колоректального раку HCT116.
Вплив STB-HO на pVEGFR2, PI3K та Akt у клітинах раку товстої кишки. (A) Базальна експресія pVEGFR2 була підтверджена в різних клітинах раку товстої кишки вестерн-блот. (B) STB-HO (0, 250 або 500 мкг/мл) обробляли в клітинах раку товстої кишки HCT15, SW620 та HCT116 протягом 24 годин. Вестерн-блотинг проводили для визначення експресії pVEGFR2, VEGFR2, PI3K, pAKT, AKT та β-актину в клітинах раку товстої кишки, оброблених STB-HO.
STB-HO інгібує опосередковану VEGF проліферацію та фосфорилювання VEGFR2 та Akt у HUVEC
Як показано на малюнку 6 А, аналіз МТТ показав, що STB-HO не виявляє жодної цитотоксичності у HUVEC як нормальна клітинна лінія. Крім того, для підтвердження антиангіогенної активності STB-HO у HUVEC, аналіз проліферації проводили у HUVEC, оброблених VEFG, методом MTT. Як показано на малюнку 6 B, STB-HO інгібує індуковану VEGF проліферацію HUVECs залежно від дози при нетоксичних концентраціях у HUVEC. Крім того, як показано на малюнку 7, STB-HO пригнічує фосфорилювання VEGFR-2 та Akt у HUVEC порівняно з необробленим контролем.
- Ожиріння та вік впливають на потенціал фертильності чоловіків - ScienceDirect
- Ожиріння як потенційний фактор ризику аденокарцином та плоскоклітинних карцином матки
- Перспективний метаботипування - Потенційна персоналізована стратегія харчування для точної профілактики
- Нейронні сигнали регулюють проліферацію β-клітин, спричинену ожирінням, за допомогою механізму, залежного від FoxM1 - PubMed
- Лікування ожиріння фекальною мікробіотою показує потенціал, зазначає дослідження