Ситість
Насиченість визначається як стан загальмованості подальшого прийому їжі, що настає після закінчення епізоду прийому їжі та виникає внаслідок наслідків прийому їжі.
Пов’язані терміни:
- Поведінка годування
- Витрати енергії
- Збільшення маси тіла
- Втрата маси тіла
- Апетит
- Калорійність
- Спорожнення шлунку
- Гіпоталамус
Завантажити у форматі PDF
Про цю сторінку
Ситість
Визначення ситості
Ситості можна зрозуміти лише стосовно всієї системи контролю апетиту. Таким чином, стан ситості досягається споживанням достатньої кількості їжі за певний проміжок часу. Прийом їжі обумовлений потужною біологічною потребою в отриманні достатньої кількості енергії для підтримки життя. Однак їжа починається до того, як відчувається значний дефіцит їжі, а прийом припиняється до надходження поживних речовин до системи. Недавні теорії того, що контролює споживання їжі, перейшли від суто гомеостатичного до пропозиції, що існує як прямий, так і непрямий контроль вживання їжі. Ідея, яку вперше запропонував Сміт у своїй основній статті з 1996 року. Для того, щоб забезпечити контекст для досліджень ситості, буде наведено короткий історичний аналіз, а потім обговорено докази з альтернативних теорій; тоді сенсорно-специфічне насичення (SSS) ілюструється як один із прикладів ситості, пов’язаного з конкретною їжею. Наслідки цього дослідження для споживача будуть обговорені як щодо регулювання ваги, так і інших переваг посиленої ситості.
Ситість
Майкл М. Мегід,. Акіо Інуї, в Енциклопедії гастроентерології, 2004
Холецистокінін
Холецистокінін є важливим сигналом, який бере участь у регулюванні споживання їжі. Це сигнал про насичення, який діє як паракринна речовина, щоб стимулювати секрецію підшлункової залози через блукаючі холінергічні волокна, але він також надходить до мозку, щоб надати катаболічний ефект. Крім того, CCK сенсибілізує блукаючий аферент до механічних подразників (наприклад, розтягнення шлунка) і посилює ефекти механічної стимуляції на припинення прийому їжі. Дійсно, механічне розтягнення черевних стінок, зокрема шлункової стінки, є потужним сигналом ситості, який негайно передається в мозок за допомогою нервових аферентів. Також наявність поживних речовин у кишечнику стримує прийом їжі та спорожнення шлунка.
СИТУАЦІЯ І АПЕТИТ | Роль ситості в харчуванні
Наукова концепція ситості
Ситість - це спеціально інгібуючий вплив дієтичного споживання на апетит. Зниження голоду або спраги, за визначенням, повинно бути спричинене якимись наслідками прийому всередину. В дослідженнях ситості недостатньо лише реєструвати оцінки ситості. Це можуть бути градуйовані вираження відчуття наповненості живота, бажання з’їсти лише невелику кількість, усвідомлення того, скільки з’їдено та як нещодавно, або інший захід, що спричиняє відмову від їжі. Необхідно показати, що витоки відсутності апетиту включають ефект прийому їжі, щоб рейтинг був справжнім показником насичення. (Див. ЗАДОВОЛЕННЯ ТА АПЕТИТИ | Їжа, харчування та апетит.)
Науковий аналіз насичення вимагає виявлення впливу їжі, що зменшує апетит. Насиченість - це не відповідь, а робота типу механізму.
Управління ожирінням
Шлункові детермінанти симптомів після їжі та насичення
Насичення - це відчуття ситості під час їжі, яке спричиняє припинення прийому їжі; ситість - це ступінь насичення, який зберігається до споживання наступного прийому їжі після періоду голодування [5,6], і регулює частоту прийому їжі. Насичення оцінюється на практиці за об’ємом, що вживається для досягнення повноти, та максимально допустимим обсягом поживного напою (1 ккал/мл), що вживається зі швидкістю 30 ккал/хвилину [7]. Насиченість оцінюється загальним споживанням калорій під час шведського столу ad libitum [8] після стандартного періоду голодування (наприклад, 4 години) та стандартного попереднього прийому їжі (наприклад, рідкого сніданку об’ємом 300 ккал).
Дослідження, засновані на сотнях пацієнтів з диспепсією, переконливо показали, що моторні функції шлунка (такі як спорожнення та акомодація), внутрішньошлунковий тиск [9] та шлункові відчуття є важливими факторами, що визначають інтрапрандіальні та постпрандіальні симптоми [10-12] .
Інші дослідження показали збільшення обсягу шлунка у пацієнтів із розладом переїдання [13] .
Гомеостаз та бюджети часу
Майкл Д. Брід, Дженіс Мур, “Поведінка тварин” (друге видання), 2016
Ситість
Ситість - це відчуття ситості після їжі. Ключовими нейромедіаторами, що контролюють апетит, принаймні у хребетних, є серотонін (5-НТ) та катехоламін. Ці нейромедіатори діють на зменшення поведінки під час годування і, відповідно, споживання їжі. Споживання вуглеводів може спричинити як підвищення рівня серотоніну, так і катехоламіну, а також зміну кількості їх рецепторів. Одним з ефектів збільшення споживання вуглеводів є підвищення сировини, доступної в мозку для синтезу нейромедіаторів; це харчується у вигляді пригніченого апетиту. Однак відносини складні, і споживання вуглеводів не завжди призводить до насичення.
Картина щодо насичення у комах набагато простіша. Стретч-рецептори виявляють ступінь розширення шлунка, що супроводжує годування. Принаймні у комах, які найбільш вивчаються на насичення (комарі, мухи та медоносні бджоли), годування припиняється, коли шлунок повністю розтягнутий. Роблячи невеликий розріз через стінку тіла і проколюючи шлунок, щоб потрапляючі рідини стікали, призводить до безперервного нерегульованого годування, як і розрив нерва, який обслуговує рецептори розтягування.
Кортикальна обробка корисної вартості їжі
Ситості Сигнали
Кортикальна обробка корисної вартості їжі ☆
Ситості Сигнали
Дієта з вуглеводами, з’їденою переважно за вечерею: інноваційний, дієтичний підхід до припинення порочного циклу абдомінального ожиріння
Голод/ситість і думки про їжу
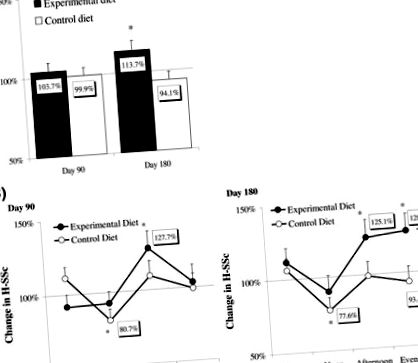
Малюнок 35.1. (A) Найменше квадратне значення ± показники голодомору за SE (H-SSc) на 90-й день та 180-й день як відсоток базового рівня (середнє значення денного насичення в 0-й та 7-й дні) в експериментальному (n = 18) та контрольному ( n = 21) групи. Порівняння груп за повторними вимірами ANOVA. ∗ P ∗, P #, P = 0,030, порівняння контрольної та експериментальної груп за допомогою контрастного t-тесту після повторних вимірювань ANOVA на 180 день.
Джерело: Sofer et al. [31] .
Виробництво коротколанцюгової жирної кислоти та функціональні аспекти метаболізму господаря
2.1.3.6.2.3 SCFA-регулює апетит, споживання їжі та витрати енергії за допомогою осі кишечник-мозок та використовуючи довго- та короткочасні опосередковані SCFA гормони
Колись вважалося, що ситість контролюється ядром вентромедіального гіпоталамуса, хоча нині значні докази вказують на те, що регулювання харчування, споживання та витрати енергії та маси тіла є гомеостатичним процесом (Wilding, 2002). Інформація про ініціювання та припинення прийому їжі регулюється за допомогою нервових сигналів, що виникають в гіпоталамусі, який в основному регулюється дугоподібним ядром (ARC), розташованим в основі цієї області між третім шлуночком і серединною висотою (Murphy and Bloom, 2004) . ARC інтегрує енергетичні гомеостатичні механізми зворотного зв'язку від довгострокових та короткочасних нейронних сигналів. Нижні центри мозку або заднього мозку також можуть відчувати поживні речовини та інші сигнали з периферії (Гриль, 2006). Оскільки задній мозок не знаходиться в межах гематоенцефалічного бар’єру (Murphy and Bloom, 2004), він має доступ до багатьох периферичних пептидів. Nucleus tractus solitarii (NTS), специфічна анатомічна область в області постреми в задньому мозку, частина дорсального вагусного комплексу (ДВК), сприймає інсулін, глюкозу та інші пептиди, отримуючи надходження від дорсального рухового ядра блукаючого аферентного, і спілкується в АРК та інших відділах переднього мозку для координації харчової поведінки та енергетичного обміну.
ARC постійно отримує короткочасні та довгострокові гормональні та короткочасні поживні сигнали від периферійних тканин через напівпроникні капіляри в основній середній висоті та отримує зворотний зв'язок нейронів від NTS. Ці комбіновані периферійні та центральні сигнали діють для здійснення гомеостатичного контролю над споживанням їжі, рівнями фізичної активності, витратою базальної енергії та ендокринною системою. Нейронні ланцюги мозку інтегрують інформацію з NTS та множинні ядра гіпоталамусу для регулювання загального гомеостазу організму (Кук та Блум, 2006), рис. 2.7 .
Гормони, що виділяються кишечником, мають інкретиновий, орексигенний та анорексигенно-стимулюючий ефект, включаючи інкретинові гормони, GLP-1, GIP та потенційно OXM, які покращують реакцію ендокринної підшлункової залози на поглинаються поживні речовини. GLP-1 та OXM також зменшують споживання їжі. Грелін, гормон, що виділяється шлунком, стимулює апетит. Гормони кишечника, що стимулюють ситість, включають холецистокінін (CCK), що виділяється з кишечника до зворотного зв'язку через блукаючий нерв, і OXM і PYY з товстої кишки, а також поліпептид підшлункової залози (PP), що виділяється з острівців Лангерганса.
Малюнок 2.8. Спрощена схема дії пептиду кишечника на гіпоталамус.
Як показано на рис. 2.8, ARC містить нейрони, які коекспресують нейропептид Y (NPY) та пов'язаний з Агуті пептид (AgRP), два пептиди, які стимулюють апетит та споживання їжі, зменшують витрати енергії та сприяють збільшенню маси тіла (показано ЗЕЛЕНИМ). Орексигенні дії NPY опосередковуються активацією рецепторів Y1 та/або Y5 (Raposinho et al., 2004), тоді як дії AgRP виникають внаслідок антагонізму нейрональних рецепторів меланокортину (MC3 та 4) (Ellacott and Cone, 2004). Оскільки сигналізація про меланокортин зменшує споживання їжі та збільшує витрати енергії, блокування MC3r та MC4r за допомогою AgRP збільшує споживання їжі та зменшує витрати енергії, ефекти, аналогічні експресії NPY. Анаболічні дії NPY та AgRP опосередковані нижчими ділянками, стимульованими цими чутливими до інсуліну та лептину нейронами першого порядку.
- Співвідношення білкової енергії - огляд тем ScienceDirect
- Значення білка - огляд тем ScienceDirect
- Pentatrichomonas hominis - огляд тем ScienceDirect
- Снек-бар - огляд тем ScienceDirect
- Перитонеальна рідина - огляд тем ScienceDirect