S100A4 при прогресуванні та метастазуванні раку: систематичний огляд
Фей Фей
1 Медична школа Нанкайського університету, Університет Нанкаї, Тяньцзінь, 300071, Китайська Республіка
2 Відділення патології, Медичний центр Союзу Тяньцзінь, Тяньцзінь, 300121, Китай
Jie Qu
1 Медична школа Нанкайського університету, Університет Нанкаї, Тяньцзінь, 300071, Китайська Республіка
2 Відділення патології, Медичний центр Союзу Тяньцзінь, Тяньцзінь, 300121, Китай
Мінцин Чжан
3 Відділ колоректальної хірургії, Медичний центр Союзу Тяньцзінь, Тяньцзінь, 300121, Китай
Ювей Лі
3 Відділ колоректальної хірургії, Медичний центр Союзу Тяньцзінь, Тяньцзінь, 300121, Китай
Сіву Чжан
2 Відділення патології, Медичний центр Союзу Тяньцзінь, Тяньцзінь, 300121, Китай
Анотація
Метастази є основною причиною смерті, пов’язаної з раком, і безпосередньо пов’язаний із прогресуванням раку, стійкістю до протипухлинної терапії та поганою виживаністю пацієнтів. Поточні зусилля, спрямовані на основні молекулярні механізми метастазування раку, привертають особливу увагу дослідників раку. Епітеліально-мезенхімальний перехід - це комплекс молекулярних програм під час ембріогенезу, запалення, фіброзу тканин, прогресування та метастазування раку. S100A4, важливий член білків сімейства S100, функціонує для збільшення прогресування пухлини та метастазування. Молекулярні механізми S100A4, що беруть участь у прогресуванні та метастазуванні, різноманітні при різних злоякісних пухлинах. Виявлення експресії S100A4 стає перспективним біомаркером у ранній діагностиці та прогнозуванні метастазів раку, а отже, S100A4 може бути терапевтичною мішенню. У цьому огляді узагальнено сучасні досягнення щодо ролі S100A4 у розвитку раку людини, прогресуванні та метастазуванні та основних молекулярних подіях, а потім стратегіях експериментального націлювання на експресію S100A4.
ВСТУП
S100A4 відіграє важливу роль у інвазії та метастазуванні злоякісних пухлин людини. Таким чином, цей огляд систематично узагальнює функції та роль S100A4 у розвитку, прогресуванні та метастазуванні раку людини, а також основні молекулярні події та стратегії для експериментальної націленості на експресію S100A4.
Білки S100 та їх потенційні функції в клітинах і тканинах людини
Білки S100 містять типовий мотив EF-руки, який при зв’язуванні з кальцієм призводить до залежних від кальцію конформаційних змін, змушуючи їх поєднуватися з їхніми цілями нижче і в результаті серії біологічних ефектів [16, 17]. S100A4 не виявляє ферментативної активності, але здійснює свою біологічну функцію завдяки взаємодії з цільовими білками [18], внутрішньоклітинно, позаклітинно або в обох відділеннях, залежно від інших білків [19]. Наприклад, внутрішньоклітинний S100A4 утворює ковалентну взаємодію зі своїми мішенями, включаючи актини, важкий ланцюг важкого ланцюга міозину IIA (NMIIA) та тропоміозин, які всі пов’язані з міграцією клітин [20, 21]. Інші білки-мішені, що зв’язують S100A4, включаючи супресор пухлини p53, метіонінамінопептидазу 2 та лейкоцитарні загальні антиген-пов’язані (LAR) трансмембранні фосфати тирозину, взаємодіючи з білком ліпрін-β1, також можуть сприяти метастазуванню пухлини, однак лише деякі з них підтверджені in vivo [ 22].
Багато видів клітин, включаючи фібробласти, імунні клітини та ракові клітини, можуть виробляти S100A4, який вивільняється у позаклітинний простір у відповідь на різні подразники, такі як активовані нормальні експресовані Т-клітини та секретуючі фактори (RANTES), що виробляються клітинами пухлини [23]. Позаклітинний S100A4 може виділятися в плазму крові як біологічно активна молекула у вигляді мультимерних білків [24, 25]. Клітинна реакція на S100A4 є опосередкованою рецепторами, специфічною для клітин і залежить від конформації S100A4 або від асоціації з кількома іншими рецепторами, такими як рецептор прогресивних кінцевих продуктів глікування (RAGE) на різні типи клітин, включаючи хондроцити людини та простату ракові клітини [26, 27]. Однак RAGE-негативні клітини вказують на те, що інші рецептори можуть брати участь у залежній від S100A4 клітинній активації, такі як Toll-подібний рецептор 4 (TLR4), рецептор епідермального фактора росту (EGFR) та рецептор IL-10 [18, 25].
S100A4 має різні біологічні функції в нормальному стані та при злоякісних захворюваннях людини, включаючи посилення проліферації клітин, ангіогенез, метастазування раку та ухилення від імунітету [28]. Підвищена експресія S100A4 була виявлена при кількох незлоякісних захворюваннях, таких як фіброз тканин, ревматоїдний артрит, псоріаз, пошкодження головного мозку, аутоімунні захворювання та інші [29]. Таким чином, виявлення експресії білка S100A4 може стати перспективним біомаркером для ранньої діагностики раку та прогнозування метастазів раку, підвищуючи можливість розвитку S100A4 як терапевтичної мішені [22]. Однак після цього необхідно визначити та визначити взаємодію S100A4 з іншими білками та їх біологічними функціями, хоча загальновідомо, що S100A4 може зв’язуватися з численними клітинними білками [30].
Роль S100A4 у раку та супутніх регуляторних сигнальних шляхах
Надмірна експресія S100A4 як показник поганого прогнозу та високого метастатичного потенціалу вперше була запропонована при раку молочної залози людини [31]. Поступово його надмірна експресія була виявлена і в інших метастазах раку людини, таких як метастази в печінку [32] та метастази в мозок [33]. S100A4 є індукуючим метастази, але не ініціюючим пухлину онкогеном [15], оскільки він не впливав на туморогенез у трансгенних мишей S100A4, але міг сприяти метастазуванню при надмірній експресії в первинній пухлині, як це спостерігалося на ксенотрансплантатах S100A4-трансгенних мишей, які показали помітне збільшення частоти метастазування в легені [34]. Коли трансгенні миші, які експресували високий рівень S100A4, але не виявляли жодного фенотипового ефекту, спаровувались з мишами, які експресували у мишей трансгенний вірус пухлини молочної залози (MMTV) -neu і піддавалися стохастичній неоплазії молочної залози, експресія S100A4 корелювала з регіонах інвазії первинних уражень та метастазів, що припускає, що S100A4 повинен з'єднатися з онкогеном, щоб викликати рак, і, отже, він не виявляє жодного ефекту у трансгенних мишей [35, 36].
S100A4 сприяє метастазуванню за допомогою ЕМТ
Роль S100A4 у різних злоякісних пухлинах людини
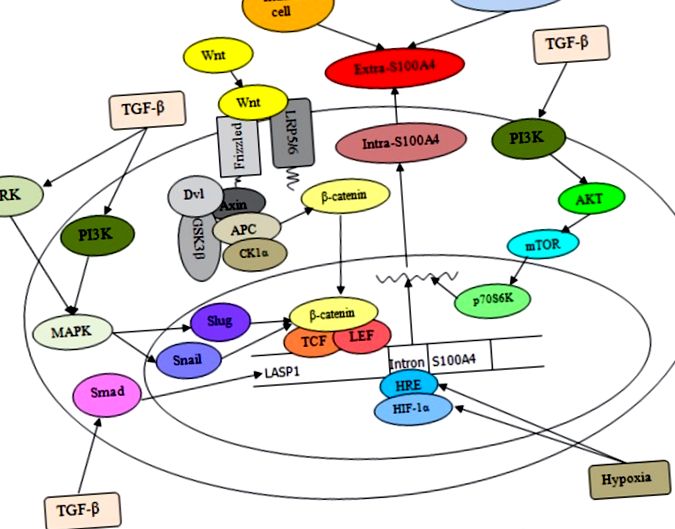
Цей розділ обговорює та оглядає сучасну інформацію про S100A4 при різних загальних злоякісних пухлинах людини. S100A4 експресується не тільки в нормальних клітинах, але і в різних типах ракових клітин [57]. Надмірна експресія S100A4 у ракових клітинах тісно пов’язана з агресивним фенотипом та метастатичною поведінкою раку людини та пов’язана з поганим виживанням хворих на рак [28]. Основні молекулярні події, які визначають потенційну роль S100A4 у раку, включають складну передачу зшиваючих сигналів, як показано на малюнках Рисунки 1 1 та та 2 2 .
Ця схема ілюструє регуляцію та експресію S100A4 в клітинах. Extra-S100A4 може вироблятися фібробластами, імунними клітинами та пухлинними клітинами. Стимуляція TGF-β призводить до збільшення LASP1 і S100A4 шляхом активації шляху Smad, а TGF-β-індукований сигнал ERK і PI3K, що призводить до синергічної регуляції β-катеніну/TCF/лімфоїдного підсилювача фактора, що впливає на слимаків та равликів ( LEF) бере участь у експресії S100A4. Крім того, взаємодія Wnt із завитим рецептором та співрецепторами білків, пов’язаних з рецепторами ліпопротеїнів низької щільності (LRP) 5/6, може інактивувати комплекс руйнування β-катеніну, що призводить до накопичення β-катеніну в цитоплазмі з подальшою його транслокацією в ядро, де він активує транскрипцію цільового гена S100A4 під контролем мотива зв'язування TCF разом з LEF. Більше того, вплив гіпоксії збільшує гіпометилювання першого інтрону (HRE) гена S100A4 та посилює зв'язування HIF-1α з HRE в клітинах пухлини, сприяючи тим самим рівня транскрипції S100A4.
Extra-S100A4, отриманий з клітин пухлини та строми, активує фактор транскрипції NF-κB не тільки регулюючи RAGE, але також індукуючи фосфорилювання IKK α/β, що призводить до посиленого фосфорилювання IκB α (інгібітора білка NF-κB). Крім того, ядерна транслокація внутрішньо-S100A4 через RAGE-залежну регуляцію та опосередковану сумоилированием сигналізацію може викликати каскади нижніх сигналів S100A4 до секреції декількох молекул, таких як OPN, MMP, c-myc, TNF-α та ANXA2, пов'язаних з інвазія пухлинних клітин, яка співпрацює з RhoA, cdc 42, цикліном B1 та NF-κB. Крім того, внутрішньо-S100A4, активований Са 2+, може регулювати стабільність ламеліподій і посилювати міграцію клітин, взаємодіючи з NMIIA; intra-S100A4 також здатний поєднуватися з комплексом Rhotekin – RhoA для сприяння розтріскуванню мембран та інвазії шляхом зв’язування міозину та актину, які пов’язані зі збільшенням утворення поширення пухлинних клітин та метастазування.
Роль S100A4 у сприянні метастазуванню раку молочної залози
S100A4 та рак яєчників
S100A4 та злоякісні пухлини травної системи
S100A4 та злоякісні пухлини сечовидільної системи
Експресія S100A4 виявилася важливим незалежним предиктором віддаленого метастатичного рецидиву та віддаленого виживання без метастазів при інвазивному м’язовому раку сечового міхура [130]. S100A4 індукує розвиток метастатичного фенотипу в моделях гризунів раку сечового міхура, і його експресія була тісно пов'язана з розвитком метастазів раку сечового міхура та поганим виживанням раку сечового міхура людини [131]. У порівнянні з нормальним уротелієм, більшість тканин раку сечового міхура демонструють високу експресію S100A4, особливо при інвазивному раку сечового міхура, присутньому в інвазивних регіонах та в одиничних інфільтруючих клітинах [132]. Експресія S100A4 виявилася фактором ризику інвазії м’язів при раку сечового міхура та виявила, що збільшує м’язову інвазію раку сечового міхура на ранніх стадіях за допомогою експресії MMP-14 [133]. Крім того, встановлено, що метилювання ДНК частково та мінливо бере участь у експресії S100A4 при раку сечового міхура, що пов’язано з помірним гіпометилюванням вмісту CpG [134]. Також повідомляється, що експресія S100A4 є прогностичним біомаркером для пацієнтів з первинним неінвазивним раком сечового міхура, що може бути корисним для медичних онкологів при виборі стратегій лікування [135].
S100A4 та рак легенів
S100A4 та інші злоякісні пухлини
Недавнє дослідження показало, що преференційно експресований антиген меланоми (PRAME) брав участь у регуляції загибелі лейкозних клітин через сигнальний шлях S100A4/p53. PRAME може індукувати апоптоз лейкозних клітин, інгібувати проліферацію лейкозних клітин та зменшувати пухлинність лейкозних клітин молекулярно, пригнічуючи експресію Hsp27 та S100A4 [155]. Надмірна експресія PRAME суттєво збільшила S100A4/P53-залежний апоптоз клітин і зменшила S100A4/P53-залежну проліферацію клітин [156]. Встановлено, що експресія S100A4 індукується під час макрофагічної або гранулоцитарної диференціації клітин промієлоцитарного лейкозу людини, що збігалося з рухливістю клітин, припускаючи, що S100A4 брав участь у регуляції рухливості лейкозних клітин [157]. У злоякісних пухлинах головного мозку людини S100A4 був позитивно пов’язаний з патогенезом, прогресуванням та гістогенезом гліоми регулюванням клітинної проліферації, міграції та інвазії [158]. На закономірності міграції клітин гліоми впливає внутрішня експресія S100A4 і така, що знаходиться в оточуючих їх астроцитах [159]. Крім того, кілька попередніх досліджень показали, що S100A4 є прямим цільовим геном передачі сигналів ERBB2 через шлях, задіяний у PI3K, AKT1 та ERK1/2 у медуллобластомі [160].
Експресія S100A4 тісно пов'язана з проліферацією, агресивним фенотипом та метастатичною поведінкою у багатьох видах раку людини, і асоціюється з поганою виживаністю хворих на рак, що регулюється багатьма видами молекул, включаючи білки, пов'язані з ЕМТ, ММР, інтегрини, і WNT, NF-κB, пов'язані з білками сигнального шляху. Крім того, роль і механізм S100A4 у різних типах раку регулюються різними сигнальними шляхами та білками. Отже, S100A4 може бути кандидатом на біомаркер для визначення метастазів раку та корисною мішенню для терапії.
Терапевтичне націлювання на S100A4 та клінічне застосування
Підвищена експресія S100A4 призводить до більш злоякісних та агресивних фенотипів пухлинних клітин [41] і, отже, тісно пов'язана з поганим результатом у хворих на рак людини, маючи на увазі, що націлювання на експресію або дії S100A4 може забезпечити нову стратегію боротьби з метастатичним раком, поліпшити прогноз та підвищити виживаність хворих на рак.
Нокдаун експресії S100A4 на основі RNAi при різних типах раку
МіРНК S100A4 змогла суттєво зменшити проліферацію, індукувати апоптоз та інгібувати інвазивний потенціал клітин анапластичного раку щитовидної залози (АТС) in vitro, метастазування в черевну порожнину та ріст пухлини in vivo [172]. Крім того, S100A4 на основі RNAi може безпосередньо зменшити експресію VEGF та MMP-9, а також призвести до зменшення інвазії клітин АТС та ангіогенезу пухлини [173]. Повідомляється, що нокдаун S100A4 на основі рибозиму знижує рівень мРНК та білка S100A4 та успішно знижує метастатичні фенотипи ОС, опосередковані S100A4 [174]. Зниження рівня експресії S100A4 може пригнічувати експресію білків ремоделювання клітинного матриксу, включаючи MMP та TIMP, які відповідають за інвазію CRC у навколишні тканини [175]. Плазміди, що несуть S100A4 shRNA, також суттєво зменшували утворення в печінці метастазів ксенотрансплантатів клітин CRC у мишей [54]. Таким чином, застосування препаратів на основі RNAi для збиття експресії S100A4 в пухлинних клітинах може бути практичним підходом для ефективного та ефективного придушення метастазів раку та продовження виживання без хвороб хворих на рак.
Інгібітори S100A4 для придушення сигналізації Wnt/β-катеніну
S100A4 нейтралізуюче антитіло в регуляції експресії цитокінів
S100A4 бере участь у запальних процесах, залучаючи Т-клітини до первинної пухлини та передметастатичної ніші [178]. Т-клітини можуть зміщувати свій поляризаційний баланс Th1/Th2 у бік пропухрогенного фенотипу Th2 завдяки активності S100A4 [178]. 6B12, нейтралізуючий антитіло S100A4, зміг відновити поляризаційний баланс Th1/Th2 та інгібувати міграцію Т-клітин до ранніх первинних пухлинних уражень та передметастатичних легенів, у свою чергу, пригнічуючи ріст та метастазування пухлинних клітин [178]. Лікування клітин раку товстої кишки людини інтерфероном-гаммою (IFN-γ) знижує рівень мРНК S100A4 у залежності від часу та дози, не пов’язуючи з цитотоксичністю [179]. IFR-γ-зниження регуляції S100A4 спостерігається також у клітинах карциноми ОС, молочної залози та товстої кишки, що було збільшено за рахунок інгібування транскрипції S100A4, але не спричинене опосередкованим IFN-γ зниженням стабільності мРНК S100A4 [180]. Попереднє дослідження розробило та розробило модель конфігурації спіральних спіральних непептидних міозинових пептидів для зв’язування з S100A4 з константою дисоціації в наномолярному діапазоні для спеціального інгібування моторики ракових клітин [181]. Подібним чином для контролю метастазування пухлини можуть бути також розроблені інші кон'югати малих молекул пептид-препарат, що мають високу спорідненість до S100A4 [181].
Інші інгібітори невеликої молекули S100A4
Резюме
ПОДЯКИ І ФІНАНСУВАННЯ
Ця робота була частково підтримана грантами Національного наукового фонду Китаю (# 81472729 та # 81672426), Фонду бюро охорони здоров'я Тяньцзіня (# 2015KY28 та # 15KG112). Ми дякуємо доктору Сяочун Сю за його професійну редагування англійською мовою.
Скорочення
| УВД | анапластичний рак щитовидної залози |
| CaSR | Са 2+ -чутливий рецептор |
| КПР | колоректальний рак |
| CCA | холангіокарцинома |
| CoCl2 | хлорид кобальту |
| CSC | ракові стовбурові клітини |
| CYR | багатий цистеїном ангіогенний індуктор |
| ECM | позаклітинний матрикс |
| EGF | епідермальний фактор росту |
| EGFR | рецептор епідермального фактора росту |
| EMT | епітеліально-мезенхімальний перехід |
| ERK | позаклітинна регульована сигналом кіназа |
| ESCC | плоскоклітинний рак стравоходу |
| EUS-FNA | ендоскопічна аспірація тонкої голки під контролем ультразвуку |
| EZH2 | підсилювач цесте гомолога 2 |
| ФАК | фокальна адгезійна кіназа |
| FSP1 | фібробласт-специфічний білок 1 |
| GPR39 | Рецептор, пов'язаний з G-білком 39 |
| HCC | гепатоцелюлярна карцинома |
| HGFR | рецептор фактора росту гепатоцитів |
| Hh | їжачок |
| HRE | реагує на гіпоксію елемент |
| ІФН | інтерферон |
| IKK | IκB кіназа |
| iTRAQ | ізобарне позначення для відносного та абсолютного кількісного визначення |
| LAR | лейкоцити - загальний антиген |
| LC-MSC | пов'язані з раком печінки мезенхімальні стовбурові клітини |
| MACC | метастази, пов'язані з раком товстої кишки |
| КАРТА | мітоген-активована протеїнкіназа |
| МЕКК | активована мітогеном позаклітинна кіназа, регульована сигналом, кіназа |
| MMP | матрична металопротеїназа |
| MMTV | миші вірус пухлини молочної залози |
| NFAT | ядерний фактор активованих Т-клітин |
| NF-κB | ядерний фактор-каппа B |
| NIK | NF-κB-індукуюча кіназа |
| НМІІА | нем’язовий міозин IIA |
| НМРЛ | недрібноклітинний рак легенів |
| ОПН | остеопонтин |
| PGCC | поліплоїдні гігантські ракові клітини |
| PI3K | фосфатидилінозитол 3-кіназа |
| PP5 | білкова фосфатаза 5 |
| ПРАМА | переважно експресований антиген меланоми |
| PTTG | трансформуючий ген пухлини гіпофіза |
| РІД | рецептор прогресивних кінцевих продуктів глікування |
| РАНТС | регулюються при активації нормальні експресуються та секретуються фактори Т-клітин |
| RLN2 | релаксин-2 |
| SDF | похідний фактор стромальних клітин |
| Тсс | звуковий їжачок |
| Srx | сульфіредоксин |
| TCF | Т-клітинний фактор |
| ТИГАР | індукований регулятором гліколізу та апоптозу пухлинний білок 53 |
| TIMP | інгібітор тканин металопротеїназ |
| TLR4 | Подібний рецептор 4 |
| TNF | фактор некрозу пухлини |
| VEGF | ендотеліальний фактор росту судин |
| Wnt | сімейство сайтів інтеграції MMTV безкрилого типу |
| ZnR | рецептор чутливості до цинку. |
Виноски
КОНФЛІКТ ІНТЕРЕСІВ
Жодного потенційного конфлікту інтересів не розкрито.
- Рослинні екстракти з пригнічуючими апетит властивостями для контролю маси тіла систематичний огляд
- Поживні речовини, що містять повнотекстові гормони в грудному молоці та вплив на ріст немовлят Систематичний огляд
- Протеомічний аналіз зразків тканин при дослідженні трансляційного раку молочної залози Експертний огляд
- Технологічні заходи для зниження ваги у первинній медичній допомозі Систематичний огляд SpringerLink
- Поширеність спроб особистого контролю ваги у дорослих систематичний огляд та мета-аналіз -