Кардіологія та сучасні дослідження
Звіт про справу Том 8 Випуск 2
Берріос-Барсенас Е, 1 Іслава Гальвес, 2 Лайнес-Зелая J 2
Перевірте Captcha
Шкодуємо про незручності: ми вживаємо заходів для запобігання шахрайським поданням форм екстракторами та сканерами сторінок. Введіть правильне слово Captcha, щоб побачити ідентифікатор електронної пошти.
1 Кардіологія, лікарня Espa
2 Кардіологія, Мексиканський інститут трансплантації, Мексика
Листування: Лайнес Зелая Дж., Кардіолог, Мексиканський інститут трансплантації, Морелос, Мексика, тел. 52 044 55 6421 0039
Отримано: 26 січня 2017 р. | Опубліковано: 1 лютого 2017 р
Цитування: Berrios-Barcenas E, Islava-Gálvez and Laínez-Zelaya J (2017) Стратифікація ризику при частих шлуночкових екстрасистолах: важливість серцевого магнітного резонансу. J Cardiol Curr Res 8 (2): 00273. DOI: 10.15406/jccr.2017.08.00273
Шлуночкова тахікардія (VT) має прямий зв’язок із раптовою серцевою смертю (SCD), і стратифікація ризику є важливою для подальшого лікування. У контексті структурного нормального серця головним підозрою є ідіопатичний ВТ. Серцевий магнітний резонанс (CMR) - це потужний інструмент для оцінки анатомічного субстрату шлуночкових аритмій. Міокардит є частою причиною аритмії, і це правильний діагноз за допомогою CMR. Наявність пізнього посилення гадолінію пов'язана з діагностикою та прогностикою міокардиту.
Ключові слова: Шлуночкова екстрасистолія; Шлуночкова тахікардія; Міокардит
BPM: ударів за хвилину; CMR: серцевий магнітний резонанс; LBBB: лівий блок розгалуження; LGE: пізній посилення гадолінію; ЛШ: лівий шлуночок; LVOT: вихідний тракт лівого шлуночка; RVOT: тракт відтоку правого шлуночка; ВТ: шлуночкова тахікардія; SCD: Раптова серцева смерть
Шлуночкова тахікардія має прямий зв’язок із СЦД, тому стратифікація ризику є важливою для подальшого лікування, яке коливається від майбутнього лікування або фармакологічного лікування, до процедур абляції катетером або імплантації автоматичного дефібриляторного пристрою. Початковим кроком є знання співіснування структурних захворювань серця з використанням методів візуалізації. Міокардит асоціюється з наявністю шлуночкових аритмій зі змінним прогнозом. Відповідний діагноз та стратифікація ризику за допомогою магнітно-резонансної томографії можуть перевернути лікування. Завдання цього огляду - повідомити про випадок шлуночкової аритмії, коли результат КМР змінив діагноз та подальше лікування.
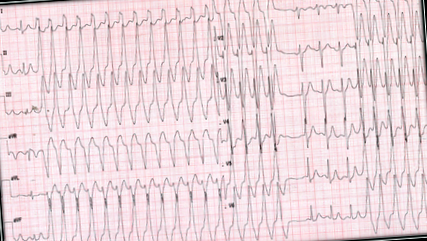
21-річний чоловік був обстежений кардіологом у відділенні невідкладної допомоги з тригодинним історією серцебиття, запаморочення та діафорезу. Фізичне обстеження було нічим не примітним, за винятком частоти серцевих скорочень 150 уд./Хв. Лабораторних відхилень не спостерігалося. Електрокардіограма (ЕКГ) показала широку комплексну QRS-тахіаритмію (рис. 1) з критеріями мономорфної шлуночкової тахікардії (ВТ). Після введення аміодарони друга ЕКГ показала синусовий ритм та мономорфний шлуночковий тригемінізм (картина LBBB з нижньою віссю) (рис. 2). Трансторакальна ехокардіограма була нічим не примітна. Під час подальшого спостереження ЕКГ та 24-годинний амбулаторний холтер показали те ж саме у мономорфних шлуночкових екстрасистол у 30% ударів. У цьому контексті підозрювали діагноз ідіопатичної шлуночкової тахікардії. Через три тижні було подано запит на серцево-магнітний резонанс і повідомлено про рубцевий міокардит між базальною міжшлуночковою перегородкою між вивідними шляхами та систолічну дисфункцію (LVEF = 48%) (рис. 3). У цьому контексті, який наступний крок?
Фігура 1: Комплекс тахіаритмії Widex QRS. Спостерігалась дисоціація АВ із відношенням АВ ˂ 1 та настанням QRS до піку в свинцевому DII> 50 мсег, що підтверджує діагноз ВТ.
Малюнок 2: ЕКГ у синусовому ритмі та часті екстрасистоли з морфологією LBBB, ступінню або хвилею R у V1 та QS у деривації aVR ≥ aVL. Ці висновки придатні для задньолатеральної частини правого вивідного тракту як генезис екстрасистолії та VT.
Малюнок 3: CMR. В A ми спостерігаємо лінійний внутрішньоміокардіальний LGE в bsal-частині міжшлуночкової перегородки, у співвідношенні із вихідним трактом правого шлуночка (B, C). Ця знахідка підтверджує можливий початок екстрасистолії та ВТ щодо рубця.
Шлуночкова тахікардія - це ритм, пов'язаний з раптовою серцевою смертю (ССД) [1], тому адекватний діагноз є основним для прогнозу. ЕКГ є початковим інструментом у диференціальній діагностиці широкої тахікардії комплексу QRS. Найбільш часто використовуваний алгоритм - це так званий алгоритм Бругада або критерії Бругада, в яких ізольована наявність атріовентрикулярної дисоціації має специфічність 100% для підтримки діагностики ВТ [2] (рис. 1).
Передчасні шлуночкові комплекси (ПВХ) - це позаматкові удари, що походять із системи Пуркіньє або міокарда шлуночків. ПВХ можна класифікувати за місцем походження (правий або лівий шлуночок), частотою (ізольована, бігемінна, трійчаста та повторювана) форма (мономорфна, поліморфна) та взаємозв’язком із серцевим циклом (взаємозв’язок з діастолою) [3]. У випадках, коли ПВХ або VT мають морфологію LBBB з нижньою віссю, слід підозрювати ідіопатичну VT (чутливий до аденозину вихідний тракт) 4, особливо у молодих пацієнтів без структурних захворювань серця (рис. 2). У цих випадках важливо визначити можливе розташування ектопічного вогнища, більшість із них між або всередині тракту відтоку правого та лівого шлуночків, використовуючи дані ЕКГ (табл. 1 та 2) [5-8]. У нашому випадку задньолатеральна верхня область у RVOT є найбільш можливим джерелом. Еволюція, лікування та прогноз цієї аритмії можуть бути доброякісними [9]. З іншого боку, ця морфологія є другорядним критерієм аритмогенної дисплазії правого шлуночка, стаючи основним диференціальним діагнозом ідіопатичної ВТ.
Морфологія QRS
R Взаємозв'язок у V1 Lead
Прекордіальний перехід QRS в РС
Прекордіальний перехід QRS у VT (da = 100%)
V2 Перехід Ratio * (так = 91%)
Співвідношення R3/V3 (da = 83%)
раніше РС
Лівий (антеромедіальне кріплення) проти правого (задньолатеральний додаток)
Амплітуда хвилі aVR та aVL QS (da = 80%)
Полярність відведення I (da = 83%)
Верхнє та нижче відношення до легеневого клапана
Початкові V1 та V2 початкові r Амплітуда хвилі (da = 66%)
Покращений (проксимальний нижче легеневого клапана)
Нижній (дистальний нижче легеневого клапана)
Таблиця 2: Оцінка точної локалізації витоків тахікардії відтоку правого шлуночка на ЕКГ 12 відведень.
У більшості випадків злоякісних аритмій, вторинних до міокардиту, подальше лікування не потрібно. Загалом, коли запалення вимикається, аритмогенний субстрат також зникає, і більшість з них мають хороший прогноз. У випадках, коли шрам зберігається, ми можемо припустити торпідну еволюцію з ремоделюванням шлуночків, прогресуванням серцевої недостатності та високим ризиком розвитку ССД. Однак у контексті первинної профілактики існує обмежена кількість доказів, що підтверджують імплантацію ІКД пацієнтам з важкими наслідками міокардиту, тому це часто залежить від клінічного контексту пацієнта та їх власного розвитку.
У пацієнтів із стійкою мономорфною шлуночковою тахікардією та частою екстрасистолією важливо оцінити можливий анатомічний субстрат за допомогою методів візуалізації, таких як CMR. Адекватний етіологічний діагноз пов'язаний з прогнозом та лікуванням.
- Bayés de Luna A, Coumel P, Leclercq JF (1989) Амбулаторна раптова серцева смерть: механізми виробництва смертельних аритмій на основі даних 157 випадків. Am Heart J 117 (1): 151-159.
- Brugada P, Brugada J, Mont L, Smeets J, Andries EW (1991) Новий підхід до диференціальної діагностики регулярної тахікардії з широким комплексом QRS. Тираж 83 (5): 1649-1659.
- Iturralde P (2016) Arritmias cardíacas. (4-е видання), PyDESA, Мехіко, Мексика с. 87-89.
- Iwai S, Cantillon DJ, Kim RJ, Steven MM, Suneet Mittal та ін. (2006) Тахікардія вивідного тракту правого та лівого шлуночків: докази загального механізму електрофізіології. J Cardiovasc Electrophysiol 17 (10): 1052-1058.
- Tanner H, Hindricks G, Schirdewahn P, Kobza R, Dorszewski A, et al. (2008) Рахікардія тракту Ourflow із переходом R/S у відведенні V3, шість різних анатомічних підходів для успішної абляції. J Am Coll Cardiol 45 (3): 418-423.
- Бетенскі Б.П., Парк Р.Е., Марчілінський Ф.Є., Хатчінсон М.Д., Гарсія ФК та ін. (2011) Коефіцієнт переходу V2: новий електрокардіографічний критерій для розрізнення походження тахікардії лівого та шлуночкового відділів. J Am Coll Cardiol 57 (22): 2255-2262.
- Kottkamp H, Chen X, Hindricks G (1995) Ідіопатична тахікардія лівого шлуночка: нові уявлення про електрофізіологічні характеристики та радіочастотну абляцію катетера. Стимуляція Clin Electrophysiol 18 (6): 1285-1297.
- Камакура С, Шімідзу З, Мацуо К, Тагучі А, Суяма К та ін. (1998) Локалізація оптимального місця абляції ідіопатичної шлуночкової тахікардії з вивідного тракту правого та лівого шлуночків за допомогою ЕКГ на поверхні тіла. Тираж 98 (15): 1525-1533.
- Кім Р. Дж., Івай С, Марковіц С. М., Шах Б. К., Штейн К. М. та ін. (2007) Клінічний та електрофізіологічний спектр аритмії ідіопатичного шлуночкового відтоку. J Cardiovasc Electrophysiol 49 (20): 2035-2043.
- Марковіц С.М., Лерман Б.Б. (2009) Механізми фокальних тахікардій тракту відтоку шлуночків: докази загальних електрофізіологічних механізмів. J Cardiovasc Electrophysiol 17: 1052-1058.
- Лерман Б.Б. (2009). У Zipes DP (Eds.), Електрофізіологія серця: від клітини до ліжка. Шлуночкова тахікардія у пацієнтів із структурно нормальним серцем. (5-е видання), США, с. 657-668.
- Natale A, Raviele A, Al-Ahmad A, Alfieri O, Aliot E, et al. (2010) Документ Міжнародного консенсусу Венеціанської діаграми щодо шлуночкової тахікардії/абляції фібриляції шлуночків. J Cardiovasc Electrophysiol 21 (3): 339-379.
- Бакстон А. Е., Ваксман Х. Л., Марчлінскі Ф. Е. (1983) Правошлуночкова тахікардія: клінічні та електрофізіологічні характеристики. Тираж 68 (1): 917-927.
- Joshi S, Wilber DJ (2005) Абляція ідіофатичної тахікардії вивідного тракту правого шлуночка: сучасні перспективи. J Cardiovas Electrophysiol 16 (Suppl 1): S52-58.
- White JA, Fine NM, Gula L, Yee R, Skanes A, et al. (2012) Корисність серцево-судинного магнітного резонансу при ідентифікації субстрату для злоякісних шлуночкових аритмій. Circ Cardiovasc Imaging 5 (1): 12-20.
- Friedrich MG, Sechtem U, Schulz-Menger J, Holmvang G, Alakija P, et al. (2009) Серцево-судинний магнітний резонанс при міокардиті: Біла книга JACC. J Am Coll Cardiol 53 (17): 1475-1487.
- Grün S, Schumm J, Greulich S, Wagner A, Schneider S, et al. (2012) Довготривале спостереження за підтвердженим біопсією вірусним міокардитом: предиктори смертності та неповного одужання. J Am Coll Cardiol 59 (18): 1604-1615.
- Baksi AJ, Kanaganayagam GS, Prasad SK (2015) Аритмії при вірусному міокардиті та перикардиті. Картка Electrophysiol Clin 7 (2): 269-281.
- Ожиріння, вага та ризик раку Всесвітній фонд дослідження раку Великобританія
- Ожиріння як фактор ризику колоректальних поліпів у японських пацієнтів
- Ожиріння надмірна вага та ризик алергічного риніту Мета-аналіз спостережних досліджень - Чжоу -
- Сенсорні властивості теплого перцю чилі - і його значення для якості їжі та культури
- Поживні речовини проти калорій Важливість поживних речовин у щоденному споживанні їжі