Розмір підшлункової залози при недоїданні енергії білками: провісник відновлення харчування
Анотація
Передумови:
Екзокринна дисфункція підшлункової залози часто фіксується при недоїданні енергії білка (ПЕМ), оскільки підшлункова залоза вимагає оптимального харчування для синтезу ферментів. Ця недостатність ферментів підшлункової залози може зіграти певну роль у продовженні ПЕМ.
Завдання:
Це дослідження було розроблене для оцінки розміру головки підшлункової залози та екзокринних функцій підшлункової залози, а саме амілази та ліпази сироватки крові в ПЕМ та її підтипах, а також співвідношення будь-якого наявного дефекту з різними клінічними та лабораторними даними пацієнтів із ПЕМ з особливим акцентом на впливі харчових речовин реабілітація.
Пацієнти та методи:
Загалом 33 випадки ПЕМ; 15 маразмів, 10 квашиоркорів (KWO) та вісім маразмічних квашиоркорів (MKWO) були набрані з дитячої лікарні університету Айн Шамса, а також 12 відповідних засобів контролю. Середній вік пацієнтів становив 11,87 ± 7,8 місяців, а контрольних - 14,83 ± 7,7 місяців. Детальний збір анамнезу та ретельне клінічне обстеження з особливим акцентом на антропометричних вимірах проводились для кожного досліджуваного немовляти, а також лабораторні дослідження, які включали; повний аналіз крові, функції печінки та нирок та амілаза та ліпаза сироватки крові. Ультразвукове дослідження розміру голови підшлункової залози проводили для випадків та контролів. Програма харчової реабілітації проводилася протягом 3–6 місяців з подальшою переоцінкою випадків.
Результати:
Значення розміру підшлункової залози були значно нижчими для всіх підтипів РЕМ (1,52 ± 0,6, 2,73 ± 0,12 та 3,00 ± 0,54 см 3 при маразмах, KWO та MKWO відповідно) порівняно з контролем (5,13 ± 2,33 см 3). Амілаза та ліпаза в сироватці крові також були значно нижчими у всіх підгрупах ПЕМ порівняно з контролем із значним поліпшенням після харчової реабілітації у поєднанні зі значним збільшенням розміру головки підшлункової залози. Суттєвих відмінностей не було зафіксовано, коли ми порівнювали підгрупи разом, за винятком значно вищої швидкості зміни рівня амілази в сироватці крові у набряклих пацієнтів порівняно з недедематозними. Тривалість періоду харчової реабілітації, вік пацієнта, вага та сироватковий альбумін були найбільш визначальними факторами для розміру голови підшлункової залози, як видно з дослідження багаторазового регресійного аналізу.
Висновок:
Потенційно коригуюча екзокринна недостатність підшлункової залози у випадках ПЕМ повинна бути ретельно продумана під час планування програми харчової реабілітації для таких пацієнтів, оскільки вона може бути відповідальною за серйозні постійні проблеми захворюваності, з якими вони стикаються. Таким чином, ми рекомендуємо включати оцінку розміру голови підшлункової залози та екзокринну функцію до оцінки пацієнтів із ПЕМ, і їх також можна використовувати як прогностичний параметр.
Спонсорство:
Зараховані пацієнти належали до числа тих, хто приймався та вільно керував медичним факультетом дитячої лікарні в Університеті Айн Шамса, включаючи використання ультразвукового апарату, тоді як набори придбані авторами, які брали участь у фінансуванні дослідження.
Вступ
Екзокринна дисфункція підшлункової залози часто реєструється при недостатньому харчуванні білками (ПЕМ) у слаборозвинених країнах. Крім того, підшлунковій залозі потрібне оптимальне харчування для синтезу ферментів, і потенційно коригується недостатність ферментів підшлункової залози може зіграти певну роль у продовженні ПЕМ (Cleghorn et al, 1991).
Гіпотрофія все ще залишається проблемою, особливо в країнах, що розвиваються, де загальна кількість дітей з недостатньою вагою та низьким рівнем росту не змінилася кардинально з 1980 року (Heird, 2004), а проблеми, що збільшують рівень захворюваності на РЕМ, додають економічного тягаря, з яким стикаються ці країни, що розвиваються.
Проблема екзокринної підшлункової залози не була ретельно досліджена у пацієнтів з ПЕМ в Єгипті. Таким чином, ця робота була розроблена для оцінки розміру та функції підшлункової залози у різних підтипах ПЕМ та кореляції будь-якого наявного дефекту з різними клінічними та лабораторними даними пацієнтів із ПЕМ. Буде вивчено також вплив харчової реабілітації на такі зміни.
Пацієнти та методи
У цьому дослідженні було включено 33 пацієнти, які страждають на ПЕМ, набрані з дитячої лікарні університету Айн Шамс, Каїр, Єгипет, у період з січня по серпень 2003 р. Вони також були класифіковані за трьома групами згідно з Wellcome (1970): 15 маразмів, 10 квашиоркорів (KWO). ) та вісім випадків маразмічного квашиоркору (MKWO). Пацієнтами були 15 чоловіків та 18 жінок середнього віку 11,87 ± 7,8 місяців. Загалом до контрольної групи було залучено 12 здорових немовлят за віком та статтю (п'ять чоловіків та сім жінок із середнім віком 14,83 ± 7,7 місяців).
Після отримання схвалення етичного комітету Дитячої лікарні Університету Айн Шамса батьки або законні опікуни підписали письмову згоду. Досліджені немовлята брали участь у трифазному дослідженні з доінтервенційною оцінкою як фаза I, інтервенційною програмою харчової реабілітації як фаза II та постінтервенційною оцінкою через 3–6 місяців від початку (фаза III).
Харчова реабілітація проводилась згідно з ВООЗ (1999). Спочатку лікування загрожуючих життю та надзвичайних ситуацій проводилося протягом першого тижня, потім почали годувати. Калорійність споживання становила 80–100 ккал/кг/день при безперервному годуванні груддю у випадках немовлят, які годували грудьми. Наведена дієта мала низький вміст білка, жиру та натрію, високу кількість вуглеводів, оскільки майже у всіх дітей, які страждають від недостатнього харчування, є інфекції, порушення функції печінки та кишечника та проблеми, пов’язані з порушенням електролітного балансу.
Етап реабілітації послідував із поверненням апетиту у немовляти. Споживання калорій зросло до 150–200 ккал/кг/день із збільшенням кількості та зменшенням частоти. Була дієта з високим вмістом білка, а вітаміни та мінерали (калій, магній та цинк) продовжувались у збільшених кількостях. На цьому етапі залізо давали для лікування наявної анемії. Немовля залишалося в лікарні протягом першої частини цього етапу реабілітації (принаймні через 3 тижні після прийому), а потім спостерігалося в амбулаторії з харчової реабілітації.
Оцінка на фазах I та III включала детальний аналіз дієти, історію будь-яких шлунково-кишкових проблем, особливо блювоту, діарею або напади розтягування живота та клінічне обстеження з особливим акцентом на антропометричних вимірах та ознаках недоїдання. Лабораторна обробка включала загальний аналіз крові (Coulter T660, Маямі, Флорида, США), функції печінки та нирок (автоаналізатор, дельта Бекмана Synchron CX-5), а також оцінку амілази сироватки хромогенним методом згідно з Klein et al ( 1970) (з використанням набору, наданого Quimica Clinica Aplicada, SA, Іспанія). Ліпазу сироватки крові також оцінювали турбідиметричним методом згідно з Lott et al (1986) (з використанням набору, наданого лабораторіями Randox, Великобританія).
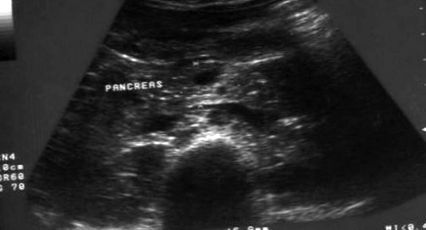
Розмір підшлункової залози демонструє тісний зв’язок з ІМТ, а діаметр головки підшлункової залози дає найкращі докази - це вимірювання з найвищою надійністю (Cuntz et al, 2000). На основі цих знань була проведена ультрасонографічна оцінка розміру голови підшлункової залози для досліджуваних випадків та контролів за допомогою апарату Hetachi EU 565A із зондом 3,5 МГц. Вимірювання головки підшлункової залози проводили таким чином: (1) діаметр головки, вертикальної до поздовжньої осі в максимальному діаметрі; (2) довжина головки, паралельної поздовжній осі в максимальному розширенні, і (3) головка підшлункової залози при впадінні селезінкової і верхньої брижових вен вертикально до поздовжньої осі при максимальному діаметрі в середині впадіння (Cuntz et al, 2000). Вимірювання повторювали три рази, щоб переконатися в його надійності. Помноживши три вимірювання разом і розділивши на два, ми отримали об'єм голови підшлункової залози (Рисунки 1 і 2).
Ультразвукова фотографія розміру голови підшлункової залози у пацієнта, що страждає на маразмію.
Ультразвукова фотографія для розміру голови підшлункової залози в одному з контролів.
Статистичний аналіз результатів проводили за допомогою стандартних комп'ютерних програм SPSS (версія 10) та програмного пакету Statistica версії 5 (Statsoft, Tulsa, OK, США). Непараметричні дані були виявлені за допомогою тесту Шапіро – Вілька. Студентська т- і в парі т-тести використовувались для параметричних кількісних даних та Манна – Уітні U та Уілкоксоном відповідні тести пар для непараметричних кількісних даних на додаток до кореляційних досліджень. Чисельні дані були представлені в середньому ± s.d. і медіана (міжквартильний діапазон). Відмінності вважалися суттєвими, якщо ймовірність (P) значення були менше 0,05.
Результати
Що стосується антропометричних вимірювань, центильний розподіл ваги та довжини або зросту за віком, а також окружність середньої частини руки був нижчим, ніж у контрольних груп (P Таблиця 1 Порівняння середнього значення ± sd. (медіана (інтерквартильний діапазон)) значень антропометричних вимірювань у підгрупах недостатності харчування білка та контролю до та після харчової реабілітації
Таблиця 3 демонструє, що розмір голови підшлункової залози був значно нижчим у всіх підгрупах ПЕМ (найнижчі значення у пацієнтів з маразмом) порівняно з контролем. Ультрасонографічні знімки пацієнта з маразмом та одного з контролів продемонстровані на малюнках 1 та 2 відповідно. Після реабілітації харчування спостерігалося значне збільшення розміру голови підшлункової залози у всіх підгрупах, як показано на малюнку 3.
Лінійний графік, що порівнює розмір голови підшлункової залози у трьох досліджуваних підгрупах до та після харчової реабілітації.
Щодо рівнів амілази в сироватці крові, у таблиці 3 наведені значно нижчі значення у всіх підгрупах (найнижчі у набрякових підгрупах) порівняно з контролем. Також продемонстровано значне покращення у всіх підгрупах після харчової реабілітації. Однак ці показники перевищують показники контролю, особливо у пацієнтів з MKWO.
Аналогічним чином, показники ліпази в сироватці крові були значно нижчими, ніж у контролі у всіх досліджуваних підгрупах (найнижчі у набряках) із значним поліпшенням після харчової реабілітації. Ліпаза в сироватці крові також показала надмірність після харчової реабілітації, проте ця знахідка не мала статистичного значення.
Швидкість зміни амілази сироватки крові, ліпази сироватки та розміру голови підшлункової залози не виявила відмінностей між досліджуваними підгрупами, за винятком значно вищої швидкості зміни сироваткової амілази у набрякових типах (як випадки KWO, так і MKWO) порівняно з недедематозним типом (маразм ) з P значення
Обговорення
Це дослідження показало значне зменшення розміру та функції головки підшлункової залози, а саме амілази та ліпази сироватки у всіх підгрупах ПЕМ порівняно з контролем. Це узгоджується з попередніми дослідженнями, які повідомляли, що харчування з дефіцитом білка супроводжувалося прогресуючою атрофією підшлункової залози з подальшою екзокринною недостатністю (Barbezat & Hansen, 1968; Sauniere & Sarles, 1988). Сильне недоїдання призводить до зменшення гранул зимогену (Davis, 1948; Stransky & Dauis-Lawas, 1950) та базальної та стимульованої секреції ферментів (Thompson & Trowell, 1952; Barbezat & Hansen, 1968). Зовсім недавно Брукс і Голден (1992) повідомляли про атрофію підшлункової залози в патологоанатомічних (ПМ) гістологічних зрізах випадків ПЕМ.
Результати цього дослідження також демонструють значне збільшення розмірів голови підшлункової залози, а також амілази та ліпази сироватки після харчової реабілітації. Це узгоджується з Томпсоном і Троуеллом (1952), а також Барбезатом і Хансеном (1968), які повідомили, що зниження екзокринної функції підшлункової залози виявилося оборотним після корекції дієтичних дефіцитів. Що стосується нормалізації розміру голови підшлункової залози при повторному годуванні, це підтверджується висновками Мохамед-Бендака та співавт. (1993), які вивчали сильне виснаження білка у щурів, та Кунц та ін. (2000), які працювали з дорослими пацієнтами з порушеннями харчування.
Найнижчими значеннями ферментів у нашому дослідженні були випадки набряків (KWO та MKWO). Попередній висновок є більш очевидним для рівня амілази в сироватці крові. Це можна пояснити ступенем патології, що спостерігається при різних типах РЕМ, як повідомляється в роботі Brooks and Golden (1992). Вони помітили, що фіброз підшлункової залози спостерігався лише в одному гістологічному відділі ПМ у 16 випадках маразму порівняно з вісьмома з 25 досліджених випадків KWO та семи з 24 випадків MKWO. Це також узгоджується з Барбезатом та Хансеном (1968), які повідомили, що середня секреція амілази була нижчою у KWO, ніж у пацієнтів з маразмом, і пояснили цей висновок тим, що відносно надмірне споживання вуглеводів у таких пацієнтів може бути причиною гормональних та нейрогенних стимуляція підшлункової залози, як бичування втомленого коня.
Очікується значно вищий показник зміни сироваткової амілази у набрякових у порівнянні з недедематозними пацієнтами, оскільки ці пацієнти мають найнижчі значення ферментів. Це також підкріплюється роботами Barbezat та Hansen (1968), які повідомили про різке збільшення рівня амілази в сироватці крові після лікування випадків KWO.
Очікується значно вищий показник зміни розміру голови підшлункової залози при маразмі порівняно з випадками KWO, оскільки у цих пацієнтів показники розміру голови підшлункової залози найнижчі.
Перевищення рівня амілази в сироватці крові пацієнтів з РЕМ до рівня, що перевищує рівень контролю після харчової реабілітації, підсилюється результатами Проста та Бельвіля (1987). Вони спостерігали, що при повторному вигодовуванні голодних щурів синтез амілази збільшувався із ефектом відскоку порівняно з контролем. Ми припускаємо, що це могло бути пов'язано зі збільшенням сили реплікації та транскрипції клітин PEM щодо поповнення відсутнього елемента раціону, яким є білок, а також інших мікро- та макроелементів, необхідних для оптимального виживання клітин.
Дане дослідження продемонструвало, що сироватковий альбумін до харчової реабілітації був одним із найбільш визначальних факторів швидкості зміни розміру головки підшлункової залози і, отже, функціонує за допомогою множинного регресійного аналізу. Це узгоджується з Барбезатом та Хансеном (1968), які повідомили про значну позитивну кореляцію між виходом ферментів підшлункової залози та концентрацією сироваткового альбуміну.
Регресійний аналіз також показав, що час реабілітації є вирішальним фактором у визначенні розміру голови підшлункової залози у пацієнтів із ПЕМ. Цей пункт має великий практичний вплив, оскільки доводить прогностичну цінність цього виміру та його важливість у прогнозуванні відновлення харчування.
На закінчення слід сказати, що потенційно коригувана екзокринна недостатність підшлункової залози у випадках ПЕМ повинна бути ретельно продумана при плануванні програми харчової реабілітації для таких пацієнтів, оскільки вона може нести відповідальність за серйозні проблеми тривалості, з якими вони стикаються. Таким чином, ми рекомендуємо включати оцінку розміру голови підшлункової залози та екзокринну функцію до первинної оцінки та спостереження за пацієнтами з ПЕМ, і таким чином їх можна використовувати як прогностичний параметр.
Список літератури
Barbezat GO & Hansen JDL (1968): Екзокринна підшлункова залоза та білково-калорійне недоїдання. Педіатрія 42, 77–92.
Brooks SE & Golden MH (1992): Екзокринна підшлункова залоза при квашиоркорі та маразмі. Світлова та електронна мікроскопія. Західноіндійський мед. J. 41, 56–60.
Cleghorn GJ, Erlich J, Bowling FG, Forrest Y, Greer R, Holt TL & Shepherd RW (1991): Екзокринна дисфункція підшлункової залози у недоїдаючих австралійських аборигенних дітей. Мед. Дж. Ост. 154, 45–48.
Cuntz U, Frank G, Lehnert P & Fichter M (2000): Взаємозв'язок між розмірами підшлункової залози та вагою пацієнтів з порушеннями харчування. Міжнародний J. Їжте. Розлад. 27, 297–303.
Davis JNP (1948): Основна патологія квашиоркору. Ланцет 1, 317–320.
Heird WC (2004): Продовольча безпека, голод та недоїдання. В: Нельсон, Підручник з педіатрії, ред. Р. Е. Берман, Р. М. Клігман і Х. Б. Дженсон, 17-е видання, глава 42, с. 167–173. Філадельфія, Пенсільванія: W.B. Компанія Сондерс.
Klein B, Foreman JA & Searcy RL (1970): Новий хромогенний субстрат для визначення активності амілази в сироватці крові. Клін. Хім. 16, 32–38.
Lott JA, Patel ST, Sawhney AK, Kazmierczak SC & Love Jr JE (1986): Аналізи сироваткової ліпази: аналітичні та клінічні міркування. Клін. Хім. 32, 1290–1302.
Mohamed-Bendaka K, Bellevillle J & Prost J (1993): Порівняльні зміни між вмістом травного ферменту підшлункової залози та соку підшлункової залози під час харчової реабілітації після важкого недоїдання білка у щурів. Br. Дж. Нутр. 69, 83–96.
Ніколсон Дж. Ф. і Пеше, М. А. (2004): Довідкові діапазони для лабораторних випробувань та процедур. В: Нельсон, Підручник з педіатрії, ред. Р. Е. Бермана, Р. М. Клігмана та Х. Б. Йенсона, 17-е видання, глава 710, с. 2396–2427. Філадельфія, Пенсільванія: W.B. Компанія Сондерс.
Prost J & Belleville J (1987): Вплив гіпотрофії білка з подальшим збалансованим підживленням на рівень синтезу гідролаз підшлункової залози у вирощуваних щурів. CR Seases Soc. Біол. Fil. 181, 407–414.
Sauniere JF & Sarles H (1988): Екзокринна функція підшлункової залози та білково-калорійне недоїдання в Дакарі та Абіджані (Західна Африка): недостатність підшлункової залози. Am. J. Clin. Nutr. 48, 1233–1238.
Stransky E & Dauis-Lawas DF (1950): Про квашиоркор (дитяча пелагра, злоякісне недоїдання). Енн Педіатр. 174, 226–246.
Thompson MD & Trowell HC (1952): Активність ферментів підшлункової залози в вмісті дванадцятипалої кишки у дітей із типом квашиоркору. Ланцет 1, 1031–1035.
Wellcome T (1970): Робоче дослідження довіри Wellcome: комітет з питань харчування. Ланцет 2, 302.
ВООЗ (1999): Управління важким недоїданням: Посібник для лікарів та інших старших медичних працівників. Женева: Всесвітня організація охорони здоров’я.
- Харчові практики, спосіб життя та контроль ваги професійних жокеїв Journal of Sports
- Про тести окремих сімейств гіпотез з малим обсягом вибірки Journal of Statistics
- Харчові проблеми та рішення для сучасної епідемії здоров'я - FullText - Журнал
- Харчовий склад та енергетичний вміст донорського людського молока Систематичний огляд досягнень у
- Поінформованість про харчування серед вагітних жінок в Латвії Колосова Міжнародний журнал