Роль дієтичного білка та м’язової форми у довголітті та старінні
Барбара Штрассер
1 Відділ медичної біохімії, Біоцентр, Медичний університет Інсбрук, Австрія
Костянтинос Волакліс
2 Департамент профілактики та спортивної медицини, ТУМ, Мюнхен, Німеччина
Дітмар Фукс
3 Відділ біологічної хімії, Біоцентр, Медичний університет Інсбрук, Австрія
Мартін Бурчер
4 Департамент спортивних наук, медична секція, Університет Інсбрука, Австрія
Анотація
Загальновідомо, що люди будь-якого віку отримують користь від регулярних фізичних навантажень, що знижує ризик ішемічної хвороби серця, гіпертонії, деяких видів раку, діабету 2 типу та багатьох інших хронічних захворювань. Справді, низький рівень кардіореспіраторної підготовленості сьогодні прийнятий як потужний предиктор смертності як у здорових, так і у хворих осіб [1-3]. М’язова сила є важливою складовою фізичної підготовки, яка має незалежну роль у профілактиці багатьох хронічних захворювань. Кілька епідеміологічних досліджень показали, що м'язова слабкість у людей середнього та старшого віку сильно пов'язана з функціональними обмеженнями та фізичною вадою [4-6]. Крім того, епідеміологічні або короткотермінові дослідження вказують на потенційний сприятливий ефект збільшення споживання білка у літніх людей. Отже, основною метою даної роботи є надати огляд ролі фізичних вправ у здоров’ї м’язів у літньому віці та окреслити клінічні докази споживання білка з їжею для підтримки здорового старіння.
М’язова сила та довголіття
Біологія старіння м’язів
Скелетні м'язи людини неминуче зазнають значних змін зі старінням, що характеризується зниженням м'язової маси та сили приблизно на 1% на рік у віці приблизно 40 років [39]. Зрештою, втрата м’язів суттєво сприятиме слабкості, нерухомості та втраті незалежності. Однак ступінь втрати м’язів сильно відрізняється між людьми через різницю як у процесі старіння, так і в рівні фізичної активності. Зміни в архітектурі м’язів і типі волокна, в механічних властивостях сухожиль і судинному контролі м’яза, що скорочується, є найбільш відомими характеристиками, пов’язаними із зменшенням маси та функціонуванням старіючих скелетних м’язів [40-42].
Вікові зміни в м’язовій архітектурі
Виразні зміни в архітектурі м'язів відбуваються під час старіння внаслідок неактивності (зникнення атрофії) та внаслідок процесу старіння (стареча саркопенія) [42]. У той час як атрофія, що не використовується, характеризується лише зменшенням розміру волокна, саркопенія демонструє як зменшений розмір волокна, так і зменшену кількість волокон. Крім того, довжина пучки та кут виведення пенії зменшуються із старінням [43]. Спостереження, що фізіологічна площа поперечного перерізу (м’язовий об’єм, поділений на довжину пучків), зменшується при відсутності використання та старіння, також вказує на більш виражену втрату саркомерів паралельно, ніж саркомерів послідовно (довжина пучка) [42].
Вікові зміни у складі типу волокна
Зменшення м’язового об’єму у людей похилого віку є наслідком зменшення рухових одиниць та м’язових волокон. Тоді як розмір м’язових волокон типу 1 майже підтримується, розмір волокна типу 2 зменшується [44]. Проте втрата клітковини залишається основною причиною зниження м’язової маси та сили зі старінням. Волокна типу 2, схоже, особливо схильні до посилення денервації із збільшенням віку [45]. Однак втрата клітковини принаймні частково запобігається тому, що рухові нейрони типу 1 утворюють зв’язки з денервованими волокнами типу 2. Як наслідок, рухові нейрони 1 типу збільшуються за рахунок волокон 2 типу [45]. Розвантаження (припинення використання) м’язів провокує повільний і швидкий перехід, що вказується підвищенням ізоформ важкої ланцюга міозину (MHC), а також ізоформ швидкого міозину легкого ланцюга (MLC) [46]. На відміну від невикористання, старіння саме по собі призводить до швидкого до повільного переходу, частково пояснюється денервацією волокон типу 2 та глікацією MHC [47].
Запропоновані механізми
Фізіологічна реакція на фізичне навантаження
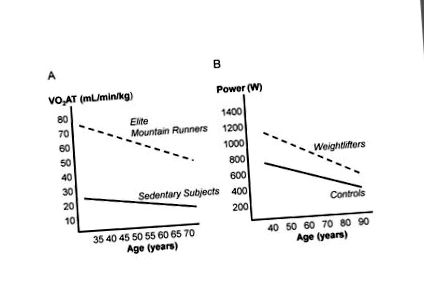
Вікове зниження анаеробного порогу (VO2AT) у гірських бігунів та сидячих суб’єктів (А) та пікової потужності у важкоатлетів та сидячих контрольних суб’єктів (В); (змінено із посилань 58, 59).
Тип вправ на опір
Вид вправ на витривалість
Дієтичний білок, м’язи та здорове старіння
Анаболічна стійкість MPS при старінні - важливість фізичних вправ
Клінічні переваги білкових добавок
Атрофія м’язів є невдалим наслідком старіння та багатьох захворювань і може порушити фізичну функцію та погіршити життєво важливі обмінні процеси [89]. Втручання при саркопенії включають фізичні вправи та харчування [90, 91], оскільки обидва вони позитивно впливають на анаболізм білка, але також посилюють інші аспекти, що сприяють самопочуттю у людей похилого віку, такі як фізична функція, якість життя та анти- запальний стан [92]. Тренування на опір призводить до справжнього збільшення сухої маси тіла та сили м’язів у здорових людей похилого віку, і тому вважається найкращим методом вправ для лікування саркопенії [93]. Нарощування доказів підтверджує збільшення споживання м’язового білка за допомогою втручання поживних речовин у поєднанні з відповідними скорочувальними маніпуляціями [94]. Важливим для людей похилого віку є те, що підняття ваги з низьким навантаженням ефективно стимулює показники MPS до рівня, порівнянного з традиційними високими навантаженнями, крім інших переваг, таких як покращена аеробна здатність [95].
Старіючий м’яз також є значущим предиктором падінь та переломів, пов’язаних із втратою незалежності в літньому віці [107, 108]. Таким чином, анаболічні втручання проти саркопенії є особливо актуальними в цій когорті, оскільки вони частіше зустрічаються у літніх пацієнтів із переломами стегна [109]. Хоча недоїдання енергії білка передбачає поганий результат у пацієнтів із переломами стегна, збільшення споживання енергії та білка сприятливо впливає на післяопераційний перебіг у людей похилого віку з переломами стегна [110]. Підводячи підсумок, клініцисти не повинні випускати з уваги переваги поєднаних фізичних вправ та прийому білка. Стимуляція м’язів необхідна для запобігання втрати м’язів, підтримання нормальної роботи м’язів та зменшення запалення у госпіталізованих пацієнтів; це вирішальні способи послабити розвиток інфекції та смертність. Крім того, існує очевидна потреба в харчуванні білка, що перевищує поточну RDA, у людей старшого віку, особливо в періоди, коли опорно-рухова маса порушена, наприклад, іммобілізація, при цьому експерти рекомендують від 1,2 до 2,0 г/кг маси тіла на день [111].
Кількість, якість і час споживання білка
Метаболізм триптофану-кінуреніну та імунна активація при старінні
Імунна активація при старінні впливає на метаболізм амінокислот [120]. Хоча для синтезу білка використовується менше 1% дієтологічного триптофану, метаболізм триптофану може мати особливе значення у літніх людей. Незамінний амінокислота триптофан є не тільки єдиним попередником серотоніну і, отже, важливим для настрою та пізнання, але він також пов’язаний із запаленням та активацією імунітету через так званий кінуреніновий шлях (КП), який часто системно регулюється при імунній відповіді активовано [121]. Th1-тип цитокінового інтерферону-гама, серед інших біохімічних шляхів, індукує розпад триптофану ферментом індолеамін 2,3-діоксигеназою (IDO-1). В результаті прискореної активності IDO-1 рівні індолеамінів триптофану та серотоніну знижуються, і це може збільшити ризик, наприклад, когнітивних порушень. Активовану імунну систему у літніх людей можна виявити при підвищенні концентрації кінуреніну до триптофану (рис. 2).
Процес старіння включає прозапальні шляхи, які включають активацію осі Т-клітина-макрофаг в рамках клітинно-опосередкованої (Th1-типу) імунної відповіді, в якій утворюється Th1-тип цитокінового інтерферону-γ (IFN- γ) є надзвичайно актуальним. IFN-γ стимулює широкий спектр біохімічних шляхів, спрямованих на зупинку небажаного росту патогенів або злоякісних клітин. Серед них перетворення незамінної амінокислоти триптофану в кінуренін є ключовим елементом, який, з одного боку, бере участь у пригніченні зворотного зв’язку активації Т-клітин через регуляторні Т-клітини і, отже, імуносупресивний. З іншого боку, катаболіти, утворені цією стратегією, можуть впливати на центральну нервову систему, коли нейроактивні сполуки накопичуються, а прозапальні каскади, включаючи утворення активних форм кисню (АФК), перешкоджають нейроендокринній сигналізації, яка контролює настрій і поведінку.
Обмеження енергії однозначно призводить до низького вмісту триптофану в плазмі крові, а отже, і його доступності, що може підірвати метаболізм серотоніну, КП і згодом імунну систему [122]. Крім того, потік триптофану через печінковий КП посилюється за рахунок конкуруючих амінокислот, таких як лейцин [123]. Хоча дієта з високим вмістом білка забезпечує більше триптофану для КП, парадоксально зменшується доступність триптофану в мозок, оскільки триптофан конкурує з іншими великими нейтральними амінокислотами (LNAA) за транспорт через гематоенцефалічний бар’єр [124]. Наприклад, сніданок, багатий білками, спричиняє значне зменшення співвідношення триптофану та LNAA у плазмі крові [125]. Незважаючи на те, що ці зміни стосуються гострого споживання білка, споживання білка з високим вмістом білка обмежує доступність триптофану для церебральної КП, може надалі впливати на синтез серотоніну і може порушити пам'ять і пізнання, а також сон і настрій, що врешті-решт збільшує ризик розвитку деменції та депресія (рис. 3).
З іншого боку, помірні фізичні вправи, потужний стимул для модуляції метаболізму триптофану, можуть бути корисними для покращення стану настрою [126]. Під час фізичних вправ надходженню триптофану в мозок через гематоенцефалічний бар'єр сприяє збільшення використання м'язів амінокислот з розгалуженим ланцюгом (ВСАА) та підвищений вміст жирних кислот у плазмі крові. Це підвищує відношення незв’язаного триптофану до BCAA з наступним значним збільшенням доступності триптофану в мозку, що призводить до більш високих концентрацій серотоніну в деяких областях мозку [127]. Недавні результати показують, що регулярні фізичні навантаження на витривалість також спричиняють адаптацію метаболізму кінуреніну за рахунок збільшення експресії кінуренінінамінотрансферази скелетних м’язів, що зміщує метаболізм кінуреніну від нейротоксичних метаболітів кінуреніну, таких як хінолінова кислота, до виробництва кінуренової кислоти. Цим методом запобігається перетин кінуреніну через гематоенцефалічний бар’єр та порушення нервової пластичності, що може мати значення для рекомендацій щодо фізичних вправ для пацієнтів з депресивними розладами [128].
Триптофан-кінуренін, саркопенія та довголіття
Процес старіння супроводжується хронічною імунною активацією та запаленням, а саркопенія може бути наслідком контррегуляторної стратегії імунної системи, що гасить процес імунної активації. Таким чином, розбиття триптофану може представляти важливий контрольний пункт. Позбавлення триптофану може пригнічувати процеси імунної активації шляхом обмеження біосинтезу білка та індукції регуляторних Т-клітин метаболітами кінуреніну [129, 130]. У здорових людей похилого віку спостерігали прискорений розпад триптофану [131, 132]. Це може стосуватися конкретних клінічних діагнозів, поширених у літньому віці, таких як серцево-судинні захворювання, хронічні інфекції або рак. Подібним чином, не тільки втрата імунокомпетентності, але також зниження когнітивних здібностей та пам’яті та вищий ризик депресивного настрою може розвинутися на основі дефіциту триптофану через прискорений зрив. Таким чином, ці симптоми можуть представляти побічні ефекти імунобіохімічних подій, що виникають внаслідок хронічної імунної активації.
Тривалий час імуносупресивна та/або протизапальна терапія обговорюється як профілактичний та терапевтичний підхід для зменшення вікових захворювань та збільшення тривалості життя [133, 134]. Більш високий рівень розпаду триптофану та нижчий рівень триптофану в сироватці крові були описані як пов’язані із зменшенням залишкового тривалості життя у осіб із серцево-судинним ризиком, і це стосувалося не лише серцево-судинної смертності, але й загальної смертності [135, 136]. Цікаво, що імуномодулюючі властивості рапаміцину та ресвератролу також відповідають за їх здатність пригнічувати розпад триптофану та активацію IDO-1, які спостерігались у мононуклеарних клітинах периферичної крові людини in vitro [137, 138]. Тоді як інтенсивні фізичні вправи можуть провокувати хронічну імунну активацію і, отже, можуть брати участь у розвитку порушеної імунної функції [139], помірне фізичне навантаження та м’язова підготовка можуть розглядатися як ефективні стратегії проти перевантаження антиоксидантами, але якою мірою вони можуть бути здатний боротися зі змінами, пов'язаними зі старінням, у метаболізмі триптофану, ще залишається показати.
Висновок
М'язова сила відіграє незалежну роль у профілактиці хронічних захворювань, тоді як м'язова слабкість сильно пов'язана з функціональними обмеженнями та фізичними вадами. Крім того, низька м’язова сила визнана чинником ризику передчасної смертності, що перевищує традиційні фактори ризику, такі як гіперхолестеринемія, ожиріння, гіпертонія та куріння. З вищевказаних причин і оскільки, як відомо, м’язова сила знижується з віком, в даний час численні медичні організації призначають фізичні вправи типу резистентності та витривалості з метою поліпшення фізичної форми та протидії несприятливим наслідкам старіння на параметри, пов’язані зі здоров’ям, зокрема ризик захворюваності та смертності [140-142]. Крім того, використання дієтичних добавок до білка може ще більше посилити анаболізм білка, але також може сприяти активнішому способу життя, тим самим підтримуючи добробут та активне старіння у людей старшого віку.
- Роб Гудвін Фітнес Сила Витривалість Довголіття Здоров’я
- Протеїнозберігаючий ефект при збільшенні ліпідів з їжею у молоді гібридної риби тамбатінга
- Роль дієтичного споживання солі та калію у серцево-судинних захворюваннях та захворюваннях
- Роль мікробіома в опосередкуванні впливу на здоров’я дієтичних компонентів Журнал сільського господарства
- Розділ B Роль неживних дієтичних компонентів - дієта, харчування та рак - NCBI