Резистентність до адипонектину та судинна дисфункція в гіперліпідемічному стані
Анотація
Вступ
Судинна активність інсуліну та судинна інсулінорезистентність (ІР)
Добре встановлено, що інсулін стимулює вироблення вазодилататора ензотелію, оксиду азоту (NO). І інсулін, і класичні вазодилататори (включаючи ацетилхолін) стимулюють вироблення NO шляхом активації ендотеліальної NO-синтази (eNOS) 10. Однак інсулін активує eNOS без участі кальцію через інсулінорецепторну тирозинкіназу, викликаючи каскад фосфорилювання/активації: субстрат-1 рецептора інсуліну (IRS-1) фосфорилюється, зв'язуючи IRS-1, активуючи фосфоїнозитид-3-кіназу (PI3K), активуючи 3-фосфоїнозитидзалежну протеїнкіназу-1 (PDK-1), яка фосфорилює протеїнкіназу B (Akt), в кінцевому рахунку фосфорилюючи та активуючи eNOS, що призводить до збільшення продукції NO протягом хвилин 11 .
Численні дослідження на хворих на цукровий діабет 2 типу та на моделях тварин підтверджують стійку взаємозв'язок між ІЧ та дисфункцією ендотелію, вимірюваної порушенням ендотеліозалежної вазодилатації 2. Чи пов'язані ці два стани безпосередньо, чи є проявами загальної основної патології, залишається невизначеним. Слід зазначити, що деякі дослідники припускають, що дисфункція ендотелію може викликати ІР 12. Незважаючи на те, що припускають, що дисфункція ендотелію може перешкоджати засвоєнню глюкози, зменшуючи кровотік скелетних м'язів 13, навряд чи це має велике фізіологічне значення.
APN у фізіології судин та патофізіології
Вплив APN на судинну структуру та функції
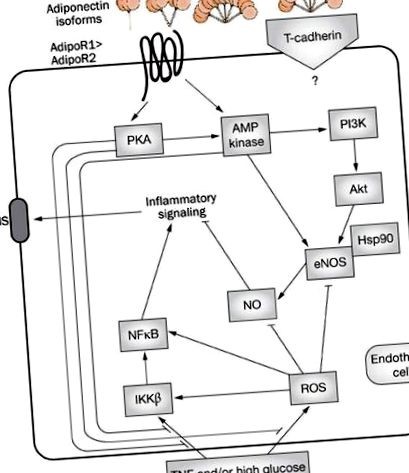
Сигналізація адипонектину в ендотеліальних клітинах.
Роль APN у метаболічних та судинних захворюваннях
Нещодавно APN-дефіцитних мишей успішно встановили шляхом генного націлювання. Миша-нокаут APN демонструє уповільнений кліренс вільного FA у плазмі, низький рівень РНК-передавача жирової кислоти 1 в м’язах, високий рівень РНК-месенджера TNF-α в жировій тканині та високі концентрації TNF-α у плазмі 34 .
Миші, що нокаутують APN, виявляють глибоку неоінтимальну гіперплазію, незважаючи на нормальний метаболізм глюкози та ліпідів під час нормального харчування 35. Ці дані свідчать про те, що пошкодження неоінтими не прискорюється внаслідок порушення обміну глюкози/ліпідів, а натомість безпосередньо спричинене дефіцитом APN. Трансгенних/апо-Е-нокаутованих мишей APN захищали від атеросклерозу порівняно з мишами апоЕ-нокауту 22, підкреслюючи роль APN як ендогенного антиатерогенного фактора, причому гіпоадіпонектинемія відіграє важливу роль в атеросклеротичному процесі. Таким чином, терапевтичні підходи щодо підвищення концентрації APN у плазмі можуть бути корисними для захисту від розвитку атеросклерозу, а також для запобігання рестенозу після ангіопластики.
Судинна дисфункція при метаболічному синдромі (гіперліпідемія та діабет)
Гіперліпідемія та судинна дисфункція
Добре встановлено, що гіперліпідемія погіршує функцію ендотелію у експериментальних тварин. Судини, вилучені з високочастотних дієтичних тварин, виявляють помітно аномальну ендотелійзалежну судинну релаксацію до таких речовин, як ацетилхолін та тромбін, тоді як розширення судин у відповідь на агенти, що діють безпосередньо на гладкі м’язи судин (такі як нітрогліцерин, нітропрусид натрію або SNAP), залишаються незмінними 37 . Розглядаючи, звідки може виникнути дисфункція ендотелію при гіперліпідемії, серед найбільш вірогідних механізмів є знижений синтез біоактивованого NO. Окрім судинорозширювальних ефектів, NO має багато повідомлених антиатерогенних властивостей, включаючи зменшення агрегації тромбоцитів 40, обмеження проліферації судинних клітин гладком'язової мускулатури, інгібування експресії молекули адгезії в ендотелії 42, інгібування адгезії нейтрофілів та моноцитів до ендотелію 43, 44 та запобігання хемотаксису моноцитів 45. Хронічне забезпечення L-повідомлялося, що аргінін для раціону кролів з гіперхолестеринемією покращує ендотелію-залежну вазодилатацію та зменшує ступінь атеросклеротичних уражень 46 .
Також важливим фактором для опосередкованої гіперліпідемією дисфункції ендотелію є підвищена продукція активних форм кисню (АФК, таких як супероксид-аніон) та результуюча кількість продуктів реакції пероксинітриту 37. Мембранно-асоційовані NAD (P) H-залежні оксидази, які можуть активуватися PKC в гіперліпідемічному стані, є основним джерелом супероксидного аніону 47. Пероксинітрит, швидкий продукт реакції NO і супероксидного аніона [швидкість 5 × 10 9 (моль/л) -1 с -1] 48, і нітрування білка, що утворюється в результаті, вважаються відповідним посередником і маркером різних пошкоджень судин, викликаних АФК/RNS., такі як атеросклеротичні ураження 49 .
Діабет та судинна функція
Взаємозв’язок між інсуліновою сигналізацією та APN-сигналізацією
Роль APN у регуляції передачі сигналів про інсулін
Запропоновано, що білок адипонектин, отриманий з адипоцитів, відіграє важливу роль у регуляції енергетичного гомеостазу та чутливості до інсуліну. Вінзелл та його колеги розкрили потенційну подвійну роль APN щодо секреції інсуліну. У звичайних острівцях підшлункової залози APN (5 мкг/мл) не робив значного впливу на секрецію інсуліну. Однак у мишоподібних острівців, які отримували резистентність до інсуліну при високочастотному харчуванні, APN пригнічував секрецію інсуліну при 2,8 ммоль/л глюкозиP 58. Мутація гена APN у людини призводить до порушення мультимеризації APN і, отже, пов'язана з підвищеним ризиком розвитку діабету 2 типу 59. Дослідження на тваринах виявляють, що у трансгенних мишей (гомозиготна нуль для APN) розвиваються гіперглікемія та гіперінсулінемія в нормальних умовах або на дієті з високим вмістом жиру 60. Однак ін'єкції екзогенного APN мишам з ожирінням знижували рівень глюкози та FA у плазмі крові, пригнічуючи вироблення глюкози в печінці та окислюючи жирні кислоти в м'язах, тим самим покращуючи IR 61, 62. Крім того, лікування хворих на цукровий діабет 2 типу розиглітазоном, агоністом PPARγ (клас сенсибілізуючого інсулін), може послабити ІР за допомогою стимуляції виробництва APN 63 .
Маллен та його колеги продемонстрували як APN, так і резистентність до інсуліну у щурів, які харчувалися дієтою з високим вмістом насичених жирів. Тварини виявляли притуплену реакцію окислення FA на глобулярний APN, а також знижений максимальний стимульований інсуліном транспорт глюкози 9. Пізніші дослідження за участю щурів, що харчувались ВЧ, показали, що втрата стимулюючого ефекту APN на окислення FA передувала збільшенню плазмолемальних транспортерів FA. Завдяки накопиченню внутрішньом’язового діацилгліцерину (DAG) та кераміду, сигналізація про інсулін, таким чином, притуплялася, і спостерігалося порушення максимального стимульованого інсуліном транспорту глюкози в скелетних м’язах 64. Брюс та його колеги вивчали пацієнтів із ожирінням без значного ІР, але виявили, що у них знизився рівень APN у сироватці крові. Крім того, спостереження притупленої активації AMPK глобулярною APN в ожирінні м’язах припустило розвиток резистентності APN при ожирінні 65. Підсумовуючи, APN, ймовірно, є важливим посередником при ожирінні або ВЧ, спричинених ВЧ-дієтою.
Подальші дослідження були проведені для вивчення впливу APN на ІЧ-передачу та передачу сигналу інсуліну. Дітц-Шредер та його колеги показали, що APN інгібує секрецію адипоцитів ІР-індукуючих цитокінів, включаючи IL-6, IL-8 та хемотаксичний білок-1 моноцитів (MCP-1) 66. Регуляція цих адипоцитокінів (вже встановлена як пов’язана з ожирінням та діабетом) за допомогою APN передбачає молекулярний зв’язок між ожирінням та ІР скелетних м’язів. Нещодавно Фіаскі та його колеги повідомили про здатність APN у транс-активації рецептора інсуліну 67. Більш конкретно, стимуляція APN виробляє перехідний сплеск активних форм кисню (АФК) і спричинює окислення/інгібування білково-тирозинфосфатази (PTP) 1B у клітинах печінки. Тоді APN викликає посилену асоціацію PTP1B з рецептором інсуліну, в кінцевому рахунку провокуючи незалежне від ліганду транс-фосфорилювання рецептора інсуліну. Ці результати продемонстрували, що APN транс-активує рецептор інсуліну методами окисно-відновного відновлення та незалежності від лігандів.
Роль інсуліну в регуляції сигналізації APN
APN швидко та потужно стимулює AdipoR1 у міотрубках, отриманих від худорлявих здорових людей 68. На противагу цьому, міотрубки, виділені від пацієнтів із ожирінням, пацієнтів із діабетом із ожирінням та пацієнтів, які втратили значну вагу після баріатричної операції, більше не стимулювались APN 68. Нездатність скелетних м'язів людей із ожирінням та діабетом реагувати на екзогенний APN може бути додатково придушена внаслідок порушення регуляції гена AdipoR1.
Миші MKR експресують домінантно-негативні мутантні інсуліноподібні фактори росту (IGF) -I рецептори в скелетних м'язах. Виявлено, що м’язи, печінка та жирова тканина, виділені від цих мишей, резистентні до інсуліну 69. Миші демонстрували підвищений рівень APN, знижену реакцію глюкози на гострі добавки APN; крім того, хронічне лікування APN не змогло покращити чутливість до інсуліну та толерантність до глюкози 69, хоча дослідження рівня мРНК рецепторів APN та APN стимулювало фосфорилювання AMPK у скелетних м'язах та печінці, подібне між MKR та мишами дикого типу 69. Таким чином, стійкість до APN, очевидна у мишей MKR, може бути результатом ІЧ. Використовуючи модель миші з нокаутом адипоцитарних рецепторів інсуліну, Лін та його колеги виявили гіперадіпонектинемію з нормальним рівнем рецепторів APN-1 та -2 (AdipoR1/R2) 70. Більше того, екзогенне введення APN не змогло знизити рівень глюкози або викликати активацію AMPK, що відповідає стану резистентності до APN 70. Ці результати додаткової підтримки ІР можуть зіграти вирішальну роль у зменшенні ефекту APN.
Цучіда та його колеги 71 помітили, що експресія AdipoR1/R2, здається, обернено корелює з рівнем інсуліну в плазмі крові в природних умовах. Цікаво, що інкубація гепатоцитів або міоцитів з інсуліном знижувала експресію AdipoR1/R2 через залежний від фосфоїнозитид 3-кінази/Foxo1 шлях в пробірці. Більше того, спостерігається значне зниження AdipoR1/R2 в скелетних м’язах та жировій тканині, виділеній із стійкого до лептину дефіциту інсуліну об/об модель миші 71. Це корелювало зі зменшенням зв'язування APN з мембранними фракціями скелетних м'язів та зменшенням активації AMPK APN. Подібним чином Інукай та його колеги 72 виявили, що інсулін чинить інгібуючий ефект на експресію AdipoR1 в механізмі, опосередкованому PI3K-залежним шляхом, а не MAPK. На відміну від Інукая, Штайгер та його колеги 73 повідомили, що інсулін безпосередньо не змінює експресію мРНК AdipoR1 у клітинах скелетних м'язів людини. Ці розбіжності можуть бути пов’язані з різницею в моделі тварин, типах клітин або станах, що використовуються в цих різних дослідженнях. Потрібні додаткові дослідження для з'ясування ролі інсуліну в регуляції експресії рецепторів APN.
Патогенна роль інсулінорезистентності при індукованій гіперліпідемією судинній дисфункції
Показано, що збільшення діацилгліцерину та кераміду при гіперліпідемії активує ПКК, зменшує активність PI3K, пов’язану з IRS-1, та інгібує фосфорилювання/активацію Akt 74, 75. Ці ефекти передачі сигналу можуть зменшити активність eNOS та вироблення NO. Крім того, аполіпопротеїн (апо) CIII, невеликий білок, який знаходиться в кількох копіях на поверхні ліпопротеїдів дуже низької щільності (ЛПОНЩ) і ліпопротеїдів низької щільності (ЛПНЩ) 76, інгібує IRS-1/PI3K/Akt/Шлях eNOS через активацію PKCβ в ендотеліальних клітинах пупкової вени людини 77. Рівні апоСIII у плазмі є найважливішим зв'язком між дисліпідемією та ІР у ендотеліальних клітинах судин з наслідком шкідливого впливу на їх атеропротекторні функції.
Рівень вільних жирних кислот у плазмі крові (FFA) відіграє вирішальну роль у судинорозширювальному та метаболічному ефектах інсуліну. Інфузія тригліцеридів у щурів підвищує рівень циркулюючої жирної кислоти, що спричиняє значні порушення у наборі капілярів скелетних м’язів. Під час процедури затискання глюкози у щурів спостерігали зниження утилізації глюкози на 40%, при рівноважному рівні інсуліну в плазмі крові приблизно 600 мкм 78. У худорлявих жінок різке підвищення рівня FFA погіршує набір капілярів та опосередковану ацетилхоліном вазодилатацію до та під час гіперінсулінемії 79. Крім того, судинорозширювальні дії інсуліну покращуються при зниженні рівня FFA у жінок із ожирінням 79. Зворотна залежність між набором капілярів та рівнем FFA, при одночасних змінах поглинання глюкози, опосередкованого інсуліном, принаймні частково відповідає за індуковану FFA мікросудинну дисфункцію при розвитку ІР, пов’язаного з ожирінням, та гіпертонії.
У сукупності гіперліпідемія, гіперглікемія та компенсаторна гіперінсулінемія при наявності діабету сприяють незалежному розвитку дисфункції ендотелію. У дисметаболічному стані основні механізми включали прозапальну ліпотоксичність та глюкотоксичність ендотелію та специфічне для шляху шляху порушення PI3K. Молекулярні та клітинні механізми, що опосередковують ІР при індукованій гіперліпідемією ендотеліальній дисфункції, різноманітні і відображають складні взаємодії між запальними та метаболічними шляхами (рис.2).
Резистентність до адипонектину (AR) та гіперліпідемічна судинна патофізіологія.
- Огляд дієтичних добавок, спричинених дисфункцією нирок, Американське товариство нефрології
- Чи найкращі тренажерні зали з гідравлічним опором?
- Найкращі смуги опору 2020 року - Business Insider
- Державний секретар штату Арканзас
- 10-хвилинне тренування групи опору для спалювання жиру