Ремоделювання спіральної артерії та інвазія трофобластів при гестозі та обмеженні росту плода
Від Інституту медичної генетики Медичного коледжу, ветеринарії та наук про життя Медичного факультету Університету Глазго, Глазго, Великобританія (F.L.); та Група з репродуктивної та судинної біології, Інститут клітинної медицини, Медична школа, Університет Ньюкасла, Ньюкасл-апон-Тайн, Великобританія (J.N.B., S.R.).
Від Інституту медичної генетики Медичного коледжу, ветеринарії та наук про життя Медичного факультету Університету Глазго, Глазго, Великобританія (F.L.); та Група з репродуктивної та судинної біології, Інститут клітинної медицини, Медична школа, Університет Ньюкасла, Ньюкасл-апон-Тайн, Великобританія (J.N.B., S.R.).
Від Інституту медичної генетики Медичного коледжу, ветеринарії та наук про життя Медичного факультету Університету Глазго, Глазго, Великобританія (F.L.); та Група з репродуктивної та судинної біології, Інститут клітинної медицини, Медична школа, Університет Ньюкасла, Ньюкасл-апон-Тайн, Великобританія (J.N.B., S.R.).
Ви переглядаєте останню версію цієї статті. Попередні версії:
Анотація
Прееклампсія, що визначається гіпертонією та протеїнурією, вражає від 3% до 7% вагітностей, є основним фактором, що сприяє захворюваності та смертності матерів та плодів2, і щорічно спричиняє 50 000 смертей у всьому світі. 3 Хоча прееклампсія часто асоціюється з обмеженням росту плода (FGR), FGR може виникати за відсутності материнських особливостей. Матері та діти вагітності, ускладненої прееклампсією, довгостроково збільшують ризик серцево-судинних захворювань та передчасної смерті. 4,5 Походження прееклампсії не зрозуміле, але тісно пов'язане з відмовою або частковою недостатністю ремоделювання спіральної артерії. 1 Спочатку вважалося специфічним для судин міометрія, також повідомлялося про 6 неоптимальних способів ремоделювання в децидуальних судинах. 7,8 Немодифіковані/частково модифіковані судини можуть подавати високі або періодичні імпульси потоку тиску, і тому пошкодження плаценти виникає в результаті гідростатичного стресу або внаслідок зміни подачі кисню. 9,10
Запропоновано 3-стадійну модель прееклампсії. 11 Перша стадія включає часткову недостатність імунної толерантності матері до антигенів, вираженої за допомогою батьківського ЕВТ. Це призводить до зменшення інвазії клітин ЕВТ плода та зменшення ремоделювання спіральних маткових артерій (стадія 2) і, врешті-решт, дисфункціональної матково-плацентарної циркуляції з окислювальним стресом та генерації факторів, що виділяються в материнський кровообіг (стадія 3).
Класичні гістологічні дослідження на плацентарному руслі при прееклампсії були отримані на основі спостережень на парафінових зрізах; інтерпретації були обмежені через відсутність антитіл для виявлення конкретних типів та структур клітин. Труднощі з отриманням біоптатів плацентарного ложа перешкоджали подальшим дослідженням. У цьому дослідженні ми використовували імуногістохімічні методи, застосовані до заморожених зрізів плацентарного русла, щоб виявити нові уявлення про невдалі фізіологічні зміни прееклампсії та ФГР, і вперше ми пов’язуємо ці зміни з клінічними параметрами матері та плоду.
Матеріали і методи
Предмети
Таблиця. Клінічні подробиці пацієнтів, набраних для відбору плацентарного ложа
Імуногістохімія
Серійні зрізи кожної біопсії (що містять один і той же посудину) були імуно забарвлені за допомогою техніки авідин-біотин-пероксидаза (комплект Vectastain Elite; Vector Laboratories, Великобританія) для цитокератину для ідентифікації EVT, для десміну для ідентифікації судинних та міометріальних м’язів та для von Фактор Віллебранда або CD31 (молекула адгезії клітин ендотеліальних клітин тромбоцитів) для ідентифікації ендотелію. Кожне моноклональне антитіло було оптимізовано перед використанням: LP34 цитокератини 5, 6, 18 (Novocastra, Великобританія) 1: 200; десмін (NCL-DES-DE-R-11) 1: 100 (Новокастра); та коефіцієнт фон Віллебранда (Дако, Великобританія) 1: 800 (детальніше див. Додаток до даних лише в Інтернеті). Імунозабарвлені зрізи цитокератину додатково фарбували методом періодичної кислоти – Шиффа для виявлення фібриноїду; після розвитку реакції DAB (3,3-діамінобензидину) зрізи інкубували протягом 5 хвилин в 1% періодичній кислоті (Sigma), промивали і накладали протягом 10 хвилин на реагент Шиффа (Sigma). Після подальшого промивання зрізи фарбували гематоксиліном Майєра протягом 30 секунд. Всього було використано 6 предметних стекол, включаючи пляму гематоксиліну та еозину.
Аналіз структурних змін у плацентарному руслі
Структурні зміни біоптатів плацентарного русла оцінювали на основі системи, описаної раніше. 18,19 секцій було забито двома спостерігачами (F.L. та J.N.B.), засліплених за особистістю секцій. Згода щодо оцінки всіх гістологічних ознак між двома спостерігачами була дуже високою (98%). Приклади оцінювання гістологічних категорій наведені в розділі Результати та в наших попередніх публікаціях. 20,21 Зрізи, що містять децидуальні або міометріальні судини, аналізували окремо.
Фігура 1. Приклади різних методів фарбування, що використовуються для ідентифікації клітин та клітинних структур у біоптатах плацентарного ложа. A, Судина міометрія прееклампсії, імунологічно забарвлена на десмін (оцінка = повністю збережена). Зірочка позначає міометрій. B, Прееклампсія повністю зберегла посудину міометрія, імуно забарвлену на цитокератин (інтерстиціальний екстравілозний трофобласт [EVT] бал = 1 [вищий]; ендоваскулярний бал EVT = 2 [відсутній]). C., Прееклампсія повністю зберегла посудину міометрія, імуно забарвлену на цитокератин (інтерстиціальний бал EVT = 2 [норма]; периваскулярний бал EVT [позначений стрілкою] = 2 [норма]]). D, Нормальна вагітність, децидуальна судина, імуно забарвлена на десмін (показник середовища = повністю зруйнований; ендоваскулярний показник EVT = 1 [присутній, позначений стрілкою]). Е, Нормальна вагітність, децидуальна посудина, імуно забарвлена на фактор VIII, а паралельна секція, імунофарбована на цитокератин (F). Ендоваскулярний показник EVT = 1. Стрілка вказує на ендоваскулярну пробку EVT. G, Нормальна вагітність, децидуальна судина, імуно забарвлена десміном (показник середовища = дезорганізований, фібриноїдний бал
Зрушення ЗМІ
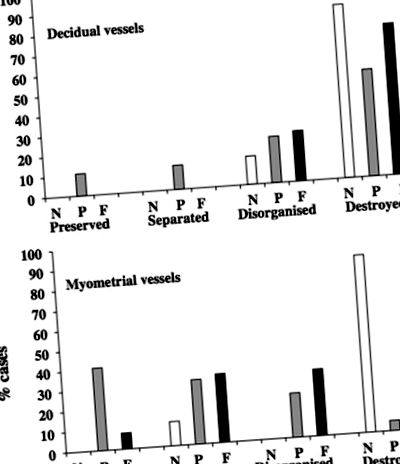
Малюнок 2 показує ступінь руйнування середовища у всіх спіральних артеріях. У нормальній групі 86% децидуальних судин мали відсутні/сильно дезорганізовані середовища, а у 14% - дезорганізовані. У прееклампсії 53% децидуальних судин виявляли відсутні/сильно дезорганізовані середовища, 23% - дезорганізацію, 12% - поділ, тоді як середовище зберігалося у 11%. У ФГР 75% суден широкого загалу мали відсутні/сильно дезорганізовані засоби масової інформації та 25% були дезорганізовані. При нормальній вагітності 88% судин міометрія мали відсутні/сильно дезорганізовані середовища, а 12% мали медіальне відділення. На противагу цьому, при прееклампсії лише 5% судин міометрія мали відсутні/сильно дезорганізовані середовища, 22% - дезорганізовані та 32% відокремлені середовища, тоді як у 41% середовища були повністю збереженими. У FGR 25% судин міометрія відсутні/сильно дезорганізовані, 33% дезорганізовані, 34% відокремлені та 8% збережених середовищ. У обох прееклампсіях менше було порушення медіа у спіральних артеріях міометрія (P= 0,0001; АБО, 0,14; 95% ДІ, 0,05–0,33) та FGR (P= 0,0001; АБО, 0,13; 95% ДІ, 0,05–0,32) порівняно з контролем. Не було різниці між прееклампсією та FGR (P= 0,93; АБО, 0,9; 95% ДІ, 0,85–9,6).
Малюнок 2. Ступінь порушення медіа (%) у децидуальному (A) та судин міометрія (B), отримані у випадках нормальної вагітності (N), прееклампсії (P) та випадків обмеження росту плода (F). Порушення середовища в цілому зменшилось у спіральних артеріях міометрія в обох прееклампсіях (P= 0,0001) та обмеження росту плода (P= 0,0001) порівняно з контролем.
Порушення медіа та клінічні параметри
Судини міометрія від випадків з вагою при народженні
Малюнок 3. Відсоток випадків або з високим екстравілозним трофобластом (EVT; 1), або з нормальним (2) в децидуальних судинах, отриманих від нормальної вагітності, випадки прееклампсії (PE) та випадки обмеження росту плода (FGR; A). B, Висновки щодо судин міометрія. Для децидуальних судин менша кількість судин отримала високий показник EVT у нормальній групі порівняно з FGR (P= 0,001) і в ПЕ порівняно з ФГР (P= 0,001). Що стосується судин міометрію, менше судин має високі показники в нормальній групі порівняно з FGR (P= 0,003) і в ПЕ порівняно з ФГР (P= 0,001).
Ендоваскулярний ЕВТ
На рисунку 4 показано відсоток випадків з ендоваскулярним ЕВТ або без нього у децидуальних (верхній графік) та міометріальних (нижній графік) судинах у 3 групах. Між групами змін не виявлено. Не виявлено зв'язку між наявністю або відсутністю ендоваскулярного ЕВТ та клінічними параметрами.
Малюнок 4. Відсоток випадків з ендоваскулярним екстравілозним трофобластом (ЕВТ) у децидуальних судинах (A) або судини міометрія (B) для нормальної вагітності, прееклампсії (ПЕ) та обмеження росту плода (FGR).
Інтрамуральний ЕВТ
На рисунку 5 показано відсоток випадків з інтрамуральним ЕВТ або без нього у децидуальному (верхній графік) та судинах міометрія (нижній графік). Не було різниці між групами для децидуальних судин. На відміну від цього, більше судин міометрія з нормальної групи містило внутрішньомуральний ЕВТ порівняно з прееклампсією (P= 0,015; АБО, 5,7; 95% ДІ, 1,39–23,2). Не було різниці між нормальною та FGR-групами щодо наявності інтрамурального EVT (P= 0,95; АБО, 0,93; 95% ДІ, 0,08–9,7). Не виявлено взаємозв'язку між наявністю інтрамурального ЕВТ та клінічними параметрами.
Малюнок 5. Відсоток випадків інтрамурального трофобласта в децидуальних судинах (A) або судини міометрія (B) для нормальної вагітності, прееклампсії (ПЕ) та обмеження росту плода (FGR). Більше судин міометрія з нормальної групи містило інтрамуральний екстравілозний трофобласт порівняно з ПЕ (P= 0,015).
Периартеріальне відкладення фібриноїдів
Результати показані на малюнку 6. Порівняно з нормальною групою, децидуальні судини від FGR мали менше відкладення фібриноїдів (P= 0,013; АБО, 0,077; 95% ДІ, 0,01–0,58). Не виявлено різниці між контрольною та прееклампсійною групами (P= 0,07; АБО, 0,72; 95% ДІ, 0,45–1,03) для децидуальних судин. Що стосується судин міометрія, виявлено менше відкладення фібриноїдів в обох прееклампсіях (P= 0,000; АБО, 0,13; 95% ДІ, 0,05–0,32) та FGR (P= 0,01; АБО, 0,28; 95% ДІ, 0,1–0,76) порівняно з контролем. У групі прееклампсії було менше відкладення фібриноїдів порівняно з FGR (P 5-й процентиль (P
Малюнок 6. Відсоток випадків з
Обговорення
Підсумок та ключові висновки
Наскільки нам відомо, це перше дослідження, яке систематично визначає кількісні зміни EVT та особливостей спіральної артерії у чітко визначених групах нормальної вагітності, прееклампсії та FGR та пов'язує їх із клінічними параметрами. Для ідентифікації конкретних типів та структур клітин було використано цілий ряд антитіл. Це неможливо з класичною гістологією. Основний дефект відбувся при реконструкції спіралі міометрія як при прееклампсії, так і при FGR, що було пов'язано з клінічним результатом. Хоча нездатність знищити гладку мускулатуру стінок судин міометрія є особливістю прееклампсії, 10% децидуальних судин при прееклампсії також зберегли свою м'язову стінку. Відсутність фізіологічних змін у спіральних маткових артеріях не було процесом "все або нічого", причому деякі ненормальні випадки демонстрували, мабуть, нормальне перебудування. Це може бути пов'язано з тим, що не всі випадки прееклампсії та FGR пов'язані з невдалою реконструкцією спіральної артерії. 11 Процентиль ваги при народженні був знижений як у прееклампсії, так і у групах FGR. Таким чином, зниження маси тіла при народженні у групі FGR відбулося не через коротший термін вагітності.
Обмеження класичних гістологічних досліджень
Класичні описові дослідження мають кілька обмежень: антитіла не були доступні для ідентифікації конкретних клітин, судини, як правило, описували як такі, що демонструють фізіологічні зміни чи ні, без узгодженого визначення, і не робилося спроб оцінити зміни в окремих ознаках. Підрахунки балів та статистичні методи застосовувались рідко, а групи суб'єктів визначались погано (наприклад, випадки з немовлятами малого для гестаційного віку або хронічною гіпертензією не аналізувались окремо). 22–26 Багато немовлят малого віку гестаційного віку є конституційно малими; ми чітко вивчили визначені випадки обмеженого зростання. Шеппард та Боннар 27 були першими, хто розглянув вплив змін спіральних артерій на вагу при народженні (детальніше див. Додаток лише для Інтернету). Їхні висновки відрізнялися від результатів Brosens та співавт. 23, які повідомили, що фізіологічні зміни ніколи не спостерігались у судинах міометрія при прееклампсії. Gerretsen et al 28 та Khong et al 6 також повідомили про свої результати від змішаної групи пацієнтів (див. Додаток до даних лише в Інтернеті).
Особливості
Інші особливості
Фібриноїд осідає там, де зруйнована м’язова стінка. В цілому, судини міометрія як у прееклампсії, так і у FGR були пов’язані з меншим відкладенням фібриноїдів, але ми спостерігали деякі випадки, коли мало фібриноїдів і мало м’язів, і навпаки, що узгоджується з Pijnenborg та співавт. відкладення в судинах міометрія проти 3 з 6 у нормальній групі. У нашому дослідженні знижений рівень фібриноїду також був пов'язаний з вагою при народженні 33 Matijevic et al 34 повідомили про більш високий індекс резистентності та індекс пульсаційності у жінок з гестозом; однак Kingdom 35 ставить під сумнів патофізіологічне значення вимірювання 8% матково-плацентарного кровотоку. Інші звіти 36, що стосуються доплерографії, використовували різні групи пацієнтів (див. Лише Інтернет-додаток до даних).
Було припущено, що CTB набуває ендотеліального фенотипу в термін, який характеризується експресією молекули адгезії клітин ендотеліальних клітин тромбоцитів-1 та інших молекул адгезії клітин ендотеліальних клітин, і що відсутність експресії цього фенотипу погіршує інвазивний потенціал CTB. 37 Також було запропоновано, щоб CTB замінив ендотеліальні клітини в термін. Однак спіральні артерії піддаються ремонту і терміново рендотелізуються. 1 Інші опубліковані дослідження повідомляють, що CTB не набуває ендотеліального фенотипу. 1,38 Крім того, оскільки інтерстиціальна інвазія CTB не зазнає невдачі, важко зрозуміти твердження, що пов'язують молекули адгезії з невдалою інвазією CTB.
Далі це дослідження підкреслює, що гестоз є гетерогенним захворюванням, при якому невдале перетворення спіральної артерії, ймовірно, є однією з кількох основних причин. Наше дослідження також підкреслює важливість використання правильних визначень та діагнозу, яких дотримувались не всі попередні дослідження. 39
Останнім часом висловлюється припущення, що прееклампсія раннього та пізнього початку може відрізнятися так само, як і класична ідея плацентарної та материнської прееклампсії; однак, як клінічно визначаються ці та інші можливі підкласи прееклампсії, було проблемою. Рання хвороба частіше пов’язана з важкими ускладненнями як матері, так і дитини, як короткочасний, так і довгостроковий ризик серцево-судинних захворювань. Переважна більшість пацієнтів з прееклампсією у цьому дослідженні проводили лікування до 37 тижнів. У тих небагатьох випадках, які були доставлені через 37 тижнів, у половині з них було відзначено неможливість модифікувати судини міометрія. Незважаючи на те, що невелика кількість випадків, вивчених у групі пізнього початку, не дозволяє проводити статистичне порівняння між захворюваннями раннього та пізнього початку, невдале перетворення спіральної артерії не обмежувалось доставкою до 37 тижнів.
Обмеження
Очевидно, що існують обмеження щодо вивчення малих біоптатів плацентарного ложа; хоча були докладені зусилля для відбору центру плацентарної ділянки, очевидно, що це не завжди досягається, і гістологічні особливості можуть відрізнятися між центром та периферією плацентарного русла. Реконструкція спіральної артерії, яку оцінювали за довільним балом, є якісною, але тим не менш відтворюваною. Опис фізичних змін у популяціях трофобластів та спіральних артеріях не дає жодного розуміння механізмів невдалого ремоделювання. Моделі in vitro з використанням спіральних експлантатів артерій можуть допомогти зрозуміти механізми, хоча залишається проблемою відтворити 2 різні шляхи вторгнення EVT, створити правильне фізіологічне середовище як у кисні, так і в позаклітинному середовищі матриксу та забезпечити відсутність інших клітин як правило, присутній в межах децидуа.
Перспективи
Подяка
Ми вдячні Барбарі Іннес за технічну допомогу та доктору Дженніфер Крослі за статистичну підтримку.
Джерела фінансування
Ця робота була підтримана Британським фондом серця та Action Research.
- Діаграма зростання ваги сибірського хаскі - наскільки важким буде мій сибірський хаскі важити доброго улюбленця
- Рисова вода для росту волосся Як зробити рисову воду для волосся
- ПЕРСОНАЛІЗОВАНА РЕАБІЛІТАЦІЯ ОБМЕЖЕННЯ КРОВІ Процвітає інтегрована фізична терапія SoHo, NoHo,
- Темпи зростання свиней годуються через вимоги
- Ринок штанів для схуднення надійно проаналізовано сегментацію, попит, останні оцінки частки та зростання