Регуляція метаболізму кінуреніну за допомогою кетогенної дієти [S]
Свеня Хайшман
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Ліндсі Б. Гано
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Кевін Квін
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Лі-Пінг Лян
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Яцек Клепацький
iC42 Клінічні дослідження та розробки, † Медичний містечко Аншутц, Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Уве християни
iC42 Клінічні дослідження та розробки, † Медичний містечко Аншутц, Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Ніколь Рейсдорф
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Маніша Патель
Департамент фармацевтичних наук, Фармацевтична школа * Університет Колорадо, Денвер, Аврора, Колорадо, 80045
Пов’язані дані
Анотація
Кетогенні дієти (КД) все частіше використовуються як лікування епілепсії, інших неврологічних захворювань та раку. Незважаючи на тривалу історію придушення судом, чіткі молекулярні механізми дії КД досі в основному невідомі. Метою цього дослідження було визначити ключові метаболіти та шляхи, змінені в гіпокампі та плазмі щурів, які харчувались KD проти контрольної дієти (CD) або ad libitum, або калорійно обмежені до 90% від рекомендованого споживання. Це було досягнуто за допомогою комбінації цільових методів та нецільового аналізу метаболоміки на основі РС. Різні метаболіти та шляхи розкладання триптофану (ГТО), такі як кінуренін (KYN), кінуренова кислота, а також кофактори ферментів, показали значні зміни між групами, що харчуються різними дієтами та/або кількістю калорій у плазмі та/або гіпокампі. KYN був суттєво знижений в обох матрицях у тварин з CD-калорійно обмеженою, KD-ad libitum та KD-calorically-обмеженою групами порівняно з CD-ad libitum групою. Наші дані свідчать про те, що шлях деградації ГТО є ключовою метою КД.
Метаболімічні підходи, тобто оцінка змін у малих молекулах, можуть запропонувати конкретні метаболіти, групи метаболітів та шляхи, які змінюються в певному середовищі. Конкретний метаболом, наприклад із плазми, тканини або сечі, може відображати зміни, викликані захворюваннями, лікуванням чи генетикою. Через дитинство поля дані метаболоміки повинні бути ретельно оцінені не лише програмними засобами, а й вручну, щоб забезпечити точну ідентифікацію ключових метаболітів та метаболічних шляхів, що зазнали впливу в експериментальних умовах. Подальші експерименти з використанням цільових методів можуть допомогти забезпечити впевненість в ідентифікації, заповнити прогалини та підтвердити гіпотези. З цих причин цілеспрямовані підходи, які допомагають слідчим отримати більш детальне розуміння модуляції шляху, як правило, потрібні після менш конкретних досліджень метаболоміки. Отже, це дослідження включає комбінацію цілеспрямованого та нецільового аналізу як у плазмі, так і в тканині гіпокампа, щоб надати всебічне розуміння того, як зміни структури малих молекул у плазмі та гіпокампі співвідносяться з КД.
Плазма, як правило, відображає системні зміни; однак, це може запропонувати зміни метаболітів та метаболічних шляхів у конкретних тканинах, наприклад, певних областях мозку у разі неврологічних/епілептичних розладів. Однак потрібно враховувати компартменталізацію; наприклад, не кожна сполука легко перетинає гематоенцефалічний бар’єр. У випадку з багатьма епілепсіями область мозку, що представляє особливий інтерес, є гіпокампом, оскільки тут відомо, що тут відбувається багато значних змін, пов’язаних із захворюваннями (12–14). Метою цього дослідження було з'ясувати механізми, за допомогою яких КД та обмеження калорій можуть здійснювати свої протисудомні ефекти і які зміни спричинені цими схемами в цілому. Профілювання метаболоміки в плазмі та тканині гіпокампа щурів, які харчувались KD або контрольною дієтою (CD), або вільно (AL), або калорійно (CR) до 90% рекомендованого прийому пропонували зміни в шляху деградації TRP/KYN. Зміни рівнів метаболітів шляху подальшого вивчення проводились за допомогою цільових аналізів; вони включали ВЕРХ-МС/МС та ВЕРХ у поєднанні з електрохімічним виявленням (ЕХД), що виявляє незначні зміни в конкретних шляхах, переважно в плазмі.
МАТЕРІАЛИ І МЕТОДИ
Дослідження на тваринах
Дослідження на тваринах були схвалені та контролювались Комітетом з догляду та використання тварин Університету Колорадо Денвер (Аврора, Колорадо) та проводились відповідно до затверджених рекомендацій. Дослідження було розроблено на основі попередніх досліджень, проведених у нашій лабораторії та проведених, як описано раніше [CD-калорійний (CCR), KD-калорично-обмежений (KCR)] (12, 13). Крім того, були вивчені групи тварин з необмеженим доступом до їжі, щоб отримати детальне уявлення про ефекти м’якого обмеження калорій у порівнянні з годуванням АЛ відповідними дієтами [CD-ad libitum (CAL), KD-ad libitum (KAL)]. Самців щурів Sprague Dawley (P28 на початку дослідження) годували KD (# F3666; BioServ, Flemington, NJ) або CD (# F3517; BioServ) або AL, або обмеження калорій до 90% рекомендованої добової потреби протягом тривалості 3 тижні (n = 6 на групу). Щурів евтаназували через 3 тижні шляхом обезголовлення під наркозом СО2 та збирали зразки тканини та плазми.
Підготовка зразка
Аналіз метаболоміки ВЕРХ-МС.
Сто мікролітрів плазми або гомогенату тканини (тканина 1:10: вода з 0,1% ацетатом амонію та 0,03% бутильованого гідрокситолуолу) використовували для зразка для аналізу, як описано раніше (15). Коротко, внутрішні стандарти були додані в якості контролю якості для екстракції метаболітів, тобто креатинін-d3, D-глюкоза-13 C6, валін-d8, тестостерон-d2, C17 керамід, FA ненасичений C19: 1, гептадеценова кислота та цис-10 -нонадеценова кислота. Для вилучення водних метаболітів та ліпідів із зразків плазми та тканини використано модифіковану двоступеневу екстракцію рідиною-рідиною метил-трет-бутилового ефіру на основі методу екстракції Блі-Даєра.
Аналіз ВЕРХ-МС/МС для цілеспрямованої кількісної оцінки шляху деградації ГТО/KYN.
П'ятдесят мікролітрів гомогенату плазми або тканини розводили 1: 1 0,2% оцтовою кислотою, що містить мічені ізотопом внутрішні стандарти. Додавали сто мікролітрів ацетонітрилу, зразки вихровували протягом 5 хв і центрифугували при 13000 g протягом 10 хв. Супернатанти розбавляли 1: 1 0,2% оцтовою кислотою. Калібрувальна крива, що містить усі аналіти в діапазоні 1–10 000 нг/мл у сольовому розчині, забуференному фосфатом, була підготовлена відповідно.
Аналіз HPLC-ECD для цілеспрямованої кількісної оцінки шляхів деградації ГТО/KYN.
Заморожені гіпокампі обробляли ультразвуком у крижаній 0,1 N хлорної кислоти, центрифугували при 13000 g при 4 ° C протягом 15 хв і збирали супернатанти.
Інструментальний, даних та статистичний аналіз
Аналіз метаболоміки ВЕРХ-МС.
Ліпіди відокремлювали на системі UHPLC Agilent 1290, використовуючи Agilent Zorbax RRHD SB-C18, 1,8 мкм, 2,1 × 100 мм колону з ізопропанолом 60: 36: 4: ацетонітрил: вода + 0,1% мурашина кислота та вода + 0,1% мурашина кислота як мобільні фази. Водні метаболіти поділяли на системі ВЕРХ Agilent 1200 із використанням Phenomenex Kinetex HILIC, 2,6 мкм, 2,1 × 50 мм колонки та 90% ацетонітрилу з рН 5,85 мМ оцтової кислоти та 50% ацетонітрилу з рН 5,85 мМ оцтової кислоти як рухомих фаз. Референтні маси вводили за допомогою ізократичного насоса з розгалужувачем.
Зразки аналізували за допомогою ВЕРХ-МС на приладах Agilent TOF (модель 6210 TOF, ліпіди; модель 6510 Q-TOF, водна фракція) з джерелом електророзпилення в режимі позитивної та негативної іонізації з такими параметрами: температура газу: 300 ° C; сушильний газ: 12 літрів/хв; небулайзер: 30 фунтів на квадратний дюйм; VCap: 4000 В; діапазон мас: m/z 50–1700; спектри: два на секунду; фрагментатор: 120 В.
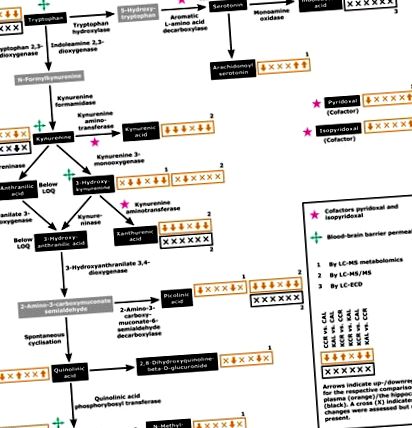
Ключові елементи шляху KYN та пов'язані з ним метаболіти. Стрілки в помаранчевому (плазма) та чорному (гіпокампу) полях показують регуляцію відповідних метаболітів для шести порівнянь у наступному порядку: CCR проти CAL, KAL проти CAL, KCR проти CCR, KCR проти KAL, KCR проти CAL та KAL проти CCR. Цифри позначають відповідні методи оцінки: 1, аналіз метаболоміки LC-MS; 2, LC-MS/MS; 3, LC-ECD. Концентрації метаболітів, позначені в сірих коробках, не оцінювали. Графіки концентрацій метаболітів з детальним статистичним порівнянням представлені на рис. 2. LOQ, межа кількісного визначення.
Зміни метаболітів або (можливо) пов'язаних із шляхами KYN у плазмі (сірі ділянки) та гіпокампах (чорні ділянки) у щурів, яких годували згідно з чотирма дієтичними режимами, CAL, CCR, KAL та KCR. Дані представлені як середнє значення + стандартна помилка середнього значення (n = 6). В: Зміни, оцінені за допомогою аналізу метаболоміки ВЕРХ-МС. B: Зміни, оцінені HPLC-MS/MS. C: Зміни, оцінені HPLC-ECD. Значення P для порівняння за двостороннім ANOVA представлені в додатковій таблиці S3. Для порівняння між групами використовувались постхок-тести Тукі (* P рис. 1), тоді як регулювання шляху KYN не відрізнялося між тваринами AL відповідних груп (четверта стрілка/символ, KCR проти KAL; рис. 1). Загалом, схеми регулювання на рис. 1 демонструють переважно регульований шлях плазми KYN під KD порівняно з CD (друга і третя стрілки в кожному полі, KAL проти CAL та KCR проти CCR; рис. 1). Порівняння KCR проти CAL та KAL проти тварин CCR показує головним чином регуляцію шляху під CD (п’ята стрілка, KCR проти CAL; рис. 1) і відсутність різниці між схемами відповідно (шоста стрілка, KAL проти CCR; Рис. . 1).
ОБГОВОРЕННЯ
Шлях KYN та пов’язані з ним метаболіти
Незважаючи на те, що більшість метаболітів шляху зазнає впливу, зміни KD- або CD-індукованих шляхів KYN раніше не повідомлялись, за одним винятком: повідомляється, що β-гідроксибутират збільшує синтез мозку в мозку in vitro (зрізи кори головного мозку та первинні культури глії ) (20). Цей висновок суперечить нашим результатам in vivo, які показали знижену регуляцію КА плазми крові за кетогенного режиму. Ця розбіжність може бути пов’язана з різницею в препаратах (дослідження in vitro проти досліджень in vivo) або різними досліджуваними областями мозку.
Нещодавнє дослідження повідомляє про підвищену активність індолеамін 2,3-діоксигенази (відповідальної за перетворення ГТО в попередник KYN N-формилкинуренін) у пацієнтів з ідіопатичною генералізованою епілепсією (36). Повідомляється, що мікрогліальна індолеамін 2,3-діоксигеназа та кінуренін 3-монооксигеназа також індукуються на мишачій моделі епілепсії скроневої частки (37). Індукція/підвищена активність цих ферментів може призвести до посиленого продукування 3-HK та інших метаболітів у патологічних умовах. Хоча дискусія щодо змін метаболітів, які спостерігаються в нашому дослідженні, порівняно із змінами окремих ферментів, їх активності та пов’язаних з ними метаболітів на основі результатів цих досліджень може бути спекулятивною, правдоподібно, що порушення регуляції шляху, як показано в нашому дослідженні, може мати терапевтичну ефекти та може протидіяти змінам у ферментативній індукції/активності.
Як вже згадувалося вище, концентрації метаболітів шляху KYN (наприклад, KA та QA) та нейропротекторні індекси у чотирьох дієтичних групах часто демонструють протилежні закономірності, як можна було б очікувати щодо нейропротекції. Однією з причин, чому інтерпретація даних є складною, є те, що взаємозв'язок між периферійним та центральним шляхами KYN є складним (40). Концентрації в плазмі, оцінені в нашому дослідженні, можуть не відображати концентрації метаболітів у гіпокампах, як це спостерігається для деяких метаболітів, виміряних у плазмі, а також гіпокампу, тобто ГТО, XA, піколінової кислоти та нікотинаміду (рис. 2). Тим не менше, зміни в шляху KYN часто описуються в крові або інших біорідинах (порівняно з мозком), і звіти можуть служити для прогнозування та вказівки змін шляху в тканинах, що представляють інтерес, як видно з нашого дослідження. Ще однією причиною невідповідності виміряних результатів щодо очікуваних результатів щодо терапії епілепсії може бути те, що шлях KYN не є основною метою досліджуваних дієт.
Зниження концентрації метаболітів шляху KYN у плазмі за допомогою КД, як показано на рис. 1, узгоджується із зниженою регуляцією шляху разом із обмеженням калорій, оскільки обидва режими харчування продемонстрували подібні реакції з точки зору нейропротекції та протисудомних ефектів (1) . Хоча такі ж метаболіти, як КА, які вважаються нейропротекторними, також були регульовані, терапевтичні переваги загального зниження регуляції шляху KYN за допомогою КД та/або обмеження калорійності можуть переважати недоліки зниження концентрації потенційних нейропротекторів. Як правило, слід пам’ятати, що наші дані були отримані у здорових/неепілептичних тварин; обмеження KD та/або калорій можуть мати різні ефекти при дії на патологічний/епілептичний мозок.
Загалом, на рівні метаболітів шляху KYN в плазмі впливали KD та/або м’яке обмеження калорій, тоді як на рівні метаболітів у гіпокампі здавалося, що це майже не впливає (за винятком KYN). Ці результати узгоджувалися з рештою наших даних метаболоміки (Heischmann et al., Неопубліковані спостереження), які підтвердили, що в плазмі змінюється більше метаболітів, ніж в гіпокампі, і що зміни рівня метаболітів в гіпокампі відбуваються в невеликих межах (головним чином AL ad libitum CAL дієта-контроль ad libitum CCR контроль дієта з калорійним обмеженням CD контроль дієта CR калорійно обмежений ECD електрохімічне виявлення 3-HK 3-гідроксикінуренін KA кінуренова кислота KAL кетогенна дієта-ad libitum KCR кетогенна дієта-калорійно обмежена KD кетогенна дієта KYN кінуренін QA хінолінова кислота ГТО триптофан XA ксантуронова кислота
- Ентеропатія, що втрачає білок, як ускладнення кетогенної дієти - PubMed
- Пругіго пігментоза після суворої кетогенної дієти - Майклз - 2015 - дитяча дерматологія - Wiley
- Проста кетогенна дієта для початківців Посібник із простих кето-порад
- Дієта тонких монетних двотів запобігає енергетичним спайкам; Покращений обмін речовин! за відгуками покупців Середній
- MTOR, метаболізм та регуляція диференціації та функції Т-клітин - Waickman - 2012 -