Прозорість тканин In Vivo
Михайло Інюшин
1 Кафедра фізіології, Центральний університет Карібе, Баямон, PR 00960, США
Дарія Мешалкіна
2 Інститут еволюційної фізіології та біохімії імені Сеченова, Санкт-Петербург 194064, Росія
Лідія Зуєва
1 Кафедра фізіології, Центральний університет Карібе, Баямон, PR 00960, США
Астрід Заяс-Сантьяго
1 Кафедра фізіології, Центральний університет Карібе, Баямон, PR 00960, США
Анотація
Прозорість тканин in vivo у спектрі видимого світла є корисною для багатьох дослідницьких застосувань, які використовують оптичні методи, незалежно від того, включає вони in vivo оптичне зображення клітин або їх активність, або оптичне втручання для впливу на клітини або їх діяльність глибоко всередині тканин, таких як тканини мозку . Класичний погляд полягає в тому, що тканина є прозорою, якщо вона ні поглинає, ні розсіює світло, і, отже, поглинання та розсіювання є ключовими елементами, які слід контролювати для досягнення необхідної прозорості. Цей огляд зосереджений на новітніх генетичних та хімічних підходах для знебарвлення тканинних пігментів для зменшення видимого поглинання світла та методах зменшення розсіювання в живих тканинах. Ми також обговорюємо можливі молекули, що беруть участь у прозорості.
1. Вступ
Багато тварин мають прозорі тканини або повністю прозорі у своєму повсякденному житті. Деякі навіть можуть стати повністю прозорими за бажанням, наприклад, деякі головоногі молюски, які змінюють адсорбцію світла на шкірі (Zylinski and Johnsen, 2011) [1], залежно від сигналів глибини зображення та спрямованого освітлення (Zylinski et al., 2016) [ 2]. Тварини з природною прозорістю мають значні переваги для досліджень, розширюючи спектр можливостей застосування різних оптичних методів (Fetcho and O'Malley, 1995; O'Malley et al., 2003; White et al., 2008; Bin and Lyons, 2016; Antinucci and Hindges, 2016; Harrison et al., 2016; Nicolson, 2017; Saleem and Kannan, 2018) [3,4,5,6,7,8,9,10]. Навіть якщо тварина загалом не є прозорою, вона, як правило, має спеціалізовані живі прозорі клітини, принаймні у зоровій системі тварини, і цю прозорість клітин можна спеціально проаналізувати (Zayas et al., 2018) [11]. Виникають запитання: Чому одні живі клітини прозорі, а інші ні? Чи можемо ми підтримувати живі клітини, роблячи їх прозорими in vivo для технічних цілей? Чи можемо ми зробити тварин прозорими або хоча б частково прозорими або розвинути прозорі тканини та органи тварин in vivo?
Класичний погляд полягає в тому, що тканина є прозорою, якщо вона ні поглинає, ні розсіює світло. Таким чином, поглинання та розсіювання є ключовими елементами, які слід контролювати, щоб досягти необхідної прозорості тканин.
За винятком кількох пігментів, більшість органічних молекул у клітині не здатні поглинати видиме світло. Таким чином, (1) елімінація цих пігментів зменшить абсорбцію і тим самим дасть забарвлення. Цього можна досягти хімічним шляхом додаванням реакційноздатних речовин, які усувають специфічні пігменти, або генетично шляхом виявлення специфічних мутацій, які порушують біосинтез пігменту. Після елімінації пігментів основною причиною будь-якої непрозорості органічних тканин є розсіювання світла (Brunsting and Mullaney, 1974; Tardieu and Delaye, 1988) [12,13].
2. Методи зменшення поглинання світла
2.1. Хімічне забарвлення пігментів
2.2. Генетичний підхід до видалення пігментів
3. Методи зменшення розсіювання світла
3.1. Хімічне зменшення розсіювання In Vivo
3.2. Генетичний підхід до зменшення розсіювання
Як ми вже згадували, існує невідповідність РІ між цитоплазмою та клітинними органелами, а також між клітинами та інтерстиціальною рідиною, яка виробляє оптичне розсіювання живою тканиною, а ОЦА, що надходить у цитоплазму, може зменшити це невідповідність. Однак замість доставки зовнішнього синтетичного ОСА до тканини він може синтезуватися самою клітиною. Виникає запитання: Які ендогенні ОСА використовуються в природі, щоб зробити тканини тварин прозорими (наприклад, прозору тканину ока), і як ми можемо генетично маніпулювати та концентрувати цю речовину в клітині? В даний час більшість опублікованих досліджень намагаються спочатку ідентифікувати природний ОКА та його відповідні гени синтезу, щоб можна було застосувати генетичний підхід, і існує два основних молекулярних класи ендогенних ОКА, які були визначені.
3.2.1. Глікозаміноглікани та антифризні білки в рибі
3.2.2. Кристаліни
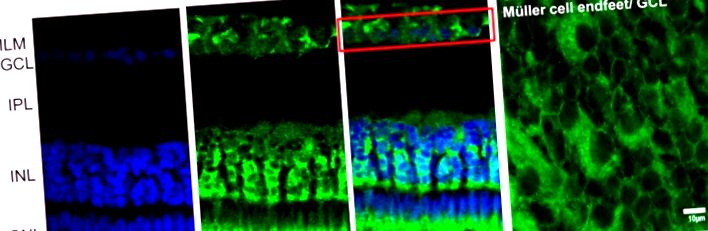
Клітини в оптичному тракті хребетних переважно прозорі. Конкретні маломолекулярні розчинні білки, які називаються кристалінами (завдяки кристалічній лінзі), містяться в особливо великій кількості в цитоплазмі багатьох клітин оптичного тракту хребетних. Велика кількість кристалінів була виявлена в цитоплазмі клітин рогівки як в епітеліальних клітинах рогівки, так і в стромальних кератоцитах (Krishnan et al., 2007; Jester, 2008) [69,70]. Подібним чином кристаліни рясніють у цитоплазмі сильно витягнутих клітин клітковини хребетних кришталиків та клітин епітелію кришталика (Delaye and Tardieu, 1983; Horwitz et al., 1999; Andley et al., 2009) [71,72,73] . У сітківці кристали з молекулярною масою 23 кДа (що відповідає як αA-, так і αB-кристаліну) були описані в клітинах Мюллера жаби (ануран) (Simirskiĭ et al., 2003) [74], і було виявлено αA-кристалін у фоторецепторних клітинах мишей і щурів (Deretic et al., 1994; Maeda et al., 1999) [75,76]. Нещодавно ми описали кристалічний α, а особливо αA-кристалін, всередині клітин Мюллера щурів та фоторецепторів (Zayas-Santiago et al., 2018) [11].
Було показано, що кристаліни важливі для прозорості клітин як рогівки, так і кришталика (Delaye and Tardieu, 1983; Takemoto, Boyle, 1998; Jester, 2008) [70,71,77]. Хімічна або генетична модифікація кристалінів призводить до помутніння, тоді як зменшення розчинних α-кристалінів призводить до катаракти (Datiles et al., 2008) [78]. Подібним чином у рогівці зменшення експресії кристалінів рогівки в стромальних кератоцитах асоціюється із збільшенням розсіювання світла in vitro та in vivo (Jester, 2008) [70]. У кришталику виявлені точкові мутації в генах, що кодують α-, β- та γ-кристаліни, що призводять до розвитку спадкової форми катаракти людини, яка присутня при народженні або розвивається в ранньому віці (Graw, 2009; Andley et al., 2009) [73,79].
Імунолокалізація αA-кристаліну в сітківці Каймана. (A) αA-кристалін (CRYS, зелений) експресується у внутрішньому ядерному шарі (INL), що оточує ядра нейронів (ядерне фарбування DAPI, синій). Кристалін також локалізований в оточуючих ядрах гангліозних клітин (червоний ящик) у шарі клітин гангліїв та у зоні внутрішнього сегмента фоторецепторів. (B) αA-кристалін, що спостерігається зверху тканини цілої сітківки. Кристалін обмежений кінцевими ногами клітин Мюллера в шарі клітин гангліїв (біла стрілка). IPL, внутрішній плексиформний шар; ILM, внутрішня обмежувальна мембрана; GCL, гангліозний клітинний шар; INL, внутрішній ядерний шар; ONL, зовнішній ядерний шар; ІС, внутрішні сегменти фоторецепторів. Шкала шкали в А, 20 мкм і в В, 10 мкм.
Участь αA-кристаліну в прозорості може бути доведена і в мікроорганізмах. Відомо, що мікобактерії можуть мати або прозорий (стаціонарний), або непрозорий (зростаючий) фазний тип клітин, які можуть переходити від одного до іншого без мутації, і цей перехід є чутливим до температури. Прозорий варіант переносить вищі температури зростання і стійкий до більшості терапевтичних засобів. Оскільки, можливо, прозорий варіант є збудником захворювання у людини, важливо розуміти механізм переходу прозорого в непрозоре (Woodley, David, 1976) [89]. α-кристаліни є одночасно білками теплового шоку, що дозволяють клітинам виживати при більш високих температурах, і агентами, що сприяють підвищенню прозорості, і цілком можливо, що кристаліни є причиною переходу прозорого в непрозорий. Відомо, що гомолог α-кристалічного 16-кДа у Mycobacterium є домінуючим білком, що продукується культурами стаціонарної фази in vitro, але його неможливо виявити в логарифмічно зростаючих культурах (Yuan et al., 1998; Stewart et al., 2006) [90,91].
3.2.3. Можливі генетичні маніпуляції, які сприятимуть прозорості та певній перспективі
Використання глікозаміногліканів як генетично маніпульованої ОСА є складним, і їх наслідки не зовсім зрозумілі. З іншого боку, αA-кристалін та його кодуючий ген добре характеризуються. Хоча в даний час активного розвитку в цьому напрямку немає, ми припускаємо, що генетичний підхід має перспективне майбутнє.
Одна складність полягає в тому, що кристаліни виконують інші функції в організмі, наприклад, служать білками теплового шоку та регуляторними білками, і їх надмірну експресію потрібно оптимізувати з урахуванням часу, інтенсивності та специфічності тканини, щоб мінімізувати порушення в розвитку та роботі організму. Підхід до надмірної експресії має давню історію застосування у трансгенних тварин, як надмірна експресія додаткових копій цільового гена, що зберігається під контролем промотора, що реагує на тетрациклін, або шляхом експресії трансактиватора Cas9. Найбільш фізіологічно адекватним варіантом вважається умовна надмірна експресія, яка протікає лише у присутності індуктора і не заважає нормальному розвитку. Таким чином, мутовані тварини нормально розвиваються, прозорість індукується лише перед експериментом, і ступінь прозорості може бути оптимізована для кожного випадку.
Трансактивація експресії генів є можливістю системи редагування генів CRISPR-Cas9 (Perez-Pinera et al., 2013) [92]. Він використовує злиття інактивованого (“мертвого”) Cas9 (який здатний утворювати комплекс лише за допомогою направляючої РНК і зв’язуватися з ціллю, але не може вирізати ціль) та домен активації транскрипції, зазвичай взятий з вірусу ген. Цей підхід має перевагу в експресії ендогенного гена тварини, рівень якого визначається базальним рівнем експресії генів і може регулюватися додаванням доменів активації, злитих з Cas9 (Cheng et al., 2013) [93].
Експериментальний організм, який може бути використаний для цього підходу, - це даніо, який і без того прозорий у вигляді личинок, але не має необхідної прозорості у дорослих через розсіяння світла. Тому мета досягнення прозорості кристаліну у дорослих даніо може бути досягнута двома стратегіями: (1) вставка генів кристаліну під контролем промоторів, що реагують на тетрациклін, і (2) вставка гена трансактиватора Cas9 з кількома генами для одно- направляючі РНК (sgRNAs). Обидва підходи мають свої властиві переваги та недоліки, що може стати перешкодою для стабільного формування клітинної лінії. Більше того, ця робота дозволить порівняти ці підходи, що також зробить її методологічно цінною.
4. Прозорість кісток та інших мінералізованих тканин in vivo
5. Інші моделі прозорості
6. Висновки
Багато дослідників розробили методи, які використовують переваги прозорості тканин in vivo. Звичайна візуалізація in vivo та спектроскопія, запис та стимулювання оптичної нейронної активності, а також оптогенетика отримали переваги від збільшення глибини візуалізації за допомогою різних методів очищення оптичних тканин in vivo. Існує два основних підходи, хімічний (фармакологічний) та генетичний, які зменшують як поглинання світла, так і розсіювання. Сила обох підходів була продемонстрована, але для повного усунення згубної дії штучних ОСА ми пропонуємо, щоб генетична модифікація для отримання модельних організмів з прозорими тканинами представляла майбутнє візуалізації in vivo.
Внески автора
Автори цього огляду брали участь у корчі відповідно до своєї галузі знань: L.Z. та A.Z.-S. — мікроскопія, D.M. — генетика, M.I. - візуалізація.
Фінансування
Це дослідження фінансувалось NIGMS (NIH), номер гранту SC2GM111149 для MI.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів. Фінансисти не мали ролі в розробці дослідження; під час збору, аналізу чи інтерпретації даних; під час написання рукопису або рішення про публікацію результатів.
- Що таке апроксимація м’яких тканин (TORe) та з'єднання WLS; Допомога у відновленні ваги
- Тканинний фактор як предиктор повторної венозної тромбоемболії при аналізі біомаркерів злоякісних пухлин
- Розширювач тканин у Санкт-Петербурзі
- Йо-йо дієта перерозподіляє токсини в тканинах тіла; Калорійний наріз Olestra Plus посилює токсичне виведення -
- Тканинні солі - мікроелементи Nature's Miracle і як ними користуватися! - Feelgood Health