Проникнення та захоплення їжі: Клітинна інвазія Anaplasma phagocytophilum, придбання поживних речовин та перспективні інструменти для їх вивчення
Анотація
Anaplasma phagocytophilum вторгається в нейтрофіли, викликаючи інфекцію, що виникає, гранулоцитарний анаплазмоз людини. Тут ми пропонуємо цілеспрямований огляд взаємодій рецепторів клітини-хазяїна з інвазином A. phagocytophilum, які сприяють проникненню бактерій та шляхам деградації та мембранного руху, які організм використовує для направлення поживних речовин до органели, в якій він мешкає. Оскільки його обов’язкова внутрішньоклітинна природа заважає виконувати підходи до комплементації, ми також обговорюємо сучасні методи, що використовуються для вивчення функції гена A. phagocytophilum, та потенційну вигоду від застосування нових інструментів, які просунуті в дослідженнях інших обов’язкових внутрішньоклітинних бактеріальних патогенів.
ВСТУП
Обов’язкова внутрішньоклітинна природа A. phagocytophilum зумовлена необхідністю паразитувати у поживних речовинах клітини-господаря. Після вторгнення бактерія перебуває у вакуолі клітини-хазяїна, яку вона переробляє в захисну нішу [1]. Мембранний трафік перенаправляється до вакуолі, зайнятої A. phagocytophilum (ApV), щоб доставити життєво важливі поживні речовини та матеріал клітинної мембрани. Цей огляд описує наше сучасне розуміння молекулярних подій, пов’язаних із клітинною інвазією A. phagocytophilum та молекулярним паразитизмом. Ми також обговорюємо проблеми вивчення організму та завершуємо оглядом останніх досягнень генетичних маніпуляцій з іншими облігатними внутрішньоклітинними бактеріями та їх потенційним застосуванням для вивчення A. phagocytophilum.
РОЗБЛОКУВАННЯ ДВЕРЕЙ: клітинна інвазія A. phagocytophilum
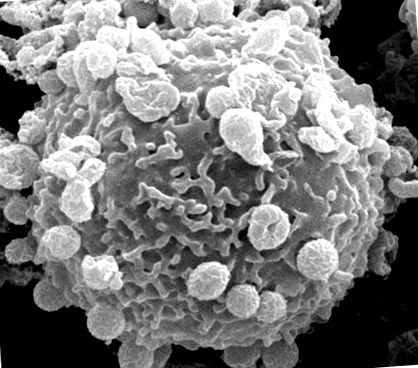
A. phagocytophilum повинен прикріпитися до клітин господаря та потрапити до них, щоб вижити (рис. 1). Цьому процесу сприяють множинні бактеріальні адгезини/інвазини, які спільно розпізнають рецептори клітин господаря та ініціюють сигнальні каскади для сприяння інтерналізації патогенів.
Скануюча електронна мікрофотографія нейтрофілу людини з численними бактеріями A. phagocytophilum, прикріпленими до поверхні клітини хазяїна.
Рецептори клітини-господаря
Адгезія та інвазія A. phagocytophilum також відбувається за допомогою незалежних від PSGL-1 шляхів, які залучають β2 інтегрин та ліпідні плоти. Відмінності у зв’язуванні з рецепторами виникають, коли взаємодія A. phagocytophilum-нейтрофілів досліджується в умовах зсувного потоку, подібних до тих, що знаходяться в кровоносній судині [12]. У той час як збудник взаємодіє виключно з PSGL-1 у статичних умовах [5, 6, 13], він зв'язує як PSGL-1, так і β2 інтегрин під потоком [12]. Ліпідні плоти є важливими сигнальними платформами і містять збагачену кількість глікофосфатидилінозитолу (GPI) -закріплених білків та кавеоліну-1. Для зараження необхідні GPI-прикріплені білки, а кавеолін-1 колокалізується з ранніми вакуолями A. phagocytophilum, припускаючи, що бактерія потрапляє в клітини хазяїна на ліпідних плотах [14]. PSGL-1 міститься у ліпідних плотах, а мобілізація β2 інтегрину в ліпідні плоти пов’язана з бактеріальним патогенезом [15, 16]. Тривале культивування в дефектних клітинних лініях α1,3-фукозилтрансферази та сіалілтрансферази відбирає організми A. phagocytophilum, які більше не покладаються на sLe x, PSGL-1 або Syk для входу [13, 17, 18]. Чи ця збагачена субпопуляція складається з фенотипових або генотипових варіантів, які націлені на β2 інтегрин, ліпідні плоти чи інші рецептори, невідомо.
Поверхневі білки A. phagocytophilum, причетні до інфекції
Asp55, Asp62 та APH1235 - це інші білки A. phagocytophilum, причетні до адгезії та інвазії. Антитіла, специфічні для Asp55 та Asp62, суттєво пригнічують інфекцію A. phagocytophilum клітин-господарів [21]. Оскільки рецептори Asp55 і Asp62 не визначені, важко інтерпретувати, якщо це інгібування є специфічним. APH1235 індукується під час передачі заражених кліщів при передачі та коли неінфекційні бактерії RC переходять в інфекційну форму DC. Повідомлення суперечливі щодо того, чи потрапляє APH1235 на бактеріальну поверхню [22, 23]. Однак розмноження A. phagocytophilum в культурі клітин HL-60 у присутності антитіла APH1235 значно зменшує бактеріальне навантаження [22].
ПОСЛУГА ЗАМОВЛЕННЯ: A. phagocytophilum вибірково направляє деградаційні та мембранні шляхи обігу до своєї вакуолі
Харчова вірулентність, придумана Абу Квайком і Буманом, означає, що "без належних харчових ресурсів для виживання/розповсюдження в хазяїні бактеріальні збудники не викликають хвороби [32]". A. phagocytophilum є ауксотрофним для 16 амінокислот і потребує холестерину для внутрішньоклітинного виживання [33–36]. Він повинен не тільки паразитувати на цих важливих поживних речовинах, але також повинен направляти їх до своєї органели. Серія останніх ключових висновків почала висвітлювати стратегії харчової вірулентності A. phagocytophilum.
Експлуатуюча автофагія
Аутофагія - це процес еукаріотичного клітинного гомеостазу, який перетравлює небажані внутрішньоклітинні предмети, включаючи пошкоджені органели. Він також націлений на внутрішньоклітинні патогени і тому є важливим елементом вродженої імунної відповіді. Формування аутофагосом контролюється послідовним складанням пов’язаних з аутофагією білків (ATG) і ініціюється утворенням комплексу, що включає ATG14 та BECN1 (Beclin 1) [37]. Комплекс сприяє утворенню структури, яка називається омегасомою, з якої фагофор формується для видовження та укладання цитоплазматичного вмісту за допомогою пари убіквітиноподібних систем кон’югації, одна з яких включає білок, LC3 [37, 38].
Останні дані свідчать про участь моно- та поліубіквітінованих білків в аутофагії [41, 42]. Тіла включення, які занадто великі для деградації в протеасомі 26S, є мішенями для селективної аутофагії та містять поліубіквітіновані білки та LC3 [42]. Крім того, було показано, що мічення інтравакуолярних бактерій монубіквітином націлено на бактерії для знищення в аутофагосомі [41], хоча деякі бактерії, такі як Salmonella enterica, підривають цей процес [43]. Цікаво, що, хоча ApV прикрашений LC3, він не прикрашений поліубіквінованими білками. Швидше за все, ApVs забарвлюють позитивний вміст на монубіквітин у ссавців та, в меншій мірі, в клітинах-хазяїнах кліщів. Синтез бактеріального білка De novo має важливе значення для подальшої асоціації монубіквітину з ApV, що припускає, що це процес, опосередкований бактеріями [44]. Моноубіквітіновані білки відіграють різні інші ролі в клітині, включаючи напрямок ендоцитарного руху [45]. Таким чином, чи використовує Ап моноубіквітіновані білки спеціально для допомоги у злитті аутофагосом, залишається невідомим.
Придбання холестерину
Геном A. phagocytophilum не містить генів для синтезу ліпіду А або повного комплементу, необхідного для синтезу пептидоглікану [33, 34]. Таким чином, бактерія стабілізує свою зовнішню мембрану, включаючи холестерин. Відсутність генів, пов’язаних із синтезом або модифікацією холестерину, зобов’язує його викрадати холестерин у господаря ссавців [34]. Дійсно, екзогенний холестерин поглинається бактерією [34], ендогенний синтез холестерину регулюється в інфікованих клітинах, а вільний (нестерифікований) холестерин збагачується в окупованій A. phagocytophilum вакуолі (ApV) [35]. Як екстракція холестерину з мембран безклітинних бактерій господаря за допомогою метил-β-циклодекстрину (MβCD), так і додавання структурного, але погано функціонального похідного холестерину, NBD-холестерину, суттєво знижують інфекційність [34], припускаючи, що холестерин також важливий для вірулентності A. phagocytophilum.
Залежність A. phagocytophilum від холестерину вказує на те, що у пацієнтів з гіперхолестеринемією може спостерігатися більш важка інфекція [48]. Дійсно, дієта з високим рівнем холестерину сприяє збільшенню зараження мишей з дефіцитом аполіпопротеїну Е (апоЕ -/-) [49]. HGA частіше асоціюється із літніми особами, на відміну від середнього віку людей, інфікованих іншими кліщовими патогенами. Люди старшого віку, як правило, мають ослаблену імунну систему та підвищений рівень холестерину в крові. Таким чином, залежність холестерину від A. phagocytophilum може принаймні частково пояснити збільшення середнього віку. Існує припущення, що терапевтичні засоби, спрямовані на зниження рівня холестерину в плазмі крові, можуть допомогти контролювати ГГА у цій популяції [35, 48, 49].
Вибіркове націлювання Rab GTPases
Рапські ГТФази є головними регуляторами мембранної динаміки на органелах. Сім'я Раб складається з майже 70 членів, кожен з яких бере участь у контролі за певним кроком везикулярного транспорту [50, 51]. A. phagocytophilum вибірково націлює підгрупу рапських GTPases на свою вакуолю [52]. Це забезпечує засіб молекулярного камуфляжу і, ймовірно, сприяє забезпеченню бактерією своїх обов’язкових внутрішньоклітинних харчових потреб щодо амінокислот та холестерину. Можливо, він також забезпечує постійне надходження матеріалу мембрани хазяїна, щоб забезпечити розширення вакуолярної мембрани таким чином, щоб вона могла вмістити зростаючу інтравакуолярну бактеріальну популяцію. Rab1, Rab4A, Rab10, Rab11A, Rab14, Rab22A та Rab35 локалізуються в ApV [52] (Таблиця 1). Ці Rabs спрямовують везикулярний рух, пов’язаний з клатрин-залежною ендоцитарною переробкою (Rab4A, Rab35) [53], незалежною від клатрину ендоцитарною переробкою (Rab10, Rab11A, Rab14, Rab22A) [51, 53], ендоплазматичним ретикулумом (ER; Rab1, Rab10 ) [54], а також мережа транс-Гольджі (TGN; Rab10, Rab11A, Rab14, Rab22A) [50, 51, 53]. Це явище зумовлене синтезом бактеріального зародження, що зароджується, і є критичним для ApV, щоб уникнути злиття лізосом [52].
Таблиця 1
Рапські GTP-ази, які вербуються до окупованої вакуолі A. phagocytophilum
- 5 продуктів, які я готую в миттєвому горщику на день приготування їжі, щоб харчуватися здорово і худнути - організуйте
- 5 здорових начинок з рисових тортів Ідеї їжі Luci; s шматочки
- 10 найкращих ідей на вечерю для смачної їжі - їжа NDTV
- 1200 калорій на день для жінок Діабет Великобританія
- Найкраща та найдешевша послуга доставки їжі дешева, але все ж смачна