Промені Стінг: Гострий клітинний ефект впливу іонізуючого випромінювання
Франко
1 Кафедра передових біомедичних наук Неаполітанського університету "Федеріко II", Італія
M Ciccarelli
2 Кафедра медицини та хірургії, Університет Салерно, Італія
D Соррієнто
3 IBB-CNR, Неаполь, Італія
Л Наполітано
1 Кафедра передових біомедичних наук, Неаполітанський університет "Федеріко II", Італія
A Fiordelisi
1 Кафедра передових біомедичних наук Неаполітанського університету "Федеріко II", Італія
Б Тримарко
1 Кафедра передових біомедичних наук Неаполітанського університету "Федеріко II", Італія
М Дюранте
4 Тренто Інститут фундаментальної фізики та прикладних програм, Тренто, Італія
Г Іаккаріно
2 Кафедра медицини та хірургії, Університет Салерно, Італія
Анотація
ВСТУП
Кілька досліджень вказували на вплив опромінення на ендотеліальні клітини судин13–15, проте нещодавно було помічено, що опромінення може також безпосередньо впливати на кардіоміоцити16 та інші серцеві структури, що призводить до кардіоміопатії17, клапанів серця та порушень провідності18. Однак знання про прямий вплив радіації на міокард все ще є низьким, оскільки це пов'язано з впливом на одиничний кардіоміоцит та специфічними молекулярними змінами, що утворюються19. Мітохондрії вважаються рушієм кардіоміоцитів і одночасно є основним джерелом АФК20. Беручи до уваги доцільність мітохондрій для серцевих функцій, можна припустити, що шкідливі наслідки хронічного опромінення можуть бути пов'язані з дисфункцією цієї органели21. У цьому огляді ми обговоримо останні дані про серцеву токсичність, спричинену іонізуючим випромінюванням (рентгенівським випромінюванням) на кардіоміоцитах, з акцентом на роль мітохондрій.
II. ФІЗИЧНІ ТА БІОЛОГІЧНІ ЕФЕКТИ РЕНТГЕНІЇ
А. Фізичні властивості рентгенівських променів
Випромінювання визначається як транспорт енергії в космосі, яка потім передається речовині. Кількісне випромінювання вимірюється в елеттронвольт (еВ). Згідно з електромагнітним спектром випромінювання можна розділити на неіонізуюче випромінювання (10 еВ). Коли випромінювання досягає тіла, воно збуджує атоми молекул біологічних тканин. Що стосується поглиненої дози, біологічні наслідки, спричинені іонізуючим випромінюванням, можуть змінюватися залежно від природи випромінювання22: α-частинка, β-частинка та рентгенівський промінь, де α та β є складовими корпускулярного випромінювання23, тоді як X та Y - електромагнітні радіація. Зокрема, рентгенівські промені класифікуються як електромагнітне, непряме іонізуюче випромінювання, оскільки воно виробляє вторинні електрони з високою кінетичною енергією. Ці електрони в свою чергу можуть спричинити пошкодження поглинаючої речовини. Вакансія електрона в атомній оболонці, спричинена викидом, заповнена електроном із зовнішньої оболонки, що в подальшому призводить до випромінювання фотона. Типовою взаємодією між рентгенівським фотоном і молекулою води є 24:
Де H20 + є високореактивним іонним радикалом. Реакція між H20 + і молекулою води утворює гідроксильний радикал H0 -
Це високоактивний вид кисню, який відповідає за біологічні ефекти рентгенівських променів. Накопичення АФК призводить до апоптотичної загибелі клітин25 і пов'язане з накопиченням пошкоджень, які неможливо відновити в мітохондріях та ядрі. Наприклад, типові ознаки, індуковані випромінюванням, включають Ядро з індукцією точкових мутацій26. Однак, коли апоптотичний процес не усуває трансформовану клітину, цитогенетичні пошкодження, такі як транслокації, переходять до дочірніх клітин27. Таким чином, посилаючись на весь організм, радіаційно-індуковані пошкодження ДНК можуть призвести до раку або спадкових захворювань відповідно до конкретної пошкодженої клітини.
Загалом, рентгенівські біологічні ефекти, як правило, діляться на дві категорії. Перша категорія складається з впливу високих доз радіації протягом коротких періодів часу, що призводить до гострих або короткочасних наслідків28. Друга категорія являє собою вплив низьких доз радіації протягом тривалого періоду часу, що призводить до хронічних або довгострокових наслідків. Високі дози, як правило, вбивають клітини, тоді як низькі дози, як правило, пошкоджують або змінюють функції декількох субструктур. Високі дози можуть вбити стільки клітин, що тканини та органи пошкоджуються або навіть руйнуються29. Це, в свою чергу, спричиняє швидку реакцію всього тіла під назвою гострий радіаційний синдром (ARS).
Низькі дози розподіляються протягом тривалого періоду часу і не викликають негайних та клінічно очевидних проблем. Вплив низьких доз опромінення відбувається переважно на клітинному рівні, і наслідки можуть не спостерігатися протягом багатьох років. Тут ми детально опишемо біологічні ефекти низького та хронічного впливу рентгенівських променів.
B. Ядерні ефекти рентгенівського випромінювання
Існує три загальні категорії ефектів, обумовлених впливом низьких доз радіації. Це: 1) генетичні, коли ефект страждає від нащадків особи, яка зазнала впливу. 2) Somatic30, що включає в першу чергу особу, яка зазнає впливу. Оскільки рак є головним результатом, його також називають канцерогенним ефектом. 3) In-Utero31,32, помилково розглядається як генетичний наслідок радіаційного опромінення, оскільки ефект, який зазнає ембріон/плід, що розвивається, спостерігається після народження.
Як зазначалося вище, рентгенівські промені в основному непрямо іонізуються, оскільки вони безпосередньо не викликають хімічних пошкоджень, а утворюють вторинні електрони з високою кінетичною енергією, такі як водень (H) та гідроксили (OH). Ці фрагменти можуть рекомбінувати або можуть взаємодіяти з іншими фрагментами або іонами, утворюючи сполуки, такі як вода, які не зашкодять клітині. Однак вони також поєднуються з утворенням токсичних речовин, таких як перекис водню (H2O2), які можуть сприяти руйнуванню клітинної структури, вказуючи на те, що частина токсичних ефектів рентгенівських променів опосередковується АФК.
К. Рос у внутрішньоклітинному передаванні сигналів: лише посередник пошкодження, спричиненого рентгенівськими променями?
Генерує градієнти Ph, і
Градієнт напруги, який визначається як потенціал мітохондріальної мембрани.
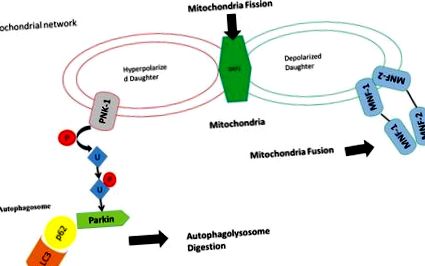
У відповідь на стрес частина мітохондрій втрачає свої мітохондріальні мембрани та індукує Drp-1 (ділення мітохондрій), отже, PINK-1 піддається пошкодженню мітохондрій, і це призводить до деградації мітохондрій через фосфорилювання убиквітінації та активацію убиквітітіна лігази паргін ). Мітохондрії не втратили мембранний потенціал, активує злиття мітохондрій через мітофузин 1, мітофузин 2 та Опа-1 з іншою частиною мітохондрій, яка зберегла свою мембрану потенціалу мітохондрій, утворюючи нові функціональні мітохондрії (злиття мітохондрій).
Разом злиття та розподіл мітохондрій регулює динамізм мітохондрій20, 65 та сприяє виживанню клітин у відповідь на стрес66. Підводячи підсумок, динамізм мітохондрій пов’язаний із структурним перебудовою мережі мітохондрій та гомеостатичним підтримкою стабільності мітохондріальної ДНК та функції дихання, що запобігає або поширює запрограмовану загибель клітин, зокрема у відповідь на стрес67. Поєднані ефекти безперервного злиття та поділу породжують мітохондріальні мережі для збереження функцій органів.
У цьому контексті цікаво представити вплив рентгенівського впливу на функції мітохондрій43. Експозиція рентгенівських променів може безпосередньо пошкодити мембрану мітохондрій68, 69 та/або побічно через збільшення виробництва АФК70. В обох випадках наслідком є зменшення мітохондріальних потенційних мембран і, таким чином, активація процесу поділу/синтезу20. Як описано вище, ці механізми мають фундаментальне значення для виживання клітин та підтримання їх у фізіологічних умовах, тому посилене вироблення АФК, індуковане рентгенівським випромінюванням, може навіть сприяти відновленню мітохондрій71. Однак, коли кількість накопичених АФК, як це відбувається при хронічному впливі до низьких доз рентгенівського випромінювання долає механізми репарації і активує проапоптотичні події та запрограмовану загибель клітин72.
II. Рентгенологічні та серцево-судинні ефекти: роль мітохондрії
Вплив рентгенівського випромінювання на міокард85 менш відомий, але виявляється, що це випромінювання може впливати на функції мітохондрій, що має відповідні наслідки, розглядаючи серце як динамічний орган з великою кількістю мітохондрій86. Отже, пошкодження мітохондрій може бути ключовим для сприяння серцевим змінам, спричиненим хронічним опроміненням87.
Роль мітохондрій у опосередкуванні ефектів рентгенівського випромінювання на виживання клітин частково пов'язана з прямим впливом на зовнішню мітохондріальну мембрану та явищем окисного стресу (рис.2).
Рентгенівські клітинні ефекти, опосередковані ROS. Х-промені на плазматичній мембрані індукують збільшення АФК через активацію NOX1 та (5 ’ліпосигенази). Рентген може спрямовуватися на мітохондрії, що прямо чи опосередковано: за рахунок збільшення виробництва АФК: 1) сполуки дихального ланцюга. 2) мтДНК, що генерує мутацію та делецію дефектних білків до дихального ланцюга. 3) Зміна окисно-відновної сигналізації та дисфункцій мітохондрій, що спричиняє некроз та апоптотичні події. 4) Вивільнення зовнішніх мембран мітохондрій цитокрому С у цитозольні фракції та утворення каналу mPTP для індукції відповідно апоптотичних та некрозових подій.
III. РЕЗЮМЕ І ВИСНОВКИ
Серця, піддані променевій терапії, можуть накопичувати пошкодження мітохондрій, які неможливо відновити за допомогою механізмів мітогенезу та/або контролю якості. Молекулярні механізми, ймовірно, не настільки далекі від того, що спостерігається в інших умовах, коли знижена толерантність до стресу пов'язана з порушенням шляхів, що беруть участь у мережі мітохондрій-ER-ядер, що є фундаментальним для сприяння клітинній адаптації до стресу. Моделі серцевої недостатності після інфаркту міокарда, старіння або діабету112 показали центральну роль дисфункції мітохондрій у прогресуванні захворювання, і пов'язані з цим відкриття ведуть до конкретних підходів, спрямованих на відновлення мітохондріальної динаміки та функцій107. Отже, новим викликом на найближчі роки буде виявлення конкретної ролі, яку відіграє ця органела в серцевих змінах, викликаних рентгенівським стресом, і, отже, розробка нових підходів для посилення та/або збереження мітохондріальних функцій та мережі під час хронічного радіаційний стрес.
- НОВИНКА) Топ-5 найкращих таблеток для схуднення бджіл Побічні ефекти Екстремальна втрата ваги Чоловік на продаж в Інтернеті
- Редуктил - дозування огляду препарату, побічні ефекти, дія, купити Редуктил
- Налтрексон-Бупропіон перорально, побічні ефекти, взаємодії, зображення, попередження; Дозування - WebMD
- Реглалан Застосування, дозування; Побічні ефекти
- Рейкі Промені