Пренатальне та постнатальне материнство за допомогою дамб, що піддаються вихлопу дизеля, по-різному програмує енергетичний обмін мишей
Анотація
Передумови
Ожиріння є однією з провідних загроз світовому громадському здоров'ю. Це є наслідком ненормального енергетичного обміну. В даний час добре встановлено, що вплив матері на навколишні стресові фактори, що спричиняють невідповідний розвиток плода, може мати тривалий негативний вплив на енергетичний метаболізм нащадків залежно від часу впливу, відомого як програмування розвитку парадигми здоров’я та хвороб. Швидко зростаючі докази вказують на те, що вплив матері на навколишні дрібні частинки (РМ2,5) корелює з аномальним розвитком плода. Тому в цьому дослідженні ми оцінили, чи впливає матері на вихлопні гази ТМ2,5 (DEP), основний компонент навколишнього середовища ТМ2,5 в міських районах, програмує енергетичний метаболізм нащадків, і далі вивчав, як час впливу впливає на це програмування.
Результати
Висновок
Пренатальне та постнатальне материнство дамами, що зазнали впливу DEP, по-різному програмує енергетичний метаболізм нащадків, підкреслюючи врахування термінів експозиції при вивченні несприятливих наслідків впливу матері на навколишнє середовище PM2,5.
Передумови
На додаток до періоду гестації, дитинство виявилось вразливим до програм розвитку на основі стресових факторів навколишнього середовища [2]. Крім того, кілька досліджень показали, що терміни впливу стресового фактору навколишнього середовища визначають не тільки ступінь серйозності, але і характер програмування розвитку [2]. Наприклад, вплив матері на голод на ранніх термінах гестації призводить до збільшення індексу маси тіла (ІМТ), тоді як вплив голоду на пізніх термінах вагітності та ранньому дитинстві призводить до зниження ІМТ [21]. Цікаво, що, хоча кілька досліджень продемонстрували несприятливі наслідки для гестаційного впливу ПМ2,5, як уже згадувалося вище, мало досліджень досліджували, чи проводить післяпологове материнство піддані дам ПМ2,5 програми потомства.
З огляду на те, що як забруднення ПМ2,5, так і ожиріння і надалі залишатимуться основними проблемами охорони здоров’я в осяжному майбутньому, необхідні додаткові дослідження, щоб задокументувати програму розвитку енергетичного обміну шляхом впливу на організм ПМ2,5 матері та його залежність від часу. Отже, у цьому дослідженні ми дослідили довгострокові ефекти пренатального та постнатального материнства підданими дамбам дизельного вихлопу PM2.5 (DEP) на розвиток потомства та енергетичний обмін. Наші результати несподівано показали різне програмування розвитку енергетичного обміну шляхом пренатального та постнатального материнства матерів, що зазнали впливу ДЕП, і, таким чином, не тільки викликало більше занепокоєння щодо здоров'я з боку матері PM2,5, але також підкреслило врахування часу впливу під час вивчення наслідків для здоров'я. впливу матері на забруднювачі повітря.
Методи
Тварини
Університет штату Меріленд, Балтимор (UMB) - це акредитована установа AAALAC. Усі процедури цього дослідження були схвалені Інституційним комітетом з догляду та використання тварин (IACUC) при UMB, і з усіма тваринами поводились гуманно та з огляду на полегшення страждань. Мишей C57Bl/6j (4-тижневі, 12 самців і 12 самок) було придбано в лабораторіях Джексона (сток # 000664) і розміщено в приміщеннях для тварин в UMB, які підтримували 12-годинне світло/12-годинне темне світло циклу та температури та вологості в рекомендованих межах. Клітини для розведення були встановлені з одним самцем та однією самкою у віці 12 тижнів. Нащадків відлучували, коли їм виповнилося 3 тижні.
Інтратрахеальна інстиляція материнської ДЕП
Аналіз траєкторії зростання потомства та споживання їжі
Ваги тіла нащадків вимірювали щотижня від народження до 16 тижнів. Оцінку споживання їжі проводили у віці 18–20 тижнів. Коротко кажучи, кожна миша була розміщена в одній нормальній клітці, і вага дієти реєструвалася щодня протягом 7 днів поспіль. Споживання їжі розраховували як різницю між двома днями поспіль. Було представлено середнє споживання їжі за останні п’ять днів. Всі нащадки були евтаназовані у віці 20–22 тижнів.
Гістологічний аналіз
Епідидимальна жирова тканина та коричнева жирова тканина (BAT) фіксували у 4% параформальдегіді, вкладали у парафін, розрізали на ділянки 5 мкм та фарбували гематоксиліном та еозином. Гістологічні зрізи переглядали зі збільшенням 20 ×, і зображення отримували цифровою камерою SPOT (Diagnostic Instruments, Sterling Heights, MI) однією людиною, яка була сліпа для групування. Загальну кількість і площу поперечного перерізу адипоцитів в жирових тканинах епідидиму розраховували, як описано раніше. Площі крапель жиру БАТ отримували за допомогою програмного забезпечення Imagej, і результати виражали як відсоток від загальної площі.
RT-PCR у реальному часі
Загальну РНК виділяли з тканин (епідидимальна жирова тканина та гіпоталамус) реагентом TRIzol (Invitrogen, Карлсбад, Каліфорнія, США). Загальна РНК 2 мкг була транскрибована за допомогою випадкових гексамерів та системи RT-PCR ThermoScript (Invitrogen). Кількісну RT-PCR проводили з Stratagene Mx3005, використовуючи SYBER Green PCR Master Mix (Applied Biosystems, Carlsbad, CA, USA). Послідовності праймерів були представлені в таблиці 1. Рівень відносної експресії був отриманий, як описано раніше [24]. Коротко, значення Ct були ознайомлені шляхом аналізу із програмним забезпеченням, що постачається виробником, і були розраховані відмінності значення Ct між цільовим геном та GAPDH (∆Ct), а потім 2 ∆Ct.
Збирання тканин, вестерн-блот і оцінка білка лептину
Тварин голодували протягом ночі, і внутрішньовенно. вводять інсулін (10 ОД/кг маси тіла). Через 20 хв тварин евтаназували передозуванням ізофлурану. Кров відбирали з серця і центрифугували при 3000 об/хв протягом 5 хв. Плазму негайно зберігали в сухому льоду, а потім −80 ° C. Гіпоталамус виділяли, як описано раніше [25], а потім швидко заморожували у рідкому азоті. Всі тканини зберігали при -80 ° C до подальшої обробки. Лізати коричневої жирової тканини готували з використанням буфера RIPA (Sigma, Сент-Луїс, Міссурі) з доповненням інгібіторами протеази та фосфатази (Sigma, St. Louis, MO). Потім зразки білка розділяли електрофорезом у 10% SDS-поліакриламідному гелі та електроблотували на мембрани з фтористим полівінілідену. Білок-мішень був виявлений кроликом UCP1 (Бостер, Каліфорнія). Для візуалізації цільових білків використовували вторинні антитіла, кон'юговані з пероксидазою хрону та реагентом хемілюмінесценції (Amersham, Marlborough, MA). Щільність цільових білкових смуг визначали за допомогою Quantity One 4.4.1 (Bio-Rad, Hercules, CA). Внутрішній контроль, β-актин, використовувався для нормалізації змін навантаження.
Для оцінки експресії білка лептину в жировій тканині лізати готували з епідидимальної жирової тканини з використанням буфера RIPA (Sigma, Сент-Луїс, Місури) з доповненням інгібіторами протеази та фосфатази (Sigma, Сент-Луїс, Місурі) та рівня їх білка лептину оцінювали за допомогою набору ELISA (RayBio Mouse Leptin ELISA Kit, RayBiotech) відповідно до вказівок виробника. Результати нормалізували за концентрацією загальних білків і представляли як відсоток рівня в групі VV.
Статистика
Усі дані виражаються як середні значення ± SEM, якщо не зазначено інше. Статистичні тести проводили з використанням одностороннього або двостороннього дисперсійного аналізу (ANOVA) з подальшою корекцією Бонферроні або неспареного т-тест за допомогою GraphPad Prism (версія 5; Програмне забезпечення GraphPad, La Jolla, Каліфорнія, США). Рівень значущості був встановлений на рівні стор
Результати
Програмування диференціального розвитку шляхом пренатального та постнатального материнства дамб, що зазнали впливу DEP
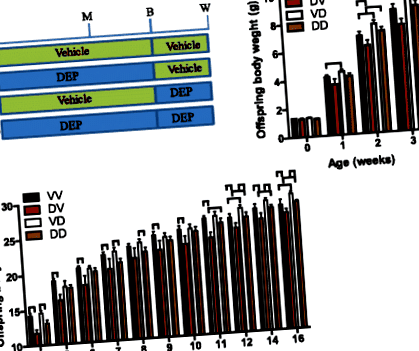
Для документування довгострокових наслідків впливу на організм дітей DEP для матері на розвиток потомства, дамб (самок мишей C57/Bl6j) обробляли DEP або носієм з віку 5 тижнів до відлучення потомства. Таблиця 2 показує, що цей вплив ДЕП не суттєво змінив масу тіла дамб. Оскільки виявилось, що як пренатальний, так і постнатальний періоди є вразливими до програмування розвитку [2], і однією з головних цілей цього дослідження є визначення вікна програмування розвитку шляхом впливу на організм матерів з боку ДЕП, половина потомства переключалася між і дамби, що зазнали впливу DEP, колись народилися Таким чином, загалом було чотири групи потомства (рис. 1а): VV, потомство дамб, оброблених транспортним засобом, постнатально завалених дамбами, обробленими транспортними засобами; DV, потомство дам, оброблених DEP, післяпологово пошкоджених греблями, обробленими транспортними засобами; VD, потомство дамб, оброблених автотранспортом, післяпологово забруднених дамбами, обробленими DEP; ДД, потомство дам, оброблених DEP, постнатально пошкоджених дамбами, обробленими DEP. Порівняння ВВ з ДВ та ВД з ДД відображали наслідки пренатального материнства дамами, що зазнали впливу ДЕП, тоді як порівняння ВВ з ВД та ДВ з ДД виявили наслідки постнатального материнства від дам, що зазнали впливу ДЕП.
Органоспецифічні наслідки пренатального та постнатального материнства дамами, що зазнали впливу DEP
Для подальшого документування наслідків розвитку пренатального та постнатального материнства дамами, що зазнали впливу DEP, ми вимірювали вагу основних органів/тканин потомства у віці 22 тижнів. Малюнок 2b-f показує, що ні пренатальне, ні постнатальне материнство дамами, що зазнали впливу DEP, не впливали на вагу легенів, серця, печінки, нирок та яєчок у дорослих нащадків. Малюнок 2g показує, що післяпологове материнство дамами, що зазнали впливу DEP, значно зменшило вагу селезінки у дорослих нащадків. Тоді як це суттєво збільшило масу коричневої жирової тканини (BAT, рис. 2h), епідидимальної жирової тканини (рис. 2i) та надниркової жирової тканини (рис. 2j). Це також призвело до тенденції збільшення маси підшкірної жирової тканини (рис. 2к). На відміну від цього, допологове материнство дамами, що зазнали впливу DEP, суттєво зменшило масу НДТ, суттєво збільшило масу жирової тканини епідидиму і не суттєво змінило вагу будь-якого іншого перевіреного органу/тканини.
Жирові ефекти пренатального та постнатального материнства дамами, що зазнали впливу DEP
Пренатальне, але не післяпологове материнство дамами, що потрапляють під вплив DEP, зменшує споживання їжі потомством
Постнатальне, але не внутрішньоутробне материнство дамами, що піддаються впливу DEP, збільшує відбілювання НДТ потомства
BAT - це ключова термогенна тканина, яка регулює витрату енергії. Як показано на рис. 2g, допологове материнство дамами, що зазнали впливу DEP, суттєво зменшило масу НДТ, тоді як постнатальне материнство дамами, що зазнали впливу DEP, збільшило масу BAT. Дослідження показали, що, крім своєї маси, рівень “відбілювання” НДТ, що характеризується накопиченням великих крапель ліпідів та дисфункцією мітохондрій, відображає зменшення витрат енергії. Малюнки 5a та b демонструють, що післяпологове материнство дамами, що зазнали впливу DEP, помітно збільшило розмір крапель ліпідів (рис. 5a), а також загальне накопичення крапель ліпідів у BAT (рис. 5b). Відповідно до морфологічних змін, постнатальне материнство дамами, що зазнали впливу DEP, суттєво знизило рівень білка UCP1, первинного мітохондріального роз’єднуючого білка BAT. На відміну від цього, допологове материнство дамами, що зазнали впливу DEP, не змінило ні накопичення крапель ліпідів, ні експресію UCP1 у НДН.
Обговорення
Основні висновки цього дослідження включають, що 1) як пренатальне, так і постнатальне материнство за допомогою дамб, що піддаються впливу DEP, проводять енергетичний метаболізм потомства; 2) програмування ними енергетичного обміну, однак, суттєво різне: в той час як пренатальне материнське становище, яке потрапляє під вплив DEP, призводить до втрати ваги, постнатальне материнське життя, яке проводиться під дією DEP, призводить до збільшення ваги; 3) пренатальне материнське втручання, яке потрапило під вплив DEP, конкретно збільшило масу епідидимальної жирової тканини через гіперплазію, тоді як постнатальне материнське становище, піддане впливу DEP, збільшило масу всіх перевірених жирових прокладок через гіпертрофію; 4) у той час як пренатальне материнство за допомогою дам, що піддаються DEP, програмує енергетичний баланс нащадків, головним чином, за рахунок зменшення споживання їжі, постнатальне материнство за допомогою дам, що піддаються DEP, впливає на енергетичний баланс потомства, головним чином, через індукцію відбілювання BAT.
Аномальний енергетичний обмін займає центральне місце в патогенезі численних захворювань, таких як ожиріння, діабет та рак. Встановлено, що вплив забруднення навколишнім середовищем PM2,5 спричиняє різноманітні відхилення в енергетичному обміні, які можуть сприяти патогенезу кардіометаболічних захворювань [26]. Дане дослідження надалі показує, що вплив матері на вплив ДЕП спричиняє помітні довгострокові наслідки на енергетичний метаболізм потомства шляхом залежності від часу впливу. Оскільки DEP є важливою складовою частинок навколишнього середовища PM2,5 у багатьох міських районах, таких як Нью-Йорк [27], ці дані, таким чином, помітно розширюють наше розуміння ефектів метаболізму енергії, спричинених забрудненням навколишнього середовища, але також провокують занепокоєння для здоров'я людей, що переживають покоління, через вплив матері на забруднення навколишнього середовища.
У цьому дослідженні ми демонструємо, що вплив ДЕП, що охоплює 7-тижневий період до зачаття, і весь термін вагітності не суттєво змінили масу тіла при народженні потомства, але призвели до втрати ваги, яка спостерігалася вже через два тижні після народження. Це ідеально повторює попереднє дослідження впливу на вдихання за допомогою DEP з того самого джерела [28], підтверджуючи наш метод впливу при оцінці токсичності DEP. Однак ці дані суперечать іншому дослідженню впливу на вдихання, яке показало, що гестаційний вплив ДЕП зменшує масу тіла народжених дітей [13]. Примітно, що DEP, що використовується в останньому, походить з іншого джерела, що припускає, що склад DEP може відігравати вирішальну роль у визначенні його впливу на потомство.
Наскільки нам відомо, це дослідження є першим, що забезпечує траєкторію росту від народження до дорослого потомства, пошкодженого дамбами, що піддаються впливу DEP. Розширюючи попередні знання [28], траєкторія росту показує, що вплив маси тіла на вплив ДЕП на масу тіла є тривалим. Це цілком узгоджується з парадигмою DOHaD [2]. Затримка між експозицією та захворюванням/дисфункцією - ще одна важлива складова парадигми DOHaD. За погодженням з парадигмою DOHaD, це дослідження показує очевидну латентність між впливом DEP на матері та різноманітними метаболічними відхиленнями у потомства. Таким чином, наші дані підтверджують, що вплив матері на організм ДЕП є фактором, що впливає на навколишнє середовище для програмування розвитку кардіометаболічних захворювань, викликаючи більш серйозні занепокоєння щодо його наслідків для поколінь.
Наявні дані показують, що пренатальний вплив DEP на матері зменшив споживання їжі, але не відбілювання НДТ, що супроводжується зниженою експресією гіпоталамусу орексигенного нейропептиду NPY, що свідчить про те, що пренатальне вплив матері на DEP може в першу чергу програмувати споживання енергії. Ці дані узгоджуються з численними дослідженнями, які показують, що вплив матері на вплив навколишнього середовища надає тривалий вплив метаболізму енергії на потомство шляхом програмування гіпоталамусових ланцюгів, що регулюють енергетичний баланс [21]. Подальші дослідження проводяться з метою виявлення структурних та/або функціональних змін у гіпоталамусі, які можуть пояснювати зменшення експресії NPY та споживання їжі.
Особливо примітно, що хоча пренатальний вплив ДЕП на матері зменшував масу тіла нащадків, це парадоксально збільшувало масу жирової тканини епідидиму. Ці дані якимось чином узгоджуються з дослідженнями відслідковування ліній, що показують, що група попередників білих адипоцитів мишей в основному здійснюється пренатально або безпосередньо після народження [30], і, отже, вимагають проведення додаткових досліджень для вивчення природи образи попередників адипоцитів, спричиненої пренатальним впливом матері ДЕП. Цікаво, що це дослідження також демонструє, що жировий ефект пренатального впливу ДЕП на материнські організми виявився специфічним для епідидимальної жирової тканини. Це нагадує про неоднорідність походження адипоцитів у розвитку [31], надаючи ще один доказ того, що пренатальне вплив ДЕП на матері може пошкодити ранній процес адипогенезу.
Оскільки гіпертрофії не спостерігалось, ця збільшена маса жирової тканини епідидиму, як видається, зумовлена в першу чергу гіперплазією. Показано, що кількість адипоцитів тварин збільшується в період статевого дозрівання, але є відносно стабільним у зрілій жировій подушці [32, 33]. На сьогоднішній день, як регулюється кількість адипоцитів у зрілій жировій подушці, ще не до кінця зрозуміло. Таким чином, демонстрація гіпертонії жирової тканини, викликаної експозицією DEP, у дорослих нащадків забезпечує цінну модель для досліджень того, як регулюється кількість адипоцитів у зрілій жировій подушці.
Крім того, наявні дані показують, що післяпологове материнство дамами, що зазнали впливу ДЕП, збільшує ожиріння потомства, що, в основному, є наслідком гіпертрофії. Примітно, що гіпертрофія жирової тканини супроводжується зниженою експресією кількох маркерів адипогенезу. Це цілком узгоджується з попередніми дослідженнями, які показали, що дієтичне лікування з високим вмістом жиру викликає гіпертрофію жирової тканини і тим часом зменшує експресію маркерів адипогенезу [37]. Ці дані в сукупності дозволяють припустити, що знижена експресія маркерів адипогенезу може бути наслідком, але не причиною гіпертрофії. Тому, як і раніше, необхідні додаткові дослідження, щоб окреслити механізми цієї індукції гіпертрофії жирової тканини післяпологовим материнством від дам, що піддаються впливу DEP.
Висновок
На закінчення, це дослідження демонструє залежність часу від програмування розвитку шляхом материнства дамб, що зазнають впливу DEP. Ці різні довгострокові наслідки пренатального та постнатального материнства підданими впливу DEP дамами підкреслюють врахування термінів опромінення при вивченні несприятливих наслідків впливу матері на навколишнє середовище PM2,5.
- OCD під час пренатального або постнатального періоду OCD-UK
- Постнатальна дієта та вправи Інтернет-курс Trendimi
- Інтернет-дієти та фізичні вправи після пологів (курс майбутньої мами) - сертифікований CPD
- Справжня їжа для вагітності Наука та мудрість оптимального внутрішньоутробного харчування Лілі Ніколс
- Постнатальний ПТСР або родова травма; Новини-Медичні