Поза роллю дієтичних білків та амінокислот у профілактиці ожиріння, спричиненого дієтою
Анотація
Показано, що дієти з високим вмістом білка запобігають розвитку ожиріння, спричиненого дієтою, і можуть покращити пов'язані з цим метаболічні порушення у мишей. Дієтичні добавки лейцину можуть частково імітувати цей ефект. Однак молекулярні механізми, що викликають ці профілактичні ефекти, ще потребують задовільного пояснення. Тут ми розглядаємо дослідження, що показують зв’язок між споживанням великої кількості білка або загального амінозою азоту та обов’язковим споживанням води. Високе споживання азоту амінокислотами може зменшити зберігання ліпідів і запобігти резистентності до інсуліну. Висловлюються пропозиції щодо подальших систематичних досліджень з метою вивчення взаємозв’язку між споживанням води, насиченням та витратами енергії. Більше того, ці обстеження повинні краще розрізняти лейцин-специфічні та неспецифічні ефекти. Дослідження в цій галузі можуть надати важливу інформацію для обґрунтування дієтичних рекомендацій та стратегій сприяння довгостроковій втраті ваги та можуть допомогти зменшити проблеми зі здоров’ям, пов’язані із супутніми захворюваннями ожиріння.
1. Вступ
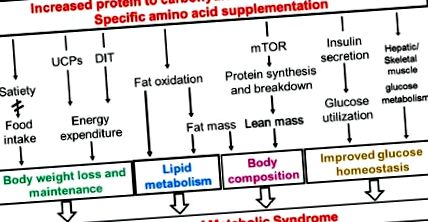
Епідемічний вимір поширеності ожиріння та пов'язаних з ним розладів представляє все більшу проблему як у розвинутих, так і в країнах, що розвиваються [1]. Тому важко знайти ефективні методи лікування та профілактичні стратегії зменшення надмірної ваги. Одним з дієтичних підходів є вживання високобілкової дієти, яка може сприяти зниженню ваги та підтримці ваги у тварин і людей. Крім того, дієти з високим вмістом білка можуть покращити гомеостаз глюкози, збільшити витрати енергії (ЕЕ), можуть знизити рівень ліпідів у крові, можуть знизити кров’яний тиск та зберегти м’язову масу [2–7]. Подібні ефекти були продемонстровані на мишах, коли співвідношення білка до вуглеводів у дієті з високим вмістом жиру було збільшено [8–11]. Крім того, дієтичні добавки функціонально різних одиничних амінокислот, включаючи аргінін, глутамін, гліцин та лейцин, можуть покращити метаболізм глюкози та ліпідів [12–18]. Однак основні механізми цих сприятливих ефектів не до кінця зрозумілі, і вони є предметом суперечок (узагальнено на рисунку 1).
Спрощена схема можливих механізмів сприятливого впливу дієтичного білка на метаболічний синдром. UCP, роз’єднуючий білок; DIT, індукований дієтою термогенез; mTOR, мішень для ссавців рапаміцину.
2. Амінокислоти та сигналізація про інсулін
3. Вага тіла та склад тіла
Ми показали, що індуковане дієтою з високим вмістом жиру накопичення жиру в організмі може бути зменшено одночасним введенням високого вмісту білка та лейцину, як у короткостроковій, так і в довгостроковій перспективі (рис. 2). Цікаво, що добавки еквімоларів аланіном зменшували приріст маси тіла в короткостроковому експерименті, подібно до лейцину, порівняно з мишами, що годували АП, хоча метаболічні функції обох амінокислот досить різні [8,19].
(A) Тривале накопичення жиру в організмі. Десяти тижнів самців мишей C57BL/6 годували протягом 20 тижнів ad libitum експериментальними напівсинтетичними дієтами з високим вмістом жиру (20% мас./Жиру), що містять різні концентрації білка та лейцину. AP, адекватний білок (10% мас./Мас. Сироваткового білка); HP, високобілковий (50% мас./Сироваткового білка); AP + L, AP, доповнений l-лейцином, що відповідає HP (+ 6% l-лейцину) [8]; (B) Короткочасне збільшення маси жиру в організмі. Десятитижневих самців мишей C57BL/6 годували протягом 7 днів ad libitum експериментальними напівсинтетичними дієтами з високим вмістом жиру (20% мас./Жиру), що містять різні концентрації білка, лейцину та аланіну. AP, адекватний білок (10% мас./Мас. Сироваткового білка); HP, високобілковий (50% мас./Сироваткового білка); AP + L, AP, доповнений l-лейцином, що відповідає HP (+ 6% мас./Мас. L-лейцину, 0,572 моль); AP + A, AP, доповнений еквімолярним l -аланіном (+ 4,5% мас./Мас. L -аланіну, 0,572 моль). Дані є середніми ± SEM, n = 9–10 [19].
Хронічний вплив НР також збільшував худою масу тіла, тоді як вага м. квадрицепси були вищими як в HP, так і в AP + L в довгострокових експериментах. Це можна пояснити позитивним балансом білка скелетних м’язів. Дійсно, ми підозрювали збільшення швидкості синтезу білка скелетних м’язів через більш високе включення 15 N-лізину після тривалого впливу HP та AP + L [8]. На противагу цьому, інші дослідження не виявили збільшення маси скелетних м’язів шляхом тривалого прийому лейцину у людей та щурів [31,44]. Амінокислоти з розгалуженими ланцюгами та, зокрема, лейцин, пропонують регулювати синтез м’язового білка шляхом активації шляху mTOR і тим самим стимулювати синтез білка на поступальному рівні [27,30,59]. Однак ми не знайшли жодних доказів активації mTOR або його подальших мішеней (таких як eIF4E-зв'язуючий білок 1 (4E-BP1) та рибосомний білок S6 (rS6-P) у скелетних м'язах у наших експериментах ([8,19 ]). Це на відміну від інших публікацій, що наголошують на ролі лейцину як потужного активатора шляху mTOR, що може бути обумовлено різницею видів або різними експериментальними установками [27,30,60,61].
Отже, ми припускаємо, що в якості альтернативи інший механізм може сприяти довгостроковій регуляції маси скелетних м’язів за допомогою харчових білків і лейцину. У цьому контексті повідомлялося про депресію деградації білка після прийому лейцину [62–65]. Запропоновано пригнічення лейцином убіквітин-протеасоми [66,67] або систем аутофагії-лізосоми [68], щоб викликати пригнічення розпаду м’язового білка. Однак антипротеолітичні функції лейцину менш задокументовані, ніж вплив на синтез м'язового білка, що заслуговує на подальше дослідження.
4. Забір енергії та води
Більш високий ситний ефект дієтичного білка вважався основною причиною втрати ваги, спричиненої дієтами з високим вмістом білка [7,69]. Це узгоджується з дослідженнями людини, які не показали змін у БТ після ізоенергетичного споживання дієт з високим вмістом білків та вуглеводів [70–73]. Отже, припускали, що зменшене споживання енергії, а не склад макроелементів, ймовірно, матиме вирішальне значення для втрати БТ після гіпокалорійних дієт [71,72,74,75]. Вище насичення після дієт з високим вмістом білка може також призвести до поліпшення підтримки ваги завдяки кращому прийняттю та дотриманню порівняно з їжею з низьким вмістом білка [76]. Наші експерименти з мишами проводили в умовах ad libitum і продемонстрували суттєво зменшення споживання їжі HP та AP + L порівняно з контролем, що піддався AP, з сильною кореляцією споживання енергії з приростом BW [8,19]. Також було показано, що дієти з високим вмістом білка запобігають початковій гіперфагії, спричиненій годуванням з високим вмістом жиру, і, отже, можуть затримати розвиток ожиріння [9]. Це було підтверджено в короткостроковому дослідженні [19], яке показало, що на прийом дієти з високим вмістом жиру гостро впливав прийом препаратів НР із суттєвими ефектами, очевидними вже через п’ять годин після зміни дієти (Рисунок 3).
Прийом їжі. Десяти тижнів самців мишей C57BL/6 годували протягом семи днів ad libitum експериментальними напівсинтетичними дієтами з високим вмістом жиру (20% мас./Жиру), що містять різні концентрації білка, лейцину та аланіну. AP, адекватний білок (10% мас./Мас. Сироваткового білка); HP, високобілковий (50% мас./Сироваткового білка); Leu, AP, доповнений l-лейцином, що відповідає HP (+ 6% мас./Мас. L-лейцину, 0,572 моль); Ala, AP, доповнений еквімолярним l -аланіном (+ 4,5% мас./Мас. L -аланіну, 0,572 моль). (A) Сукупне споживання їжі протягом усього випробування годування; (B) Прийом їжі в перший день дієтичного втручання. Значення є середніми ± SEM. Затінена зона відноситься до нічного (вимкненого) періоду. Зірочки вказують на суттєві відмінності від AP (** p Рисунок 4), тому що ми підозрювали роль споживання води для ситості та BW (огляд див. [78]). Дослідження на людях показали, що вживання води може збільшити ситість, зменшити споживання енергії та спричинити втрату ваги [79–81]. Ми спостерігали майже подвоєне споживання води мишами, котрі харчувались дієтою НР, порівняно з групою АР [19]. Хоча збільшення споживання води групами, що отримували лейцин або аланін, не досягло статистичної значущості, загальне споживання води суттєво корелювало з споживанням амінокислот в їжі та негативно корелювало з споживанням енергії у всіх групах (рис. 4). Подібне збільшення споживання води спостерігали у жирних мишей з високим вмістом жиру, які отримували сироватковий білок з добавкою у питну воду, що призводило до 78% більших рівнів споживання білка порівняно з недоповненими контролями [10]. Цілком можливо, що цей ефект пов'язаний з виробленням сечовини, яка збільшується паралельно з рівнем введеного в організм білка або амінокислоти азоту для обробки надлишку споживаних амінокислот [82,83].
Вживання води. Десяти тижнів самців мишей C57BL/6 годували протягом семи днів ad libitum експериментальними напівсинтетичними дієтами з високим вмістом жиру (20% мас./Жиру), що містять різні концентрації білка, лейцину та аланіну. AP, адекватний білок (10% мас./Мас. Сироваткового білка); HP, високобілковий (50% мас./Сироваткового білка); Leu, AP, доповнений l-лейцином, що відповідає HP (+ 6% мас./Мас. L-лейцину, 0,572 моль); Ala, AP, доповнений еквімолярним l -аланіном (+ 4,5% мас./Мас. L -аланіну, 0,572 моль). (A) Вживання води в перший день дієтичного втручання; (B) Співвідношення споживання води з споживанням азоту; (C.) Кореляція споживання води з енергоспоживанням. Значення в (B) та (C.) означають ± SEM (** p Рисунок 5, [8]). Значно нижчі концентрації триацилгліцерину в печінці також спостерігалися у мишей лише через тиждень дієтичного харчування під час дієти HP. У короткостроковій перспективі добавки лейцину або аланіну (поки) не виявляли такого значного впливу на жир печінки [19]. Хоча приріст маси жиру в цих дослідженнях сильно корелював із споживанням енергії, лише близько 77% збільшення жиру в організмі можна пояснити споживанням енергії. Менше вмісту печінкового жиру також було виявлено у мишей, які годувались сироватковим білком з високим вмістом жиру, порівняно з контролем без суттєвих відмінностей у загальному споживанні енергії. [10] Зниження ефективності годування та модифікація витрат енергії та споживання кисню після дієти з високим вмістом білка може вказувати на механізми, що призводять до негативного енергетичного та жирового балансу [10,89,90].
Таблиця 1.
Відносний рівень експресії генів білків печінки та білої жирової тканини у самців мишей C57BL/6 десяти тижнів, яких годували різними дієтами з адекватною (AP), високою (HP) або адекватною концентрацією білка, доповненою l -аланіном (AP + A) або l-лейцин (AP + L) протягом одного тижня [19] 1, 2 .
Крім того, було показано, що підвищене поглинання жирних кислот за рахунок більш високих рівнів експресії білків транспорту ліпідів, таких як транслоказа жирних кислот (CD36) та білок, що зв’язує жирні кислоти печінкового типу (l -FABP), може бути більш важливим для відкладення жиру в печінки, ніж зміни у новому ліпогенезі чи окисленні жиру [93]. Отже, зменшене накопичення печінкових ліпідів у мишей, що піддаються HP і AP + L, може бути наслідком зменшення споживання жирних кислот через зниження рівня білка CD36. Це спостерігалося після тривалого годування HP, а також AP + L [8]. На відміну від цього, білок CD36, а також рівень його мРНК не змінювались у печінці мишей, які харчувались дієтами HP, AP + A або AP + L протягом лише одного тижня (таблиця 1). Концентрація триацилгліцерину в печінці суттєво не відрізнялася між групами, що містять амінокислоти, та контрольованими АР через тиждень. Однак ми не можемо виключити вплив дієтичних амінокислот на поглинання жирних кислот у печінці, оскільки мРНК l -FABP була значно знижена у всіх групах втручання порівняно з АР (табл. 1). Цікаво, що годування НР стимулює базальний ліполіз білого жиру, на що вказує підвищена експресія гена жирової триацилгліцеринової ліпази (ATGL) через один і 20 тижнів годування з високим вмістом жиру ([8]; Таблиця 1).
Однак цього не спостерігалося в групах AP + L та AP + A (таблиця 1), що знову ж може бути пов'язано з меншим споживанням вуглеводів у групі HP. Отже, вплив білка та добавки лейцину змогли запобігти гепатостеатозу у мишей, можливо, завдяки різним механізмам. Вплив HP на ліпогенез печінки та ліполіз жирової тканини може бути головним чином обумовлений меншим споживанням вуглеводів, тоді як на вплив на поглинання жирних кислот у печінці також можуть впливати одноразові добавки амінокислот.
Альтернативні механізми профілактики гепатостеатозу досі недостатньо вивчені, зокрема в контексті сприятливих ефектів дієт з високим вмістом білка. Тому необхідні більш детальні дослідження змін експресії та регуляції ключових ферментів та транскрипційних ко-факторів, що контролюють печінковий ліпідний та енергетичний обмін.
7. Специфіка спостережуваних лейцинових ефектів
8. Метаболічні наслідки збільшення надходження води у відповідь на дієти з високим вмістом білка
9. Висновки
Подяка
Цю роботу підтримав Deutsche Forschungsgemeinschaft, Бонн, Німеччина (номер контракту/гранту: PE 643/7-1). Фінансисти не брали участі у прийнятті рішення про публікацію та підготовці рукопису.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Крім індексу маси тіла - Прентис - 2001 - Огляди ожиріння - Інтернет-бібліотека Wiley
- Купуйте дієтичні повноцінні харчові концентрати для схуднення HealthBeyondHype; Здоров’я поза Hype Shop
- АМІНОКОР BCAA АМІНОКИСЛОТИ Чому його слід використовувати цілий рік
- Амінокислоти - список торгових марок від
- Придбайте CORTEXIN, Amino Acids Vitamins Minerals, 10vialspack, 10mg (5ml) флакон