Потенційний зв’язок між фосфатом та старінням - уроки від мишей з дефіцитом Клото
Макото Куро-о
Кафедра патології Південно-західного медичного центру Техаського університету в Далласі, бул. Гаррі Хайнс, 5323, Даллас, Техас 75390-9072, телефон: (214) 648-4018, факс: (214) 648-4070
Анотація
Гомеостаз фосфатів підтримується головним чином кістково-нирковою ендокринною віссю. Коли фосфату надлишковий, фактор росту фібробластів-23 (FGF23) виділяється з кісток і діє на нирки, сприяючи виведенню фосфатів із сечею. FGF23 також знижує рівень вітаміну D у сироватці для придушення всмоктування фосфатів з кишечника. Таким чином, FGF23 функціонує як гормон, який індукує негативний фосфатний баланс. Однією з найважливіших особливостей FGF23 є те, що він вимагає Klotho, однопрохідний трансмембранний білок, що експресується в ниркових канальцях, як зв'язуючий ко-рецептор для зв'язування та активації споріднених рецепторів FGF. Важливо, що дефекти або FGF23, або Klotho не лише спричиняють затримку фосфату, а й синдром передчасного старіння у мишей, який можна врятувати шляхом вирішення гіперфосфатемії. Крім того, зміни концентрації позаклітинного та внутрішньоклітинного фосфатів впливають на метаболізм глюкози, чутливість до інсуліну та окислювальний стрес in vivo та in vitro, що потенційно може вплинути на процеси старіння. Ці результати свідчать про несподіваний зв’язок між неорганічним фосфатом та старінням ссавців.
1. Вступ
2. Ендокринна регуляція фосфатного обміну
3. Молекулярна основа дії FGF23
Недавні дослідження визначили Klotho, однопрохідний трансмембранний білок, експресований в нирках, як ко-фактор, необхідний для зв’язування FGF23 з FGFR (Kurosu et al., 2006; Urakawa et al., 2006). Білок Klotho утворює конститутивний бінарний комплекс з декількома FGFR (FGFR1c, 3c та 4) і підвищує їх спорідненість до FGF23. Іншими словами, Клото функціонує як зв'язуючий ко-рецептор для FGF23. Насправді миші з дефіцитом Клото є цілком стійкими до FGF23 і виявляють фенотипи, що утримують фосфати, як миші з дефіцитом FGF23 (Tsujikawa et al., 2003; Yoshida et al., 2002). Специфічна для нирок вираз Klotho пояснює, чому FGF23 визнає нирку своїм органом-мішенню серед багатьох органів, які експресують FGFR. Білок Klotho, можливо, еволюціонував, щоб компенсувати низьку спорідненість FGF23 до сульфату гепарану і, зокрема, підтримувати активацію FGFR за допомогою FGF23, що представляє новий механізм обмеження органів-мішеней у надлишкових взаємодіях ліганд-рецептор. Таким чином, Klotho та FGF23 стали важливими компонентами кістково-ниркової ендокринної осі, яка регулює метаболізм фосфатів (Kuro-o, 2006, 2008; Kurosu and Kuro-o, 2008, 2009b; Liu et al., 2007; Liu and Quarles, 2007).
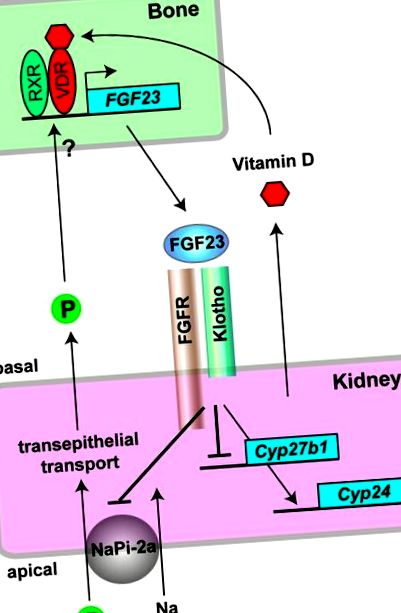
Кістково-ниркові ендокринні осі, опосередковані FGF23 та Klotho. В остеоцитах активна форма вітаміну D (1,25-дигідроксивітамін D3) зв'язується з рецептором вітаміну D (VDR) і утворює гетеродимери з іншим ядерним рецептором (RXR) для трансактивації транскрипції гена FGF23. Фосфат (P) також збільшує експресію FGF23 у кістці, проте його механізм ще потрібно визначити. FGF23, що виділяється з кісткових впливів на комплекс Klotho-FGFR, що експресується в нирковому епітелії нирок. Як фосфатуровий гормон, FGF23 інгібує трансепітеліальну реабсорбцію фосфату, пригнічуючи натрій-фосфатний ко-транспортер типу-IIa (NaPi-2a) на мембрані верхівкової кисті ниркових канальців, тим самим закриваючи негативну петлю зворотного зв'язку для гомеостазу фосфатів. Як протирегуляторний гормон для вітаміну D, FGF23 знижує сироваткові рівні 1,25-дигідроксивітаміну D3, пригнічуючи його синтез шляхом регулювання зниження експресії гена Cyp27b1 та сприяння його інактивації шляхом регулювання експресії гена Cyp24, тим самим закриваючи петля негативного зворотного зв'язку для гомеостазу вітаміну D.
4. Генетичні докази токсичності фосфатів
Дефекти або Klotho, або FGF23 порушують петлі негативного зворотного зв'язку, які підтримують гомеостаз фосфатів та вітаміну D, що призводить до високого рівня фосфатів та вітаміну D у сироватці крові. Високий вміст вітаміну D у сироватці сприяє всмоктуванню кальцію в кишечнику та також індукує гіперкальціємію. Слід зазначити, що цей метаболічний стан, що характеризується високим рівнем фосфатів, кальцію та вітаміну D у сироватці крові, пов’язаний із синдромом передчасного старіння. Насправді ген klotho спочатку ідентифікували як ген, мутований у штамі миші, який успадкував синдром передчасного старіння (Kuro-o et al., 1997). У мишей, яким не вистачає Клото, розвиваються численні фенотипи, схожі на старіння, включаючи скорочену тривалість життя, затримку росту, гіпогонадотропний гіпогонадизм, швидку атрофію тимусу (Min et al., 2007), атрофію шкіри, саркопенію, кальцифікацію судин, остеопенію (Kawaguchi et al., 1999 ), емфізема легенів (Ishii et al., 2008; Sato et al., 2007; Suga et al., 2000), порушення пізнання (Nagai et al., 2003), порушення слуху (Kamemori et al., 2002), і дегенерація рухового нейрона (Anamizu et al., 2005). Ці фенотипи спостерігаються також у мишей, у яких відсутній FGF23 (Razzaque et al., 2006).
Ці спостереження свідчать про те, що фосфати, кальцій та/або вітамін D можуть бути токсичними при збереженні та прискоренні старіння. Кілька досліджень підтвердили це поняття. По-перше, дієта з дефіцитом вітаміну D не тільки відновила рівень фосфатів і кальцію в сироватці крові до норми, але також врятувала декілька старіючих фенотипів як у мишей з дефіцитом Клото, так і у мишей з дефіцитом FGF23 (Stubbs et al., 2007; Tsujikawa et al., 2003 ). По-друге, абляція дії вітаміну D у мишей з дефіцитом Клото і мишей з дефіцитом FGF23 шляхом порушення гена Cyp27b1 (Ohnishi et al., 2009; Razzaque et al., 2006) або гена рецептора вітаміну D (Hesse et al., 2007) також врятував гіперфосфатемію, гіперкальціємію та синдром передчасного старіння.
Нарешті, дієта з низьким вмістом фосфатів врятувала скорочену тривалість життя та кальцифікацію судин як у мишей з дефіцитом FGF23, так і у мишей з дефіцитом Клото (Morishita et al., 2001; Stubbs et al., 2007). Ці дослідження дали однозначні докази того, що синдром передчасного старіння, спричинений дефектами ендокринної осі Klotho-FGF23, зумовлений утриманням фосфатів, кальцію та/або вітаміну D. Слід зазначити, що дієта з низьким вмістом фосфатів врятувала множинні фенотипи FGF23- дефіцитні миші, незважаючи на той факт, що він ще більше підвищував і без того високий рівень кальцію та вітаміну D у сироватці крові (Stubbs et al., 2007), припускаючи, що фосфати, але не кальцій або вітамін D, в основному відповідають за фенотипи, схожі на старіння. Цілком ймовірно, що дієта з низьким вмістом вітаміну D та абляція активності вітаміну D врятували прискорене старіння за рахунок зниження рівня фосфатів у сироватці крові, хоча залишається визначити, чи потрібні високі рівні вітаміну D та/або кальцію для того, щоб фосфат викликав синдром передчасного старіння.
5. Фосфат і старіння
Неорганічний фосфат є не тільки важливим компонентом клітинної структури (ДНК та мембранні фосфоліпіди), але також ключовим посередником численних клітинних видів діяльності, включаючи енергетичний обмін (вироблення АТФ) та передачу сигналів, опосередковану кіназою. Він також бере участь у патофізіології різних розладів, таких як захворювання кісток, кальцифікація судин та хронічні захворювання нирок, серед інших. Хоча мало відомо про прямий вплив фосфату на старіння, накопичувані докази демонструють, що неорганічний фосфат має значний вплив на метаболізм глюкози та окислювальний стрес, що потенційно може вплинути на процеси старіння будь-якого організму від дріжджів до людини.
У Saccharomyces cerevisiae фосфатне голодування, як і голодне глюкоза, індукує зупинку клітинного циклу та продовження хронологічного періоду життя (Boer et al., 2008; Brauer et al., 2008). Виявлено кілька генів, що реагують на фосфати, включаючи ген PHO85, який кодує циклінозалежну кіназу, активність якої корелює з концентрацією внутрішньоклітинного фосфату. Pho85 інактивується в умовах низького рівня фосфатів, що призводить до спокійного G0-подібного стану та тривалого виживання (Wanke et al., 2005). Pho85 також функціонує як негативний регулятор для набору генів, які зазвичай індукуються при глюкозному голодуванні (DeRisi et al., 1997; Mouillon and Persson, 2006). Таким чином, обмеження фосфатів викликає метаболічні зміни, подібні до тих, що викликані обмеженням калорій (глюкози) у дріжджах.
У ссавців дієта з низьким вмістом фосфатів викликає зміни в метаболізмі, подібні до тих, що викликані обмеженням дієти, як обговорюється нижче. Тварини з обмеженим харчуванням знижують рівень інсуліну в крові, щоб адаптувати знижену доступність вуглеводів та змінити експресію генів, що реагують на інсулін, що призводить до змін метаболізму глюкози, включаючи посилений глюконеогенез та зменшення гліколізу серед інших (Cao et al., 2001; Kayo et al., 2001; Lee et al., 1999; Masoro, 2006; Wetter et al., 1999). Незважаючи на те, що дієта з низьким вмістом фосфатів не знижує рівень інсуліну в крові, вона дійсно змінює експресію реагуючих на інсулін генів таким чином, як індукований обмеженням дієти (Xie et al., 1999; Xie et al., 2000), що призводить до посилення глюконеогенезу а також зниження рівня гліколізу. Частково це можна пояснити тим фактом, що дієта з низьким вмістом фосфатів індукує помірну резистентність до інсуліну за невідомих механізмів (Haap et al., 2006; Paula et al., 1998). Таким чином, помірний інсулінорезистентність, індукована обмеженням фосфатів, а також гіпоінсулінемія, індукована обмеженням дієти, послаблюють внутрішньоклітинну сигнальну активність інсуліну та викликають подібні зміни в експресії гена, що реагує на інсулін, що призводить до подібного стану.
Більше того, Американська кардіологічна асоціація оголосила, що ХХН слід включити до групи з найвищим ризиком серцево-судинних захворювань (Sarnak et al., 2003). Важливо, що експресія Клото значно знижується в нирках хворих на ХХН (Koh et al., 2001). Таким чином, ХХН можна розглядати як сегментарний прогероїдний синдром, пов’язаний із станом дефіциту Клото та затримкою фосфатів. Цікаво, що пацієнти з синдромом прогерії Хатчінсона-Гілфорда (HGPS) виявляють гіперфосфатемію та зменшену фракційну екскрецію фосфату (Merideth et al., 2008; Ortiz, 2008), що є характерними ознаками мишей, у яких відсутня Klotho або FGF23. Хоча гіперфосфатемія не в першу чергу відповідає за фенотипи HGPS, вона може збільшити серцево-судинну смертність у пацієнтів із HGPS.
Іншим підтвердженням думки, що фосфат впливає на процеси старіння, є зворотна кореляція між тривалістю життя та рівнем фосфату в сироватці крові у ссавців (рис. 2). Хоча існують труднощі з точною оцінкою довготи та "нормального" рівня фосфатів у сироватці крові, чітко спостерігається тісний взаємозв'язок між тривалістю життя та фосфатом у сироватці у різних видів.
- 5 уроків здоров’я, яким можна навчитися у італійців - довголіття НА ЖИТТІ
- Ефект проти ожиріння та антиоксидантна активність у дієтичних мишей з високим вмістом жиру, ферментованих гречаних продуктів
- Ефект проти ожиріння у мишей із ожирінням C57BL6, викликаних дієтою з високим вмістом жиру. Дослідження нового витягу з
- Проти ожиріння та протизапальний ефект женьшенного оцту при дієті з високим вмістом жиру, яку годували мишами SpringerLink
- Дивовижне посилання на ожиріння