Посилена експресія фактора росту тучних клітин та активації тучних клітин у сечовому міхурі після розв’язання коліту тринітробензолсульфокислоти (TNBS) у самок щурів
Руомей Лян
1 Медичний факультет, Кафедра гастроентерології, гепатології та харчування, Університет Пітсбурзької школи медицини, Пітсбург, Пенсільванія, 15213, США
Устінова Олена Євгенівна
1 Медичний факультет, Кафедра гастроентерології, гепатології та харчування, Університет Пітсбурга, Школа медицини, Пітсбург, Пенсільванія, 15213, США
Радхіка Патнам
1 Медичний факультет, Кафедра гастроентерології, гепатології та харчування, Університет Пітсбурзької школи медицини, Пітсбург, Пенсільванія, 15213, США
Метью О. Фрейзер
2 Кафедра хірургії, відділення урології Медичний центр університету Дюка та Дарем VAMC Дарем, штат Північна Кароліна 27705 США
Дмитро В. Гуткін
3 Відділення патології, Медичний центр Вірджинії, Пітсбург, штат Пенсільванія
Майкл А. Пеццоне
1 Медичний факультет, Кафедра гастроентерології, гепатології та харчування, Університет Пітсбурзької школи медицини, Пітсбург, Пенсільванія, 15213, США
Анотація
Хронічні розлади тазового болю часто збігаються. Ми показали, що гостре подразнення товстої кишки може спричинити гостру іритаційну структуру сечовипускання та гостро сенсибілізувати аферентні реакції сечового міхура на механічні та хімічні подразники. Ми припускаємо, що з часом подразнення товстої кишки може призвести до нейрогенних змін у сечовому міхурі та розвитку хронічної сенсибілізації сечового міхура.
Методи
Структури сечовиділення вимірювали у щурів через 60–90 днів після індукції коліту тринітробензолсульфонової кислоти (TNBS) у фазі розрішення цієї моделі. Загальний та активований тучний клітин (MC) визначали кількісно в сечовому міхурі, тоді як рівні мРНК фактору стовбурових клітин (SCF) (він же фактор росту MC) та фактора росту нервів (NGF) (MC та ноцицептивний стимулятор C-волокон) визначали кількісно сечовий міхур і ганглії спинного кореня L6-S1 (DRG).
Результати
Після внутрішньоректального TNBS обсяг пустот зменшився (p Ключові слова: Фактор стовбурових клітин, кишечник, нейрогенний цистит, сечовипускання, дегрануляція
ВСТУП
Оскільки колоректум та сечовий міхур - це два органи малого тазу, функції яких є невід’ємною частиною повсякденної, свідомої, фізіологічної діяльності тазу, не дивно, що синдром подразненого кишечника (СРК) та інтерстиціальний цистит (ІЦ), аналогічні розлади тазового болю та невідкладності є двома найпоширенішими порушеннями хронічного тазового болю (ХТП), які в цілому вражають близько 15% чоловіків і жінок [Mathias et al., 1996; Молдвін, 2002; Вессельманн, 2001; Zondervan et al., 2001]. СРК, кишковий розлад, що характеризується хронічними або рецидивуючими болями внизу живота або дискомфортом, пов’язаними зі зміною консистенції та частоти стільця [Thompson et al., 2000], є найпоширенішою шлунково-кишковою причиною CPP, що вражає 50% таких жінок, які звертаються до гінекологічних клінік. [Хогстон, 1987; Prior et al., 1989; Walker et al., 1991; Walker et al., 1996]. IC або синдром хворобливого сечового міхура характеризується неприємними сечовивідними симптомами, такими як частота сечовипускання, невідкладність, ніктурія та, головним чином, біль, пов’язаний з наповненням сечового міхура за відсутності активної інфекції або органічного захворювання [Koziol, 1994; Ратнер, 2001; Молдвін, 2002].
У 40–60% пацієнтів з діагнозом СРК також виявляли симптоми та відповідали діагностичним критеріям ІК [Prior et al., 1989; Whorwell et al., 1986], хоча відповідно у 50% пацієнтів з діагнозом ІС також були виявлені симптоми та відповідають діагностичним критеріям СРК [Alagiri et al., 1997; Нові та ін., 2005]. Мабуть, не дивно, що відверті запальні стани товстої кишки, такі як дивертикуліт та запальні захворювання кишечника, також пов’язані з дизурією та ІК [Gibson, 1969; Alagiri та ін., 1997]. Більше того, це явище не обмежується товстою кишкою та сечовим міхуром, оскільки інші тазові області та органи зі спільними дерматомами також мають значне клінічне перекриття. Наприклад, 26% пацієнтів з ІЦ мали одночасний біль у вульві або вульводинії [Fitzpatrick et al., 1993], тоді як у 45% чоловіків із хронічним простатитом або у чоловіків СРП спостерігався біль при наповненні сечового міхура, що є класичною особливістю ІК [Молдвін, 2002]. Високий коефіцієнт узгодженості IBS, IC та інших розладів CPP свідчить про загальну схильність, спільний етіологічний фактор або можливу перехресну сенсибілізацію органів малого тазу [Pezzone et al., 2005].
Нещодавно, в новій експериментальній моделі гострого подразнення органів малого тазу та нервових перехресних зв’язків між органами малого тазу, ми продемонстрували, що гострий цистит може знизити колоректальний сенсорний поріг до роздуття балонів і що гострий коліт може спричинити гострі ірративні схеми сечовипускання. . Розвиток перехресної сенсибілізації органів малого тазу в умовах гострої обстановки запропонував роль і подальшу модуляцію вже існуючих аферентних шляхів в малому тазу. Доречно, подальші дослідження, проведені в нашій лабораторії з використанням одиничного реєструючого аферентного сечового міхура C-волокна, показали, що гостре подразнення товстої кишки здатне сенсибілізувати аферентні речовини сечового міхура до механічних та хімічних подразників. Переривання нервового введення в сечовий міхур покращило цей ефект, вказуючи на прямий аферентний шлях з товстої кишки [Устинова та ін., 2006].
Щоб дослідити цю гіпотезу, ми оцінили фізіологічний вплив подразнення товстої кишки на функцію сечового міхура, вимірюючи схеми мікціону у неспаних самок щурів через 60–90 днів після індукції коліту TNBS під час фази розв’язання. Щоб почати виявляти гістологічні та біохімічні зміни в аферентних та кінцевих органах, які можуть бути відповідальними за нейрогенне запалення та аферентну сенсибілізацію в малому тазу після подразнення товстої кишки, кількість тучних клітин сечового міхура та відсоток активації були визначені кількісно. У паралельній серії тварин RT-PCR використовували для кількісної оцінки рівня мРНК у факторі стовбурових клітин (SCF, він же фактор росту тучних клітин) та факторі росту нервів (NGF, нейротрофічний фактор, а також стимулюючий фактор тучних клітин, який діє синергічно в у зв'язку з цим із SCF [Hirata et al., 1993; Carnahan et al., 1994; Lourenssen et al., 2000] у сечових міхурах та гангліях дорсального кореня L6-S1 (DRG) (що відповідає попереково-крижовому аферентному входу в сечовий міхур та дистальний колоректум щура).
Матеріали і методи
Тварини
Діви-самки щурів Sprague-Dawle, вагою 200-225 г та віком 9-11 тижнів, були придбані у Hilltop Lab Animals, Inc. (Скоттсдейл, Пенсільванія) і розміщені в стандартних поліпропіленових клітках з вільним доступом до їжі та води в Університеті Пітсбурга, Центральний завод для тварин. Усі дослідження були схвалені Інституційним комітетом з догляду та використання тварин Університету Пітсбурга, і було встановлено, що вони відповідають стандартам гуманного догляду та використання тварин, встановлених Законом про захист тварин та Посібником NIH з догляду та використання лабораторних тварин.
Індукція тринітробензолсульфонової кислоти (TNBS) Коліт
2,4,6-тринітробензенсульфонову кислоту (TNBS; 5% -ний водний розчин; Sigma) вводили внутрішньоректально під 4% -ною анестезією ізофлураном, як описано раніше Morris [Morris et al., 1989] та модифіковано Appleyard [Appleyard and Wallace, 1995] викликати подразнення товстої кишки. Коротко, TNBS (50 мг/мл), розчинений у 50% етанолі (об./Об.), Вводили трансанально (загальний об’єм 0,5 мл) за допомогою катетера PE-90, кінчик якого розміщували приблизно на 6 см проксимальніше анального отвору. межі. Контрольні тварини отримували 0,5 мл фізіологічного розчину. Сургілуб (E. Fougera & Co., Мелвілл, штат Нью-Йорк) наносили на промежину, щоб мінімізувати будь-яке потенційне подразнення забруднювачів через анальний витік. Ця модель коліту характеризується локальними ділянками гострого запалення, що досягають максимуму через 4–7 днів, і супроводжується хронічним, мононуклеарним запальним клітинним інфільтратом, який зберігається до шести тижнів, поки не пройде без спонтанного рецидиву.
Вимірювання метаболічних клітин
У цих експериментах вимірювали схеми сечовипускання (порожнистий об'єм і частоту) у метаболічних клітинах протягом 24 годин у неспаних щурів через 60–90 днів після індукції коліту TNBS, як описано вище (n = 7), або внутрішньоколонового сольового розчину (n = 8 ). Це вважається «загоєною» фазою коліту TNBS, оскільки розмір та частота стільця нормалізуються. Використовували період 60–90 днів, щоб переконатись, що хронічна (активна) фаза коліту вирішена. Оскільки для вимірювання частоти сечі та випорожненого об’єму в метаболічній клітці потрібне розділення рідкої сечі та твердого стільця, 60–90-денний часовий проміжок забезпечив клінічне вирішення коліту (як характеризується твердим стільцем) та дозволив вимірювання сечі протягом 24 годин (що вимагає сформований стілець).
Тварин поміщали в метаболічні клітини приблизно в один і той же час під час кожної оцінки (10 ранку) для контролю щодо добових ритмів та змінних. Щонайменше, один контролер з підстилкою тварин завжди був у парі з лікуючими тваринами у будь-який день (4 загальні клітки) для контролю щодо будь-яких повсякденних змінних середовища. Камери розміщувались у тихій обстановці, а штучне світло використовувалося для відтворення домашньої клітини тварини, цикл день-ніч (не зворотний). Метаболічні клітини були обладнані системою збору сечі, яка визначає кількість сечі, що виробляється в режимі реального часу. Для збору даних була використана комп’ютеризована система збору даних (DATAQ Instruments, Inc., Akron, OH) для подальшої інтерпретації.
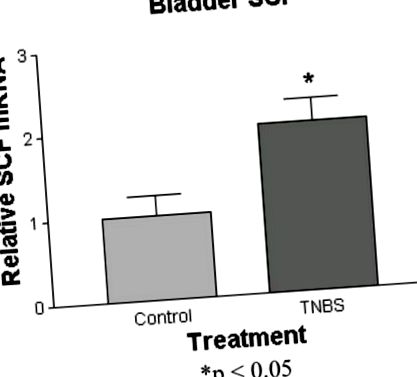
Тварин тестували лише один раз або більше 23 годин (рисунок 1, об’єм випорожненого сечового міхура у неспаних щурів, які раніше отримували внутрішньоколоніальну TNBS (за 60–90 днів до цього) (n = 7), був на 50% менше, ніж контрольовані фізіологічним розчином (n = 8) (0,62 ± 0,02 мл на порожнечу проти 1,25 ± 0,2 мл на порожнечу відповідно) (p Рисунок 2). Тучні клітини переважно розташовувались навколо підслизових та адвентиціальних судин з інфільтрацією власного пластинки та muscularis propria. Представник мікрофотографія як для контрольної, так і для обробленої TNBS щури показана на малюнку 2. Хоча середня кількість тучних клітин не отримувала значного збільшення у тварин, які отримували TNBS (7,1 ± 0,7 на hpf проти 5,4 ± 1,2 на hpf для контрольних груп), значне збільшення кількості та відсотка активованих тучних клітин спостерігалося після TNBS (рис. 3 та 4). 4). Кількість активованих тучних клітин зросла з 1,05 ± 0,3 на hpf до 2,75 ± 0,5 на hpf (p Рисунок 5). Однак у ДРГ L6-S1, загальному джерелі аферентних проекцій кишечника та сечового міхура, рівні мРНК SCF нічим не відрізнялися від контролю.
Література, що підтверджує нейрональну роль SCF, що включає виживання та регенерацію нейронів, підтверджена, оскільки дослідження показали, що продукція нейротрофічних факторів, таких як NGF та цитокінів, таких як IL-1β, IL-6 та TNF-α, мікроглією збільшується регулюється введенням екзогенного SCF, фактора, секреція якого може бути регульована фізіологічно після пошкодження нейронів [Zhang SC and Fedoroff, 1996]. Вважається, що церебральна гіпоксія та ішемія стимулюють нейрогенез через трофічні фактори, такі як SCF в ЦНС [Jin et al., 2002]. Також було показано, що SCF є нейротрофічним фактором (синергічним з NGF) для нейронів DRG, відіграючи роль у рості та регенерації невритів, керуючи аксонами DRG [Hirata et al., 1993; Карнахан та ін., 1994; Lourenssen et al., 2000]. Більше того, подальша характеристика цих c-kit-позитивних нейронів у ДРГ показала, що багато містять SP (44%), що закінчуються в пластинах спинного мозку I та II, та реагують на NGF, що свідчить про ноцицептивну роль як аферентні C-волокна [ Хірата та ін., 1995]. Важливість та складність цих взаємодій між сенсорними нейронами та SCF додатково виявляється у знахідці, що SP може індукувати продукцію SCF, яка, в свою чергу, може підвищувати регуляцію SP-рецепторів підтипу NK-1 у стромі кісткового мозку [Rameshwar and Гаскон, 1995]. Отже, SCF може відігравати важливу роль у аферентній сенсибілізації та/або нейрогенному запаленні.
- Лікарі клінічної регенеративної медицини та спеціалістів із стовбурових клітин Амарілло, Техас
- GP76 Досвід лікування екстрофії сечового міхура у новонародженої дівчинки з синдромом Аперта Архіви
- Евеліна Бледанс фото, біографія, фільмографія, ріст
- Дослідницькі роботи з клітинної сигналізації - Протеоліз Убіквітація - Оновлення сигналізації - Шлюз сигналізації
- Гомолог крихти 1 необхідний для підтримки поляризації та адгезії фоторецепторних клітин