Поширена помилкова локалізація FUS є молекулярною ознакою аміотрофічного бічного склерозу
Джулія Е Тайзак
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Рафаель Луїзьє
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
Доаа М Таха
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Джейкоб Нівз
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Миха Модіч
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Джеймі Мітчелл
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Іоне Мейєр
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Лінда Грінсміт
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Джіа Ньюкомб
3 NeuroResource, Департамент нейрозапалення, Інститут неврології UCL Queen Square, Королівська площа, Лондон, Великобританія
Джерней Уле
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Ніколас М Лускомб
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
4 UCL Genetics Institute, University College London, Gower Street, London, UK
5 Вищий університет Окінавського інституту науки і техніки, Окінава 904–0495, Японія
Рікі Патані
1 Інститут Френсіса Крика, 1 Мідленд-роуд, Лондон, Великобританія
2 Відділ нервово-м'язових захворювань, Інститут неврології Queen Square, Королівська площа, Лондон, Великобританія
Пов’язані дані
Дані, що підтверджують результати цього дослідження, можна отримати у відповідного автора на обґрунтований запит.
Анотація
Дивіться Відаля та Аткіна (doi: 10.1093/brain/awz256), щоб отримати науковий коментар до цієї статті.
Вступ
Бічний аміотрофічний склероз (АЛС) - це невблаганно прогресуючий нейродегенеративний стан, який залишається невиліковним через наше неповне розуміння молекулярного патогенезу. Генетичні відкриття при ALS сильно впливають на всюдисущо виражені регулятори РНК-обробки (Taylor et al., 2016). Патологічно у 97% випадків білок TDP-43 неправильно локалізується від ядра до цитоплазми, де він агрегує (Neumann et al., 2006). Однак мутації, що спричиняють ALS, у зрощеній саркомі (FUS) та супероксиддисмутазі 1 (SOD1) у більшості випадків помітно не мають протеїнопатії TDP-43 (Mackenzie et al., 2007). Агрегація FUS є визнаною особливістю ALS, пов'язаного з мутацією FUS (Vance et al., 2009). Однак концепція того, що FUS дикого типу від ядерної до цитоплазматичної неправильної локалізації (а не агрегації) може бути більш розповсюдженою особливістю інших форм ALS, досі нам не була систематично оцінена. Дійсно, така помилкова локалізація досі могла уникнути виявлення через упередженість щодо вивчення агрегатів/включень, а не порушену субклітинну локалізацію лише неагрегованих білків. Ця можливість посилюється фактами, що (i) порушення ядерно-цитоплазматичної компартменталізації дедалі більше визнається ключовою особливістю ALS (Boeynaems et al., 2016); і (ii) FUS, як відомо, переміщається між ядром і цитоплазмою.
Тут ми систематично досліджували локалізацію білка FUS у моделі індукованої людиною плюрипотентних стовбурових клітин (iPSC), трансгенних моделях миші та тканині людини після забою з багатьох випадків спорадичного ALS. Ми виявили, що неправильна локалізація FUS від ядер до цитоплазми є більш поширеною особливістю ALS, ніж визнано раніше. Крім того, ми представляємо докази, які підтверджують передбачуваний молекулярний механізм цієї неправильної локалізації через взаємодію між білком FUS та аберрантною транскрипцією SFPQ, що зберігає інтрон.
Матеріали і методи
Індукована плюрипотентна культура стовбурових клітин та диференціація рухових нейронів
IPSC підтримувались із використанням стандартних протоколів. Диференціацію рухових нейронів проводили, як було описано раніше (Hall et al., 2017; Luisier et al., 2018). Детальнішу інформацію див. У Додатковому матеріалі. Детальна інформація про лінії iPSC наведена в додатковій таблиці 1.
Тварини, трансгенні моделі та обробка тканин
Посмертна тканина людини
Зрізи заморожених тканин отримані з поперекових відділів спинного мозку восьми здорових донорів та 12 вікових та статевих спорадичних хворих на БАС (Додаткова таблиця 2). Смерть до часу затримки заморожування також була порівнянна між групами [середня затримка ± стандартне відхилення (SD): 30,13 ± 12,87 та 27,75 ± 10,63 год, для контрольних та спорадичних пацієнтів з БАС відповідно]. Зразки спинного мозку були отримані з тканинного банку NeuroResource, Інститут неврології UCL, Лондон, Великобританія. Зразки були передані в банк тканин за письмовою згодою донорів тканин після етичної перевірки Комітетом NHS NRES Лондон-Центральна та зберігаються під ліцензією дослідницького сектору Управління людських тканин Великобританії (HTA). У цьому дослідженні випадки ALS вважалися епізодичними через відсутність будь-якої сімейної історії хвороби рухових нейронів. Крім того, всі випадки виявляли патологію TDP-43 при скринінгу NeuroResource, припускаючи, що вони не є мутантами SOD1 [оскільки патологія TDP-43 відсутня у випадках ALS, пов’язаних з SOD1 (Mackenzie et al., 2007)].
Імуномаркування, візуалізація та аналіз зображень
Фракціонування клітин, екстракція РНК, зворотна транскрипція та кількісна ПЛР
Флуоресценція однієї молекули in situ гібридизація
Зонди були розроблені з використанням програмного забезпечення Probe Designer від Biosearch Technologies і надані тим самим постачальником. Включені зонди були розроблені проти SFPQ-інтрону, кон'югованого з Quasar®570 (SMF-2037-1), і зрілого SFPQ, кон'югованого з Quasar®670 (послідовності зондів доступні за запитом). Кількісне визначення сигналу гібридизації проводили за допомогою власного алгоритму виявлення інтенсивності плями в сегментованих клітинах DAPI для розділення ядерного та цитоплазматичного сигналів.
Аналіз даних субклітинної локалізації білка FUS
Ми використовували R та lme4 (Bates et al., 2015) для проведення лінійного аналізу змішаних ефектів взаємозв'язку між локалізацією FUS та мутацією VCP або SOD1, а також зі спорадичними ALS, що пояснює ідіосинкратичні варіації як через тваринні, так і через індивідуальні відмінності . Як фіксовані ефекти ми або ввели в модель мутацію або змінну хвороби ALS. Як випадкові ефекти ми мали перехоплення або для тварин (SOD1, VCP), або для пацієнтів, і для партій. Візуальний огляд залишкових ділянок не виявив явних відхилень від гомосцедастичності або нормальності. Значення P були отримані за допомогою тестів на коефіцієнт вірогідності повної моделі з ефектом, про який йде мова, проти моделі без відповідного ефекту.
Картування даних iCLIP
Неопрацьовані дані зшивання з роздільною здатністю індивідуального нуклеотиду FUS та дані щодо імунопреципітації (iCLIP) можна отримати за посиланням https://imaps.genialis.com/ (Attig et al., 2018). Перед вирівнюванням було здійснено вилучення двоступеневого адаптера за допомогою Cutadapt відповідно до стандартної робочої процедури ENCODE iCLIP. Для вирівнювання також був використаний двоступеневий підхід. По-перше, Bowtie2 використовували для видалення зчитувань, що вирівнюються до рРНК або тРНК. Потім STAR використовували для вирівнювання решти зчитувань за GRCh38, зберігаючи лише однозначно зіставлені зчитування. Дублікати ПЛР були згорнуті на основі унікальних молекулярних ідентифікаторів та місць відображення. Положення зшитого з роздільною здатністю нуклеотиду розраховували як координату, яка безпосередньо передувала події усічення зворотної транскрипції.
Дотримання етичних норм
Для роботи з iPSC на людях у цьому дослідженні було отримано інформовану згоду від усіх пацієнтів та здорового контролю. Експериментальні протоколи проводились згідно із затвердженими правилами та рекомендаціями Національної лікарні неврології та нейрохірургії UCLH та спільного комітету з питань етики Інституту неврології UCL Queen Square (09/0272). Посмертні зразки спинного мозку людини були отримані з тканинного банку NeuroResource, Інститут неврології UCL Queen Square, Лондон, Великобританія. Зразки були передані в банк тканин за письмовою згодою донорів тканин після етичної перевірки Комітетом NHS NRES Лондон-Центральна та зберігаються під ліцензією дослідницького сектору Управління людських тканин Великобританії (HTA). Усі експерименти на тваринах, описані в цьому дослідженні, проводились за ліцензією Міністерства внутрішніх справ Великобританії та були схвалені Комісією з етичного огляду Інституту неврології.
Наявність даних
Дані, що підтверджують результати цього дослідження, можна отримати у відповідного автора на обґрунтований запит.
Результати
Ядерна-цитоплазматична помилкова локалізація FUS у моделях ALS-мутантів VCP людини та миші
Ядерна-цитоплазматична неправильна локалізація FUS в спорадичному ALS людини
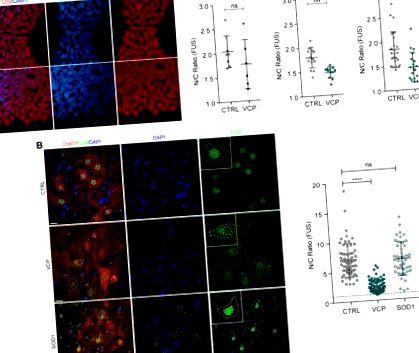
Встановивши, що FUS неправильно локалізований у моделях ALS, пов’язаних з VCP, але не в SOD1, ми далі намагалися розглянути питання про узагальнення цього висновку для спорадичних форм ALS (що становить 90% усіх випадків). З цією метою ми дослідили патологоанатомічну тканину спинного мозку з 12 спорадичних випадків БАС та восьми здорових контрольних груп (рис. 2 А). Ми виявили чіткі докази неправильної локалізації FUS від ядер до цитоплазми у цих спорадичних випадках ALS, але за відсутності включень цитоплазми FUS.
Ядерна-цитоплазматична неправильна локалізація FUS в спорадичному ALS людини. (A) Аналіз субклітинної локалізації FUS в рухових нейронах в черевному відділі спинного мозку здорових людей контролю (n = 8) та пацієнтів зі спорадичними ALS (sALS) (n = 12). Цитоплазму рухових нейронів ідентифікували за допомогою імуномаркірування ЧАТ, ядра фарбували DAPI. Коефіцієнт N/C імунореактивності FUS вимірювали, як описано на рис. 1 B. Для аналізу враховували лише рухові нейрони з видимим ядром. Ми використовували R та lme4 (Bates et al., 2015) для проведення лінійного аналізу змішаних ефектів взаємозв'язку між локалізацією FUS та хворобою sALS. Шкала шкали = 20 мкм. Наведені дані - це співвідношення N/C (середнє значення ± SD) на клітину з принаймні восьми випадків на групу. (B) Ядерна та цитоплазматична області ядер рухових нейронів та цитоплазми в sALS (n = 12) проти контролю (n = 8). Наведені дані є середнім значенням ± SD. P-значення з непараметричного тесту Манна-Уітні. (C.) Одноклітинне вимірювання ядерної (праворуч) та цитоплазматичної площі (ліворуч) не показує кореляції із співвідношенням ядер FUS та цитоплазмою, як показано на діаграмах розсіювання. PCC = коефіцієнт кореляції Пірсона.
Зменшення розміру моторно-нейронних сом раніше було показано в моделі in vitro ALS, яка асоціюється із збільшенням апоптозу (Kiskinis et al., 2014). Таким чином, ми дослідили, чи супроводжують зміни субклітинної локалізації FUS у спорадичних зразках ALS зміни в морфології клітин. Використовуючи одноклітинний аналіз ядерних розмірів і розмірів клітин, ми продемонстрували значне зменшення як ядерної, так і цитоплазматичної областей у спорадичних ALS порівняно з контрольними руховими нейронами (рис. 2 B), що не корелювало зі зменшенням локалізації ядерної та цитоплазматичної FUS в випадки sALS (рис. 2 С).
FUS зв'язується з аномально збереженим інтроном у транскрипті SFPQ, який експортується з ядра
Знайшовши чіткі докази того, що FUS ядерно-цитоплазматична неправильна локалізація є більш розповсюдженою в ALS, ніж раніше визнана, ми прагнули зрозуміти її молекулярну взаємодію з 167 аберрантними інтронами, що зберігають транскрипти, які ми нещодавно описали в ALS (Luisier et al., 2018). З цією метою ми проаналізували дані iCLIP, що дозволило ідентифікувати цілі, що зв'язують РНК білка FUS. Використовуючи цей підхід, ми виявили, що білок FUS в значній мірі зв'язується з аберрантно збереженим інтроном 9 у транскрипті SFPQ (рис. 3 A і B), який ми визначили як найбільш значний утримуваний інтрон у різних мутаціях ALS (Luisier et al., 2018 ). Далі ми підтвердили, що транскрипт, що утримує інтрони SFPQ, експортується до цитоплазми за допомогою ядерно-цитоплазматичного клітинного фракціонування та qPCR (рис. 3 С), показуючи збільшену частку транскрипту інтрону SFPQ, що утримує в цитозолі мутантних культур VCP. Ми використовували одномолекулярну флуоресценцію РНК in situ гібридизацію (smFISH) як ортогональне підтвердження того, що ця транскрипція експортується з ядра (рис. 3 D).
Обговорення
Основна висновок нашого дослідження полягає в тому, що білок FUS неправильно локалізується від ядра до цитоплазми у випадках, які не пов'язані з мутацією FUS ALS. Зокрема, ми виявляємо неправильну локалізацію FUS у ALS, пов’язаному з мутацією VCP, і, що найважливіше, у спорадичному ALS. Наші висновки були ретельно перехресно перевірені на лініях iPSC (чотири мутанта VCP та чотири контрольні лінії iPSC), трансгенна модель миші (три мутанта VCP та три контрольні миші) та тканини після забою (12 випадкових випадків ALS та вісім випадків контролю ). Поширена помилкова локалізація FUS, ймовірно, ухилилася від виявлення, оскільки FUS в основному залишається неагрегованою в цитоплазмі, а не є частиною агрегатів TDP-43 у спорадичних випадках ALS.
Наші висновки підтверджують модель, згідно з якою у більшості випадків БАС відбувається неправильна локалізація FUS від ядра до цитоплазми, але, як правило, вона не агрегується в цитоплазмі. Ядерна втрата білка FUS може погіршити сплайсинг пре-мРНК, тоді як можливість цитозольного токсичного посилення функції також заслуговує на увагу у світлі останніх досліджень (López-Erauskin et al., 2018). Цікаво, що агрегація TDP-43 також спостерігається у більшості сімейних та епізодичних випадків ALS, за винятком випадків, спричинених мутаціями SOD1. Таким чином, неправильна локалізація FUS трапляється у більшості випадків, подібних до агрегації TDP-43. Важливо, що неправильно локалізований FUS спостерігається в моделях мишей та iPSC на ранніх стадіях, до появи агрегатів TDP-43, що вказує на те, що неправильно локалізований неагрегований FUS може відігравати причинну роль на початку процесу хвороби ALS, можливо, шляхом створення більшої агрегації схильне цитоплазматичне середовище.
Наш аналіз даних iCLIP свідчить про те, що FUS жадібно зв’язується з аномально збереженим інтроном транскрипту SFPQ в ALS. Сукупно, наші дані узгоджуються з робочою гіпотезою про те, що FUS дикого типу може виходити з ядра, коли зв’язаний з аномально збереженим інтроном 9 транскрипту SFPQ в ALS (рис. 3 E), хоча підтвердження такого механізму потребуватиме детальна молекулярна подальша робота.
Підводячи підсумок, ми повідомляємо про невизнану раніше широко розповсюджену помилкову локалізацію (але не агрегацію) FUS в ALS, і пропонуємо передбачуваний контекстно-специфічний механізм для цього через його взаємодію з пов'язаним з ALS аномально збереженим інтроном 9 у транскриптах SFPQ. Ці висновки піднімають перспективу спрямування ядерно-цитоплазматичної неправильної локалізації неагрегованого FUS як передбачуваної терапевтичної стратегії при ALS.
- Що таке запитання та відповіді про молекулярну гастрономію, методи та рецепти
- Переваги для здоров’я за грою в гольф - Hallmark Golf
- Молекулярна основа алергії на арахіс
- Кавунова ікра, вступ до молекулярної гастрономії смачна їжа, фітнес та технології
- Нецільова метаболоміка виявляє молекулярний вплив кетогенної дієти на здоровий та пухлинний ксенотрансплантат