Порівняння морфологічних змін м’язових волокон у відповідь на динамічне електричне скорочення м’язів та динамічну гідравлічну стимуляцію в моделі використання задньої кінцівки щура
1 Кафедра біомедичної інженерії Університету Стоні-Брук, Стоні-Брук, Нью-Йорк, США
Х. ЛАМ
1 Кафедра біомедичної інженерії Університету Стоні-Брук, Стоні-Брук, Нью-Йорк, США
R. YEH
1 Кафедра біомедичної інженерії Університету Стоні-Брук, Стоні-Брук, Нью-Йорк, США
М. ТЕЕРАТАНАНОН
1 Кафедра біомедичної інженерії Університету Стоні-Брук, Стоні-Брук, Нью-Йорк, США
Y.-X. QIN
1 Кафедра біомедичної інженерії Університету Стоні-Брук, Стоні-Брук, Нью-Йорк, США
Резюме
Вступ
Скелетні м’язи та кістки тісно взаємодіють як анатомічно, так і функціонально (Cianferotti and Brandi 2014). Показано, що на обидві ці тканини суттєво впливає відсутність сили тяжіння та іммобілізації (Bonewald et al., 2013). Біомеханічні сигнали або спрацьовані системні гормональні подразники, викликані такими станами, як навантаження або невикористання, сприймаються та трансдуруються ендокринними властивостями м’язів і кісток (Cianferotti and Brandi 2014). Незважаючи на припущення, що основний ефект відсутності сили тяжіння може бути пов’язаний з відсутністю м’язового навантаження на кістку, м’язи та кісткові тканини можуть насправді сприяти відновленню або відновленню один одного (Bonewald et al. 2013). Тому єдиний двофункціональний терапевтичний засіб, який міг би підтримувати та лікувати не лише кістки, а й м’язи, є найбільш ідеальним і потребував ідентифікації.
Повідомлялося про зниження м’язової активності, що призводить до атрофії м’язів, після космічної місії, травми спинного мозку, постільного режиму та старіння. Зміна в механічному середовищі швидко індукує м’язову адаптацію до розміру клітковини та метаболічних властивостей (LeBlanc et al. 2000, Edgerton et al. 1995, Zhou et al. 1995, Gregory et al. 2003, Narici et al. 2003, Trappe et al. 2001). Короткочасні космічні польоти спричинили значні втрати в обсязі м'язів на 5-17%, площі поперечного перерізу волокон на 11-24% та волокнах I типу на 6--8% (LeBlanc et al., 2000, Edgerton et al., 1995). Подібним чином, 6-тижнева травма спинного мозку спричинила 15% втрату м’язової маси на нижніх кінцівках та усереднене зменшення площі поперечного перерізу м’язів на 18–46% (Castro et al. 1999, Spungen et al. 2003). Ці зміни часто пов’язані із збільшенням м’язової слабкості та ризиком переломів (Zehnder et al. 2004).
Моделі дрібних тварин були широко вивчені з метою імітації стану відсутності (Allen and Bloomfield 2003, Morey-Holton and Globus 2002, Hauschka et al. 1988, Morey-Holton and Globus 1998). Подібно до досліджень на людях, дослідження гризунів показали втрату маси скелетних м’язів, найбільшу в постуральних м’язах, і зменшення м’язової сили (Boonyarom and Inui 2006, Fisher et al. 1998, Hurst and Fitts 2003, McClung et al. 2006). Паралізована кінцівка, індукована хімічними речовинами, у щурів показала найбільший спад (
40%) у вазі м’язів та площі поперечного перерізу волокон у м’язі підошви (Dupont Salter et al. 2003). Ступінь атрофії м’язів не була такою глибокою у великій гомілковій кістці та шлунково-кишковому відділі,
20%. Розвантаження задніх кінцівок щурів також підтвердило ці висновки, де спостерігалося значне зменшення площі м’язових волокон типу I та II для м’язів підошви та підошовної м’язи (Kyparos et al. 2005). Крім того, суспензія задніх кінцівок зменшила відсоток м’язових волокон типу I приблизно на 40%, тоді як кількість волокон типу II збільшилась за рахунок
Як втручання функціональна електрична стимуляція виробляє ізометричні скорочення замість відсутності м’язової активності (Baldi et al. 1998). Показано, що індуковані скорочення збільшують м’язовий об’єм, площу поперечного перерізу м’язів та покращують стійкість до втоми у людини (Gerrits et al. 2002, Skold et al. 2002). Однак ефекти цього зовнішнього подразника сильно залежали від мінливості тривалості та частоти стимуляції (Perez et al. 2002). Вплив динамічної електричної стимуляції м'язів (DEMS) на пом'якшення втрати кісткової маси у щурів було продемонстровано в залежності від частоти та відношення скорочення до спокою (Lam and Qin 2008, Lam et al. 2011). З іншого боку, нещодавно розроблена динамічна гідравлічна стимуляція (DHS) пропонується діяти неінвазивно як зовнішня коливальна мускулатура. Показано, що динамічні компоненти, отримані від гідравлічного навантаження, впливають на тиск міжкісткової рідини в кістках і пом'якшують втрату кісткової тканини залежно від частоти та величини (Hu et al. 2014, Hu et al. 2013a, Hu et al. 2012), можливо за допомогою модуляції популяції мезенхімальних стовбурових клітин кісткового мозку (Hu et al. 2013b) та експресії остеогенних генів (Hu and Qin 2014).
Електростимуляція, що застосовується до тварин, повідомляє про різний вплив на морфологію та біохімію скелетних м’язів. Численні парадигми стимулювання були перевірені і дали неоднозначний висновок про користь таких стимулювань. До розбіжностей в основному сприяли застосовувана частота стимуляції, тривалість стимуляції та тип аналізованого м’яза (Mabuchi et al. 1982, Kernell et al. 1987, Gorza et al. 1988, Jarvis et al. 1996). Стимуляція при частоті 10 Гц протягом 24 год на добу збільшувала опір втомі, проте зменшувала розмір передніх м’язів великогомілкової кістки (Salmons and Henriksson 1981). Менша частота, така як 2 Гц, застосовувана протягом 10 год на день, продемонструвала помітне зниження паралізованої атрофії підошви (Dupont Salter et al. 2003). Більшість досліджень, які показали позитивні ефекти електричного скорочення м’язів на тканинному рівні, використовували надзвичайно довгі протоколи стимуляції - від 2 до 24 годин. Крім того, застосування частоти стимуляції становило від 1 до 100 Гц.
Оскільки скелетні м’язи та кістки взаємопов’язані та взаємозалежні, і що оптимізовані сигнали стимуляції мають вирішальне значення для регенерації тканин, ми були зацікавлені в дослідженні частотного ефекту DEMS та впливу динамічних компонентів, отриманих від DHS, на морфологічні реакції м’язового волокна під стан використання. Були проведені окремі дослідження на тваринах: (1) для перевірки атрофічного ефекту суспензії задніх кінцівок на м’язи підошви щурів, шлунково-кишкового та квадрицепсного м’язів щурів; (2) оцінити різницю в морфологічних реакціях м’язових волокон на DEMS при частотах 1 Гц, 50 Гц та 100 Гц; та (3) отримати доступ до різниці в морфологічних реакціях м’язових волокон на статичне навантаження та DHS навантаження 2 Гц.
Матеріали і методи
Дослідження на тваринах 1 - Валідація індукованої HLS атрофії м’язів
Дослідження на тваринах 2 - Вплив DEMS на морфологію м’язових волокон при різних частотах навантаження
Дослідження на тваринах 3 - Вплив динамічних компонентів DHS на морфологію м’язових волокон
Гістологія та аналіз зображень
Поперечні зрізи кріоконсервованих зразків м’язів, що містять як глибокі, так і поверхневі м’язові шари, зробили до 8 мкм за допомогою кріостата (Leica) при −20 ° C. Потім три зрізи фарбували гемотоксиліном та Еосоном (H&E, Polyscience, США). П'ять випадкових знімків яскравого поля в поперечному перерізі (20x) були зафіксовані з кожної ділянки м'яза за допомогою мікроскопа Zeiss (AxioVision 4.5, Німеччина). Усереднені ділянки м’язових волокон у поперечному перерізі визначали за допомогою програмного забезпечення Image J і нормалізували до середнього значення HLS.
Статистичний аналіз
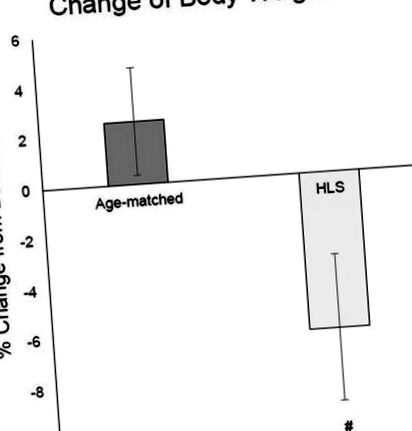
Графік показує середні значення ± SE для відсотка зміни маси тіла від вихідного рівня. Зіставлені за віком тварини показали збільшення маси тіла на 2,5%. З іншого боку, ЗСЖ впливав на відсоток зміни маси тіла із зменшенням на 6,2% ( # стор a стор b стор c стор b стор d стор a стор b стор # p Малюнок 4, усереднена площа поперечного перерізу волокна правого підошви в групі обробки 50 Гц (1605 ± 430 мкм 2) та групі обробки 100 Гц (855 ± 75 мкм 2) становила 18% (p> 0,05) і 56 % (р 2) відповідно. Правий квадрицепс у групі лікування 50 Гц (2998 ± 453 мкм 2) був на 8% більшим, ніж у групі обробки 1 Гц (2765 ± 236 мкм 2) (р> 0,05), і на 29% більше, ніж у терапії 100 Гц (2329 ± 148 мкм 2) групи (p 2) порівняно з групами лікування 50 Гц (2 585 ± 247 мкм 2) та 1 Гц (2 583 ± 91 мкм 2) (p> 0,05). Нормалізація до усередненого значення ЗСЖ показала подібні тенденції.
Графік показує середні значення ± SD для усереднених ділянок волокон солеуса, гастрокнемія та квадрицепса у відповідь на DEMS при різних частотах навантаження (A, C. і Е), а також відповідна нормалізація до середнього значення ЗСЖ (B, D і F). * стор # p Малюнок 5, усереднена площа поперечного перерізу волокна правого підошви в групі DHS (1 303 ± 439 мкм 2) була подібною до тієї, що була у статичної (1 237 ± 331 мкм 2) групи (p> 0,05). Подібним чином різниця між усередненими ділянками волокон поперечного перерізу правих м’язів шлунково-кишкового тракту між групою DHS (2643 ± 363 мкм 2) та статичною (2843 ± 739 мкм 2) групою була статистично незначущою (р> 0,05). Нормалізація до усередненого значення ЗСЖ показала подібні тенденції.
Графік показує середні значення ± SD для усереднених площ поперечного перерізу підошви та гастрокнеміального волокна у відповідь на статичний тиск та навантаження DHS (A і C.), а також відповідна нормалізація до середнього значення ЗСЖ (B і D). Усереднені ділянки м’язових волокон у поперечному перерізі в DHS були подібні до тих, що були в статичній групі.
Обговорення
У цьому дослідженні досліджували частотний ефект DEMS та вплив динамічних компонентів, отриманих з DHS, на морфологічні реакції м’язових волокон в умовах невикористання. HLS негативно впливав на вологу вагу м’язів та середні площі волокон у поперечному перерізі, більше у підошві, ніж у шлунково-кишковому та квадрицепсному відділах. За таких умов використання DEMS при 50 Гц мав значно більшу середню площу поперечного перерізу волокна порівняно з групою 1 Гц або 100 Гц в квадрицепсах і демонстрував подібну тенденцію в області гастрокнемія. DEMS при 100 Гц показав більшу середню площу поперечного перерізу волокна порівняно із стимуляцією 1 Гц та 50 Гц у підошві. Чотириголовий м’яз та шлунково-м’язовий м’яз є прикладами м’язів, що швидко смикаються, що чудово реагує на скорочення великою кількістю м’язових волокон II типу (Zhou et al. 1995, Perez et al. 2002, Punkt et al. 2004). Навпаки, підошва вважається м’язом постави (повільне посмикування) з великою кількістю волокон I типу (Punkt et al. 2004, Perez et al. 2002, Zhou et al. 1995). Повідомлялося, що волокна, що повільно смикаються, більш чутливі до ЗСЖ, ніж швидкі м’язові волокна, і це невикористання викликає повільну і швидку трансформацію (Marsh et al. 1992, Oishi et al. 1998).
Наявні дані підтвердили, що ефективність DEMS сильно залежить від частоти стимуляції. Досліджувались механічні стимуляції для полегшення атрофії м’язів. Тривала (10 - 24 год) електрична стимуляція на низькій частоті суттєво запобігала зниженню ваги у передній частині підошви та великогомілкової кістки (Dupont Salter et al. 2003, Salmons and Henriksson 1981). Однак інші виявили, що стимуляція з більшою частотою може підтримувати механічні властивості м'язів, тобто посмикування та тетанічну силу, а також зменшення втрати ваги м'язів та CSA клітковини (Eerbeek et al. 1984, Gorza et al. 1988). Щодня 30 хв електричної стимуляції при 45 Гц - 60 Гц попередньо вивчали на здорових людях (Perez et al. 2002). Оскільки випробовувані не зазнали жодної втрати м’язів, пов’язаної з невикористанням, стимуляція послужила посиленням і показала збільшення середнього показника CSA на 14% та кількості волокон типу II. Наскільки нам відомо, це дослідження було першим, хто вивчив вплив такої короткочасної тривалості (10 хв) на відмову від використання м’язів. Раніше ми показали, що DEMS, що застосовується 10 хв на день, може частково запобігти трабекулярній втраті кістки у використаній стегновій кістці залежно від частоти, де 50 Гц було визнано оптимізованою частотою навантаження DEMS для кісток (Lam and Qin 2008). Відповідно, вплив DEMS на кістки та м’язи може в кінцевому підсумку дати уявлення про взаємозв’язок між кістками та м’язами.
М'язи чотириголового м'яза та шлунково-кишкового тракту є прикладами м'язів, що швидко смикаються, які чудово реагують на скорочення великою кількістю м'язових волокон II типу. Навпаки, підошва вважається м’язом постави (повільне посмикування) з великою кількістю волокон I типу (Zhou et al. 1995, Perez et al. 2002, Punkt et al. 2004). Виявлено дослідження на швидкосмикуваних групах м’язів, тобто розгиначів пальців довгих (EDL)
95% волокон типу II за допомогою гістохімічного аналізу та ізоформи важкої ланцюга міозину (MHC) II за допомогою аналізу білка (Jarvis et al. 1996, Punkt et al. 2004, Pette et al. 2002). - висловив Солей
На закінчення, 10 хв щоденної DEMS до квадрицепса при 50 Гц показали збільшення середньої площі волокон квадрицепса в середньому в порівнянні з 1 Гц та 100 Гц. Варіація частоти стимуляції вплинула на морфологічні зміни м’язових волокон в умовах невикористання. З іншого боку, не виявлено різниці в морфології м’язів між статичною стимуляцією та стимуляцією DHS 2 Гц. Хоча механізм між стимуляцією та адаптацією тканин залишається незрозумілим, ці дослідження продемонстрували важливість розгляду типу стимуляції, що застосовується, та змін у перфузії рідини, що породжуються такою стимуляцією. У майбутньому розслідування може бути націлене на тривалість стимуляції та доповнення відповідною частотою стимуляції в режимах DEMS та DHS. Він спрямований на оптимізацію умов навантаження DHS (наприклад, частоту та величину), що діють на м’язи, та на визначення механізмів, що знаходяться нижче за течією.
Подяка
Автори вдячні за люб'язну підтримку з боку Національного інституту охорони здоров'я (R01 AR52379 та AR61821, YXQ), Командування медичних досліджень та матеріалів армії США та Національного космічного біомедичного дослідницького інституту через Угоду про співпрацю НАСА NCC 9-58 (YXQ).
- Електрична стимуляція м’язів (EMS), також відома як електроміостимуляція - Форум Concept2
- Зміни у вазі та складі тіла після ортогнатичних операцій та переломів щелепи порівняння
- Тренувальна тренування EMS - що таке електрична стимуляція м’язів
- Чи шкодить електрична стимуляція м’язів FITtec Fitness for Life?
- FITTONE EMS М'язовий тренажер для живота Акумуляторний м'язовий тонер-стимулятор Пояс для схуднення, жиру