Порівняння ефективності антитіл та опосередкованого клітинами імунітету проти інгаляційного та прищепленого вірусу грипу
Анотація
Передумови
Для оцінки імунітету проти грипу зазвичай проводять дослідження на мишах шляхом інтраназального закапування суспензії вірусу знеболеним тваринам. Це призводить до неприродного середовища в нижніх дихальних шляхах під час інфікування, і тому існує певне занепокоєння, що імунні механізми, визначені в цій моделі, можуть не відображати механізми, що захищають від інфекційних частинок вірусу, що доставляються безпосередньо в нижні дихальні шляхи у вигляді аерозолю.
Метод
Для оцінки відмінностей у захисті від прищепленого та інгаляційного вірусу мишей імунізували антигенами грипу, які, як відомо, індукують антитіла або клітинно-опосередковану відповідь, а потім піддавали 100 LD50 A/PR/8/34 (PR8) у формі аерозолю (вдихається) або рідка суспензія (закапана).
Результати
Мишей, імунізованих рекомбінантним аденовірусом (Ad), що експресує гемаглютинін, захищали від втрати ваги та смерті в обох викличних моделях, проте імунізація Ad, що експресує нуклеопротеїн грипу A (NPA) або M2, привела до більшого захисту від інгаляційного аерозолізованого вірусу, ніж вірус, закапаний у рідкій суспензії . Ad-M2, але не Ad-NPA-імунізовані миші були захищені від нижчої дози інстиляції.
Висновки
Ці результати демонструють відмінності в захисті, які залежать від методу зараження, і припускають, що опосередкований клітинами імунітет може бути більш точно продемонстрований в дослідженнях інгаляцій на мишах. Крім того, дані свідчать про те, що імунні механізми, які зазвичай характеризуються як неповні або слабкі на моделях мишей з використанням рідкого інтраназального зараження, можуть запропонувати більший імунітет проти грипозної інфекції, ніж вважалося раніше.
Передумови
Щорічні епідемії грипу призводять до приблизно 40 000 смертей у США та щонайменше до одного мільйона смертей у всьому світі [1, 2]. Вакцинація забезпечує захист від хвороб, коли антигени в інактивованих розщеплених вакцинах мають антигенну відповідність циркулюючим вірусам грипу, що відображає активність антитіл, які нейтралізують зараженість вірусом та обмежують поширення вірусу. І гемаглютинін (HA), і нейрамінідаза (NA), що інгібують антитіла, є незалежними корелятами імунітету [3]. Однак опосередкований клітинами імунітет сприяє очищенню вірусу, при цьому кількість Т-клітин, що секретують IFN-γ, корелює з ефективністю живої, ослабленої вакцини проти грипу у дітей [4].
Ранні дослідження на мишах показують, що для зараження мишей шляхом інгаляції потрібно менше інфекційних одиниць, ніж інстиляція [21], і для прямого відкладення в нижніх дихальних шляхах аерозолізовані краплі слід
Результати і обговорення
Імунізація живим вірусом та рекомбінантним аденовірусом (Ad), що експресують білки грипу
Мишей BALB/c інтраназально піддавали сублетальній дозі PR8 (H1N1) або гетерологічному реасоргенту вірусу H3N2 X-31 або вакцинували внутрішньом'язово рекомбінантним аденовірусом (Ad), що експресує HA, M2 і NP вірусів грипу A (Ad-NPA ) або NP вірусів грипу B (Ad-NPB). Остання вакцинна група, а також наївні миші служили негативним контролем, оскільки ці миші не повинні бути захищені від зараження PR8. Через три тижні після вакцинації мишам зробили кров і виміряли титри антитіл до інгібування гемаглютинації (HAI). Миші, імунізовані Ad-HA, але не Ad-M2 або Ad-NP, мали титри HAI приблизно 1: 100, що свідчить про те, що ця стратегія вакцинації ефективна для індукування відповіді антитіл. Здатність Ad-M2 та Ad-NP індукувати M2-специфічні антитіла та NP-специфічні CD8 + Т-клітини була встановлена іншими за допомогою цих самих рекомбінантних препаратів аденовірусу [5, 6, 28]. Антитіла до HAI, реактивні з PR8, також були присутніми в сироватках мишей, які зазнали сублетальної дози PR8 (титри HAI приблизно 1: 600), але не після впливу X-31 (H3N2). Як повідомляли інші, NP-специфічні CD8 + Т-клітини активуються після зараження живим вірусом грипу А і в значній кількості рекрутуються в легені після зараження вірусом іншого підтипу [29].
Реплікація вірусу в легенях вакцинованих мишей аналогічна через 4 дні після інгаляції та закапування PR8
Через п’ять тижнів після впливу вірусу або вакцинації рівну кількість мишей (n = 10) у кожній вакцинній групі піддавали дії PR8 у вигляді інгаляційного аерозолю або у вигляді закапуваної рідкої суспензії. Аерозольне випробовування проводили, як описано в "Методи та матеріали", використовуючи систему впливу лише на ніс, не заспокоюючи мишей. Навпаки, закапування проводили шляхом нанесення крапель суспензії вірусу на нори знеболених мишей. Була використана та сама летальна доза (100 LD50); оскільки миші BALB/c гинуть при вдиханні в 10 разів меншої кількості PR8 порівняно з інтраназальною інстиляцією [26], кількість вірусу, що використовується при інгаляційному випробуванні, було приблизно в 10 разів менше, ніж при інстиляційному вдиханні.
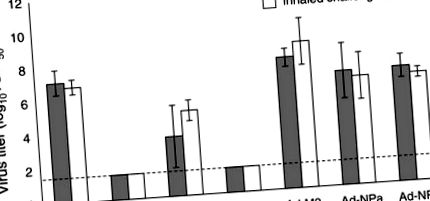
П’ять мишей у кожній групі жертвували через 4 дні після зараження та вилучали легені для титрування вірусу; клінічні ознаки захворювання та смертності контролювали у решти тварин. Ці результати показують подібну кількість вірусу в легенях мишей, що зазнали впливу, незалежно від методу зараження (рис. 1). В цей момент часу вірус не виявлявся в легенях мишей, раніше підданих впливу PR8 або вакцинованих rAd-HA. Відмічено значне зменшення титрів вірусу легенів для мишей, які раніше зазнавали дії гетерологічного вірусу Х-31, що свідчить про те, що гетеросубтипічний імунітет, індукований попередньою інфекцією живого вірусу, забезпечує подібний захист від інгаляційного та інстильованого вірусу. Однак імунізація Ad-M2 та Ad-NPA не зменшила титри вірусу на день 4 ні після інгаляції, ні через інстиляцію.
Порівняння титрів вірусів у легенях вакцинованих мишей після інстиляції та інгаляції PR8. Середні геометричні титри вірусу (TCID50/мл) показані для мишей, яких викликали інстиляцією (сірі смуги) та інгаляцією (білі смуги). Титри вірусів визначали для легенів (5 мишей на групу), зібраних на 4-й день після зараження, та гомогенізували в 1 мл середовища, що не містить сироватки. Смужки помилок вказують на стандартне відхилення, а пунктирна лінія є межею кількісного визначення для цього аналізу.
Повний імунітет проти інгаляційного та інстильованого грипу у мишей, які раніше зазнавали впливу живого гомологічного або гетерологічного вірусу або були вакциновані Ad-HA
Миші, які раніше піддавались інфекційному PR8 або які були імунізовані rAd-HA, не мали вірусу в легенях через 4 дні після інгаляції або закапування 100 LD50 гомологічного вірусу (рис. 1). Ці миші не тільки були захищені від зараження, вони були повністю захищені від втрати ваги (рис. 2) та смерті (рис. 3). Цей захист корелює з наявністю антитіл, що інгібують НА, які, як відомо, нейтралізують зараженість вірусом.
Миші, імунізовані rAd-M2 і rAd-NP, захищені від втрати ваги при вдиханні вірусу, але не при закапуванні вірусу. Середній відсоток вихідної ваги для кожної групи показаний для мишей, яким було завдано (A) закапування та (B) інгаляція. Мишей у кожній групі (n = 5) зважували індивідуально кожного дня після зараження. Кожен графік відображає середню зміну ваги групи у відсотках щодо базової ваги тіла, причому смужки помилок вказують стандартне відхилення для групи.
Незважаючи на те, що у легенях вимірювали деяку реплікацію вірусу, миші, які раніше зазнавали дії гетерологічного живого вірусу Х-31, були повністю захищені від втрати ваги (рис. 2) та смерті (рис. 3) після вдихання та закапування вірусу. Ці миші не мали антитіл, які інгібують активність HA або NA вірусу, що викликає виклик, PR8 (не показано). Як повідомлялося в численних дослідженнях гетерологічного захисту, цей захист зазвичай опосередковується специфічними для грипу CD4 + і CD8 + Т-клітинами, які вбивають інфіковані клітини [5, 29], хоча антитіла до збережених антигенних епітопів, таких як M2e, можуть також сприяти гетеросубтипічному імунітету [9, 30, 31].
Імунітет проти інгаляційного, але не прищепленого грипу у мишей, вакцинованих рекомбінантним Ad-M2 або Ad-NPA
Миші, імунізовані Ad-M2, Ad-NPA та Ad-NPB, втрачали вагу з тією ж швидкістю, що і наівні миші, після зараження рідкою суспензією PR8 (рисунок 2). Усі ці групи мишей померли до 8-го дня після зараження (рис. 3). Цікаво, що це було на один день пізніше, ніж померлі наївні миші загинули, що свідчить про деяку перевагу імунізації Ad-M2, Ad-NPA та Ad-NPB. Навпаки, втрата ваги після аерозольного зараження мишей, імунізованих Ad-M2 та Ad-NPA, сповільнилася через 3 дні після аерозольного зараження, хоча їх вага залишалася значно меншою, ніж група Ad-HA (p Рисунок 4
(A) Титри вірусів, (B) втрата ваги та (C) смертність 10LD 50 прищеплений PR8. Групи мишей (n = 10) імунізували, як і раніше, і викликали інстиляцією PR8. Через чотири дні після зараження 5 мишей у кожній групі були евтаназовані, щоб забезпечити титрування вірусу в легенях, масу та виживання решти мишей контролювали до 12-го дня (A) показує середні геометричні титри вірусу разом із стандартним відхиленням; пунктирна лінія є межею кількісного визначення для цього аналізу. (B) показує відсоткове зменшення ваги відносно базової ваги тіла, причому смужки похибок показують стандартне відхилення. Клавіша для груп показана праворуч від цього графіку. (C.) показує відсоток виживання мишей у кожній групі. Ключ для цих груп показаний праворуч від графіка. Виживання мишей, вакцинованих Ad-HA та Ad-M2, було значно більшим (тест Мантел-Кокса, р = 0,0016), ніж мишей, імунізованих Ad-NPA або Ad-NPB. Останні 2 групи не відрізнялись одна від одної або наївних мишей.
Виклик вдиханням дуже дрібних аерозольних частинок, що містять вірус, має меншу дозу LD50 [26], і тому простим поясненням різниці в захисті було те, що менша кількість віріонів потрапляє в нижні дихальні шляхи мишей, які вдихають вірус, ніж у мишей, що зазнали впливу прищеплений вірус. Ми перевірили цю ідею, прищепивши мишам в 10 разів менше закапаний вірус. Наші результати показали, що це не так - мишей, імунізованих Ad-NPA, не захищали від зараження еквівалентною кількістю вдихуваних і закапуваних частинок вірусу.
Хоча різниця в градієнті хемокінів є потенційною причиною опосередкованого клітинним захистом від інгаляційного, але не прищепленого вірусу, є й інші пояснення, які слід врахувати. Наприклад, відмінності в активованих або вроджених механізмах клітинних типів можуть призвести до більш ефективного очищення вдиху, ніж прищеплений вірус, специфічними для грипу CD8 + Т-клітинами. Тому в майбутніх експериментах слід вивчити гістопатологію легенів від заражених мишей, щоб визначити кількість та типи запальних клітин, рекрутованих у легені, та порівняти ступінь зараження, типи клітин, що інфікуються, та пошкодження клітин, оскільки вірусна або імунна патологія також може сприяти розвитку відмінності в захисті від прищепленого та інгаляційного вірусу. Інші фактори, що вимагають тестування, включають потенційний вплив ізофлурану на зараженість вірусом та функцію клітин, що реагують [34], і можливі відмінності імунної відповіді, викликаної у верхніх дихальних шляхах інстильованим та інгаляційним вірусом. Потрібні подальші експерименти, щоб визначити причини різниці в захисті від індукованого та інгаляційного вірусу, спричиненого Ad-NPA.
Наші результати показують, що миші були повністю захищені від летального зараження PR8 попереднім впливом гетеросубтипічного вірусу X31. У той час як антитіла сприяють перехресному захисту [30], опосередкований клітинами імунітет відіграє важливу роль в імунітеті з великою кількістю пам’яті NP-специфічних CD8 + Т-клітин, рекрутованих у легені [35]. Наші результати, що показують неефективний захист мишей, імунізованих Ad-NP, проти інстильованого вірусу в нашій моделі з використанням однієї дози вакцини дозволяють припустити, що NP-специфічна імунна відповідь, а також можливий захист від інстильованого вірусу можуть бути покращені введенням додаткових доз або комбінація з ад'ювантом.
Підсумовуючи, ми порівняли захист від інгаляційного та закапуваного вірусу у мишей, які раніше зазнавали дії гомологічного та гетеросубтипічного вірусу або раніше були імунізовані рекомбінантними аденовірусами, що експресують HA, M2 або NP. Наші результати показують подібний захист від інгаляційних та прищеплених проблем для мишей, які раніше були інфіковані або вакциновані Ad-HA, але не для мишей, імунізованих Ad-M2 або Ad-NPA. У цих останніх групах був значний захист від інгаляційного, але не прищепленого PR8. Ці результати свідчать про те, що імунні механізми, які часто характеризуються як слабкі, такі як вбивці, опосередковані Т-клітинами NK або CD8 +, можуть відігравати більш значну роль у захисті від хвороб та смерті, ніж раніше пропонувалося в дослідженнях, в яких мишам було завдано інстиляції рідкої суспензії вірусу . Наші дані вказують на те, що тваринні моделі, що використовують аерозольні випробування, можуть бути підходящим підходом для оцінки потенційної ефективності вакцин проти грипу, для яких клітинно-опосередковані відповіді є корелятом імунітету.
Методи та матеріали
Вірусні та вакцинні препарати
Миші та навчальний дизайн
Самки мишей BALB/c були придбані у лабораторії Джексона (Бар-Харбор, Міссісіпі) та розміщені в Центрі оцінки та досліджень біологічних препаратів (CBER), де вони були імунізовані. Мишей, яким піддавали інгаляцію лише носом, відправляли в Південний науково-дослідний інститут (SR, Бірмінгем, Алабама) приблизно за 1 тиждень до початку дослідження. Розмір клітини та догляд за тваринами відповідають рекомендаціям, передбаченим у Керівництві по догляду та використанню лабораторних тварин, Міністерство сільського господарства США через Закон про захист тварин.
Мишей викликали інстиляцією при CBER та інгаляцією лише через ніс при SR. Всі експерименти проводились за протоколами 2006-22 та 10-217, затвердженими Інституційними комітетами з догляду та використання тварин при CBER та SR, відповідно. Миші мали вік приблизно 15 тижнів і важили від 19 до 26 грамів на момент зараження вірусом інгаляцією або закапуванням.
Система виклику вдиху
До проведення інгаляційних випробувань систему характеризували за допомогою вірусу PR8 [26]. Характеристика включала досягнення та підтримання цільового діапазону концентрацій аерозолю, як визначено аналізом нальоту на зразках імпінджера, та демонстрацію розподілу частинок аерозолю за розміром аерозолю, що визначається, за допомогою аналізу APS.
Виклик вірусу
Інгаляція вірусу: Три дні поспіль перед інгаляційним випробуванням мишей навчали в утримуючих пробірках для інгаляцій лише для носа. У день виклику інгалятор Collison 3-Jet наповнили суспензією вірусного запасу і підключили до лінії доставки біоаерозолю. Розведення вірусу, необхідне для доставки 100 LD50, було визначено раніше [26]. Збір зразка суспензії небулайзера для попереднього розпилення був підтверджений, щоб було підготовлено правильне розведення вірусу. Мишей поміщали в утримуючі пробірки, призначені лише для носа, і з'єднували з пленумом для інгаляції, використовуючи носові конуси Positive Flow-By ™ (In-Tox Products, LLC; Albuquerque, NM). Групи мишей піддавали дії небулайзованого вірусу протягом 30 хвилин. Початок періоду випробування (T = 0) розпочався після активації небулайзера та встановлення на 30 psi. Інгаляційна доза (приблизно 870 ПФУ) була розрахована як добуток концентрації аерозолю, хвилинної вентиляції миші (0,062 л/хв [37]) та тривалості дії.
Інстиляція вірусу: Групи мишей знеболювали під впливом 3% ізофлурану в присутності 3% O2, а потім інокулювали 30 мкл PR8, розведеного в PBS (приблизно 5160 PFU), наносячи краплі суспензії на обидві нори.
За усіма мишами спостерігали двічі на день протягом карантину та періодів дослідження на наявність ознак захворюваності та смертності. Вагу тіла реєстрували щодня. Тварин, які втратили ≥25% від початкової ваги, евтаназували. Ці миші були мертвими, зі сгорбленою поставою, бездіяльністю та відсутністю реакції на поводження. Криві виживання були побудовані з урахуванням як евтаназованих, так і тварин, виявлених мертвими.
Статистичний аналіз
Статистичний аналіз даних про масу тіла проводили за допомогою автоматизованої системи збору даних Provantis (Instem; Стаффордшир, Великобританія). Відмінності у вазі між групами визначали двостороннім повторним вимірюванням ANOVA (Microsoft Excel 2003, Редмонд, штат Вашингтон), а різницю у виживаності визначали за допомогою тесту Мантел-Кокса з використанням програмного забезпечення GraphPad PRISM 5. Середнє значення, стандартне відхилення та дисперсійний коефіцієнт розраховували для аеробіологічних даних, використовуючи Excel або SigmaPlot (Systat Software, Inc., Сан-Хосе, Каліфорнія), коли це доречно.
Титрування вірусу
Інфекційну дозу 50% культури тканин (TCID50) визначали титруванням на клітинах MDCK (лінія ATCC CCL-34) за стандартною процедурою, яка була описана раніше [36]. Коротко, серійні десятикратні розведення кожного гомогенату легенів інокулювали в чотириразові лунки 96-лункової платівки, що містять моношар клітин MDCK. Через 1 год в інкубаторі з CO2 при температурі 37 ° C додавали рівний об'єм безсироваткового середовища, що містить 3% BSA та трипсину, обробленого TPCK (5 мкг/мл). Після 3-денної інкубації решту клітин фарбували кришталево-фіолетовим у глютеральдегіді. Титр TCID50 визначали як зворотне розведенню, яке виявляло цитопатичний ефект у 50% лунок.
- Пийте цю лляне насіння, лимонну та медову воду для схуднення та імунітету - Go Travel Blogger
- Порівняння Frumpy Coronation Street призвело до того, що Джемма втратила дивовижний ШІСТЬ камінь - Birmingham Live
- Усні огляди та оцінки користувачів CitraNatal Harmony Ефективність, простота використання та задоволення
- Ефективність програми управління вагою на основі спільноти для пацієнтів, які приймають антидепресанти
- Ефективність та безпека антиішемічного триметазидину у пацієнтів зі стабільною стенокардією та