Порівняльне експериментальне дослідження ефективності моно- та мультипробіотичних штамів у профілактиці неалкогольної жирової хвороби печінки
Анотація
Передумови
Дослідити ефективність різних пробіотичних штамів, їх комбінацій та форм (живих або ліофілізованих) при профілактиці неалкогольної жирової хвороби печінки (НАЖХП).
Методи
Результати
Введення MSG протягом неонатального періоду призводить до розвитку НАЖХП у 4-місячних щурів. Щодо ступеня стеатозу не було суттєвої різниці між групою ожиріння MSG та групами ліофілізованих монокомпонентних пробіотиків (III – V). Найвищий прояв стеатозу спостерігався для B. animalis ВКЛ групи (2,0 ± 0,25) порівняно з B. animalis ВКБ (1,70 ± 0,21) та L. casei IMVB-7280 (1,80 ± 0,20). Зміни балів стеатозу між усіма групами монопробіотиків (III – V) були незначними. Введення з народження як живої (VII), так і ліофілізованої (VI) пробіотичної суміші призводить до значного зменшення на 69,5% (стор
Передумови
Безалкогольна жирова хвороба печінки (НАЖХП) варіюється від простого стеатозу до неалкогольного стеатогепатиту (НАСГ), який може мати різну ступінь фіброзу та прогресувати до цирозу печінки та гепатоцелюлярної карциноми [1]. НАЖХП, що асоціюється з ожирінням та діабетом 2 типу, має загальну поширеність 15–20% серед загальної популяції та 76–90% серед людей із ожирінням [2]. В даний час НАЖХП є основною причиною хронічних захворювань печінки [3, 4], що призвело до значних проблем зі здоров'ям, таких як захворюваність, смертність та трансплантація печінки [5].
Згідно з моделлю Двое із двох ударів про патогенез НАЖХП, інсулінорезистентність як перший удар викликає накопичення ліпідів у гепатоцитах та призводить до розвитку жирової печінки. Другий удар включає клітинні порушення, такі як окислювальний стрес та окислення ліпідів, що пошкоджує клітини печінки та викликає запальний процес, що призводить до патологічних змін у гепатоцитах, що призводять до НАСГ [6]. Недавні дослідження дають чіткі докази того, що мікробіота кишечника сильно причетна до патогенезу та перебігу НАЖХП через декілька механізмів [7].
Основними механізмами, які пов'язують змінений склад мікробіоти кишечника з НАЖХП, є модуляція метаболізму дієтичного холіну [8] та вироблення ендогенного етанолу [9], підвищення проникності кишечника [10] з подальшою ендотоксемією та метаболічним запаленням низького ступеня [11], посилення енергетичний збір з дієти [12] та порушення синтезу коротколанцюгових жирних кислот [13], зниження всмоктування вітамінів та біологічно активних сполук [12], зміна метаболізму жовчних кислот та сигналізація FXR/TGR5 [14]. Пребіотики та пробіотики мають фізіологічні функції, що сприяють здоров’ю мікробіоти кишечника та/або відновленню мікрофлори, підтримці здорової маси тіла та контролю факторів, пов’язаних з НАЖХП, за допомогою різних вищезазначених шляхів [15].
У нашій попередній роботі ми показали, що періодична обробка мультипробіотиками, що містять біомасу 14 живих штамів (Лактобактерії, лактококи, Біфідобактерії, Propionibacterium, Ацетобактер) запобігає, принаймні частково, індуковане MSG ожиріння [16] та розвиток НАЖХП [17]. Однак питання щодо ефективності різних пробіотичних штамів, їх поєднання та форми (живих або ліофілізованих) при лікуванні НАЖХП залишається відкритим, що і сформувало цілі поточного дослідження.
Методи
Тварини
Це дослідження було проведено у суворій відповідності з рекомендаціями Керівництва з догляду та використання лабораторних тварин Національного інституту охорони здоров'я та загальних етичних принципів експериментів на тваринах, затвердженого Першим національним конгресом з біоетики в Україні (вересень 2001 р.) . Протокол затверджений Комітетом з етики експериментів на тваринах Київського національного університету імені Тараса Шевченка (номер протоколу: 10/2014). Щурів утримували в колективних клітках в контрольованих умовах температури (22 ± 3 ° С), світла (12 год цикл світло/темрява) та відносної вологості (60 ± 5%). Тварин годували лабораторною чау (PurinaW) та водою з-під крану у разі необхідності.
Дизайн експерименту
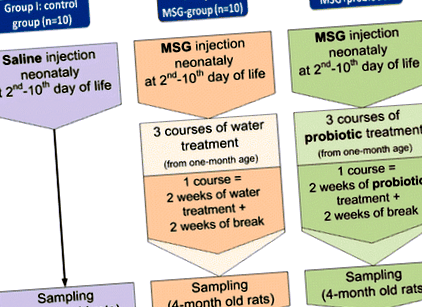
Дослідження включало 70 самців щурів Wistar, розділених на 7 груп, по 10 тварин у кожній (рис. 1). Новонародженим щурам контрольної групи (I) вводили фізіологічний розчин підшкірно (с.к.) в обсязі 8 мкл/г на 2-й, 4-й, 6-й, 8-й і 10-й післяпологові дні. Новонародженим щурам груп II – VII вводили розчин глутамату натрію (MSG) (4,0 мг/г маси тіла) с. на 2, 4, 6, 8 і 10 післяпологові дні [18]. Неонатальне введення MSG викликає значне накопичення жиру в черевній порожнині дорослих щурів. Це відбувається через вплив нейротоксичності на дугоподібне та вентромедіальне ядра гіпоталамуса [19]. У нашій попередній роботі ми продемонстрували розвиток НАЖХП в умовах важкого вісцерального ожиріння, викликаного MSG [17]. Таким чином, отримані результати підтвердили обґрунтованість використання MSG для розвитку НАЖХП.
III – VII групи лікували пробіотиками. III – V групи отримували ліофілізовані монопробіотики B. animalis ВКЛ, B. animalis ВКБ, L. casei IMVB-7280 відповідно. Група VI отримала суміш цих трьох пробіотичних штамів. VII групу лікували мультипробіотиком «Симбітер», який постачав Науково-виробнича компанія «О.Д. Пролісок ”. Він містить 14 живих пробіотичних штамів Лактобактерії + Лактокок (6 × 10 10 КУО/г.), Біфідобактерії (1 × 10 10/г.), Propionibacterium (3 × 10 10/г.), Acetobacter (1 × 10 6/г.) родів.
Введення розпочали наприкінці 4-го тижня після народження і продовжували періодично, чергуючи 2-тижневий курс та 2-тижневі інтервали без лікування. Протягом 4 місяців після народження щури мали нормальну дієту. Всі параметри вимірювали у щурів 4 місяців.
Збір зразків та біохімічний аналіз крові
Щурів усіх груп голодували приблизно протягом 12 годин до жертви. Щурів приносили в жертву шляхом вивиху шийки матки під уретановим наркозом. Кров брали з верхівки серцевого шлуночка, і кілька крапель крові збирали в мікроцентрифужну пробірку, що містить суміш NaF та ЕДТА, у співвідношенні 2: 1 (ж/б) співвідношення. Зразок крові збирали у стерильну пробірку та центрифугували при 3500 об/хв (2260 г) протягом 15 хв. Після центрифугування сироватку супернатант для подальшого аналізу розподіляли у пробірки для мікроцентрифуги та зберігали при -80 ° C. Білірубін, активність аланіну та аспартатамінотрансферази в сироватці крові визначали стандартними біохімічними методами.
Оцінка гістології печінки
Для гістологічного аналізу брали зразки тканини печінки як з правої, так і з лівої печінкової часток (розмір зразка 0,5 × 0,5 см). Після фіксації протягом 24 год у рідкій буені фрагменти печінки зневоднювали у спирті зростаючих концентрацій (від 70 до 96 °), вкладали у парафін, а потім розрізали товщиною 5–6 мкм і фарбували гематоксилін-еозином. Патолог, засліплений груповим розподілом, провів гістологічний аналіз предметних стекол за допомогою світлової мікроскопії («Олімп», Японія). Для оцінки морфологічних змін у печінці ми використовували NAS (показник активності NAFLD), який включає гістологічні особливості і визначався як незважена сума балів за стеатоз (0–3), часточне запалення (0–3) та балонування (0–2) ). Відповідно до оцінок NAS ≥5 діагностується як безалкогольний стеатогепатит (NASH) та випадки з тестом NAS 2. Різниця між групами була визначена статистично значущою, коли a стор-значення було менше 0,05.
Результати
Ми не виявили суттєвої різниці в біохімічних показниках (аланінтрасаміназа (ALT), аспартат трансаміназа (AST), білірубін) печінки в сироватці крові між інтактною, MSG-ожирінням та групою MSG-пробіотиків (Таблиця 1).
Зміни гістології печінки, оцінені за шкалою NAS, пов’язані із введенням різних типів пробіотиків, представлені в таблиці 2. Для ступеня стеатозу не було значної різниці між групою ожиріння MSG та групами ліофілізованих монокомпонентних пробіотиків (III – V) (Рис. 2а-г). Найвищий прояв стеатозу спостерігався для B. animalis ВКЛ групи (2,0 ± 0,25) порівняно з B. animalis ВКБ (1,70 ± 0,21) та L. casei IMVB-7280 (1,80 ± 0,20). Зміни балів стеатозу між усіма групами монопробіотиків (III – V) були незначними. Введення з народження як живої (VII), так і ліофілізованої (VI) пробіотичної суміші призводить до значного зменшення на 69,5% (стор Таблиця 2 Морфологічні зміни в печінці щурів, оцінені за шкалою активності НАЖХП (NAS)
Легкі мікроскопічні мікрофотографії тканини печінки щурів, пофарбовані гематоксиліном та еозином, × 400. На мікрофотографіях переважно спостерігався мікровезикулярний виражений тотальний стеатоз. a - Група ожиріння, спричинена MSG; b - B. animalis Група ВКЛ; c - B. animalis Група ВКБ; d - L. casei Група IMVB-7280
Легкі мікроскопічні мікрофотографії тканини печінки щурів, пофарбовані гематоксиліном та еозином, × 400. На мікрофотографіях спостерігались переважно вогнищеві легкі мікровезикулярні стеатози. a - Група поліпробіотиків; b - Група симбітерів
Подібно змінам балів стеатозу, ми виявили, що введення як живих, так і ліофілізованих пробіотичних сумішей з 4-го тижня після народження призводить до значного зменшення проявів запалення печінки у зрілому віці у щурів порівняно з однолітками із ожирінням, спричиненим MSG. У розділах гістології печінки спостерігали специфічні ураження NASH. Зокрема, запалення було легким і переважно часточковим, а не портальним, із типово змішаними інфільтратами, які включали хронічні фенотипи запальних клітин, такі як лімфоцити, моноцити (рис. 4а-г). Будь-яких суттєвих змін у часточковому запаленні, оцінених за оцінкою NAS, між групою ожиріння, спричиненою MSG, та ліофілізованими монокомпонентними групами пробіотиків (III – V) не виявлено. Були описані найвизначніші зміни з усіх ліофілізованих груп B. animalis ВКЛ. Тільки в цій групі ми діагностували НАСГ у 10% тварин, що було значущим (стор = 0,026) порівняно з групою ожиріння MSG з 30% тварин з НАСГ. Усі групи, як правило, були відносними у гістологічному викладі дегенерації повітряної кулі через відсутність будь-якої суттєвої різниці (стор > 0,05) (Таблиця 2).
Легкі мікроскопічні мікрофотографії тканини печінки щурів, пофарбовані гематоксиліном та еозином, × 400. На мікрофотографіях мікровезикулярний стеатоз з периваскулярною лейкоцитарною інфільтрацією в зоні 3 (легке часткове запалення) (c, d) та вогнищевий некроз в результаті дегенерації балонів гепатоцитів - відсутність ядер (у центрі) (a, b). a - Група ожиріння, спричинена MSG; b - B. animalis Група ВКЛ; c - B. animalis Група ВКБ; d - L. casei Група IMVB-7280
Найнижчий загальний бал NAS спостерігався після введення живої мультипробіотичної групи (0,8 ± 0,2), яка була незначною у контрольних щурів та статистично нижчою порівняно з усіма групами монопробіотиків (III – V). При використанні ліофілізованої (VI) пробіотичної суміші зміни загального балу NAS серед інших оброблених були незначними.
Паралельно із покращенням загального балу NAS для обох полікомпонентних пробіотичних сумішей ми спостерігали значне зниження вмісту загальних ліпідів та тригліцеридів у печінці приблизно на 22-25% відповідно порівняно з групою ожиріння MSG (рис. 5а та b). Після введення ліофілізованих монокомпонентних пробіотиків (групи III – V) зміни кількості ліпідів печінки були незначними.
Обговорення
Наше дослідження остаточно показало, що короткочасні курси пробіотичних сумішей з народження мають профілактичний вплив на розвиток жирової хвороби печінки за умови ожиріння, спричиненого MSG. Проте терапевтичний потенціал є більш вираженим для живої пробіотичної багатонаправленої суміші (VII), оскільки лише для групи Симбітер були виявлені значно нижчий ступінь стеатозу та загальний бал NAS у порівнянні з монокомпонентними групами пробіотиків (III – V) та будь-які суттєві зміни параметрів оцінки гістології печінки не були виявлені в порівнянні з інтактними щурами.
Зокрема, різні Лактобактерії та Біфідобактерії штами мають специфічний вплив на маркери ожиріння на моделях гризунів. Аналіз даних літератури, опублікованих з січня 2013 року по липень 2014 року Кані та співавт. показали, що принаймні 15 різних штамів Лактобактерії і 3 штами Біфідобактерії не в рівній мірі впливають на печінкові ліпіди та розвиток НАЖХП на різних моделях тварин. Примітно, що 12 штамів зменшували запалення печінкової тканини, а 11 - зменшували вміст тригліцеридів у печінці при одноразовому лікуванні [22].
На відміну від нашого дослідження, де ми не помітили жодних суттєвих специфічних змін у метаболізмі ліпідів та розвитку НАЖХП, недавнє дослідження порівняло ефекти чотирьох Біфідобактерії штами (Біфідобактерії L66-5, L75-4, M13-4 та FS31-12) щодо метаболізму ліпідів у мишей із ожирінням, що страждають ожирінням. Всі чотири штами можуть зменшити тригліцериди сироватки та печінки та значно полегшити відкладення ліпідів у печінці. Що стосується лише загального холестерину Біфідобактерії L66-5 та Біфідобактерії FS31-12 значно зменшив його кількість у печінці [23].
Введення одноштамбового пробіотику Lactobacillus rhamnosus GG захищає мишей від розвитку НАЖХП, викликаного дієтою з високим вмістом фруктози, через збільшення корисних бактерій, відновлення функції кишкового бар'єру та подальше послаблення запалення печінки та стеатозу [24]. Інше дослідження продемонструвало, що лікування з Lactobacillus rhamnosus GG протягом 13 тижнів за умови дієти з високим вмістом жиру покращили чутливість до інсуліну та зменшили накопичення ліпідів, стимулюючи секрецію адипонектину та, як наслідок, активацію AMPK [25].
Крім того, повідомлялося, що пероральний прийом препарату Bifidobacterium adolescentis (5 × 10 (7) КУО/мл) ad libitum протягом 12 тижнів, захищений від індукованого дієтою НАСГ у мишей C57BL/6. Крім того, у мишей, які отримували пробіотик, значно зменшилося пошкодження печінки, що було пов’язано із запобіганням перекисному окисленню ліпідів, активації NFκB і, нарешті, запаленню в печінці [26].
З іншого боку, наші дані знаходять підтримку в іншому недавньому дослідженні, яке встановило, що одноштаммові пробіотики Lactobacillus curvatus HY7601 значно зменшило накопичення жиру в печінці порівняно з Lactobacillus plantarum KY1032 при ожирінні, спричиненому дієтою. Комбінація цього пробіотику була більш ефективною для інгібування експресії генів різних ферментів, відповідальних за синтез жирних кислот у печінці, одночасно зі зниженням активності ферментів, пов’язаних з окисленням жирних кислот, та їх генної експресії [27].
Плаза-Діаз у щурів Цукера з генетично обумовленим ожирінням оцінювала ефекти Lactobacillus paracasei CNCM I-4034, Bifidobacterium breve CNCM I-4035 і Lactobacillus rhamnosus CNCM I-4036 пробіотичні штами та їх суміші на розвиток стеатозу печінки порівняно з плацебо. У цьому дослідженні застосовується лише одноштамбовий пробіотик Lactobacillus rhamnosus або Bifidobacterium breve і суміш Bifidobacterium breve і Lactobacillus paracasei зниження вмісту триацилгліцерину в печінці щурів та зменшення проявів стеатозу печінки частково за рахунок зниження рівня ЛПС у сироватці крові [28].
Пролито трохи світла на основні механізми впливу пробіотиків. Відомо, що симбіотичні бактерії можуть продукувати коротколанцюгові жирні кислоти, напр. бутират. Ця речовина пригнічує активацію залежних від давальницьких рецепторів (TLR) сигнальних каскадів у печінці завдяки посиленню щільного з'єднання кишечника та зменшенню транслокації бактеріального ендотоксину в печінку, що було показано на моделі НАФЛД, спричиненої дієтою західного типу [ 30]. Було встановлено, що бутират запобігає перекисному окисленню ліпідів за рахунок зниження рівня аддуктів 4-гідроксиноненальних білків і знижує регуляцію індуцибельної синтази оксиду азоту, що є критично важливим для регуляції не тільки сигнальних каскадів, залежних від NF-κB, при розвитку NAFLD, але і для експресії TLR -4 ген первинної реакції мієлоїдної диференціації білка на мієлоїдну 88. Таким чином, вироблення бутирату призводить до ослаблення запалення та TLR-залежної сигналізації в печінці в умовах експериментальної НАЖХП [30].
Висновки
Післяпологове введення як живої (VII), так і ліофілізованої (VI) пробіотичної суміші призводить до значного зниження вмісту печінкового стеатозу, загального вмісту ліпідів та тригліцеридів у печінці порівняно з ожирінням MSG і може бути більш корисним, ніж одновидові пробіотики. Таким чином, багатокомпонентні пробіотики мають профілактичну дію на розвиток жирової хвороби печінки. Це може бути пов’язано з більш вираженою життєздатністю живих штамів та запобіганням їм транслокації бактерій. Мультиштампи або різновиди утворювали муталістичні взаємодії в сумішах і, отже, мали змогу ділитися з різними метаболітами, впливати на різні рецептори та утворювати різні біологічно активні сполуки. Отже, їх загальний синергетичний ефект перевищує суму їхніх індивідуальних ефектів. З іншого боку, швидше за все через різні передбачувані механізми дії, специфічні для штаму пробіотики повинні розглядатися для нових досліджень при різних метаболічних захворюваннях.
- Ефективність Allium sativum (часник) проти експериментального криптоспоридіозу - ScienceDirect
- Дієтичні звички та показники ожиріння у пацієнтів із шлунково-стравохідною рефлюксною хворобою порівняльний
- Межі Фармакокінетика, безпека та клінічна ефективність лікування каннабідіолом у
- Повний текст Однорічне дослідження, що оцінює ефективність дієти з обмеженим вмістом йоду при ВМРР
- Здоров'я та медицина Gale OneFile - Документ - Порівняльне дослідження пробіотичних ефектів