Піст
Голодування спричиняє різке зниження концентрації лептину, а наслідки гіпоталамічного ефекту стимулюють апетит.
Пов’язані терміни:
- Інсулін
- Глюкоза
- Рівень глюкози
- Ожиріння
- Рівень глюкози в крові
- Цукровий діабет
- Гіпоглікемія
- Резистентність до інсуліну
- Інсулінонезалежний цукровий діабет
Завантажити у форматі PDF
Про цю сторінку
Скринінг та діагностика діабету II типу
Каміль Мішо, доктор медичних наук, дитячий діабет II типу, 2019
Переваги та проблеми вимірювання глюкози натще
Дані про глюкозу натще забезпечують послідовний, відомий стан оцінки для інтерпретації даних, і було встановлено, що вони демонструють більший прогностичний ризик розвитку діабету. 31 Особи з діагностичним вмістом цукру в крові натще,> 125 мг/дл, все ще можуть бути безсимптомними з приводу гіперглікемії. 1,4,26,27 Рання ідентифікація цукру в крові на діабет при дослідженнях натщесерце може призвести до раннього впровадження лікування та посилення досягнення раннього контролю глікемії. Однак повторне відвідування повного лабораторного моніторингу не завжди гарантується через відповідність пацієнта, і тому воно може спричинити не дані, а оцінку, контрольовану споживанням. Оскільки толерантність до глюкози натще може бути неушкодженою, а порушення толерантності до глюкози неможливо виявити до навантаження на глюкозу, дослідження натще натще можуть пропустити ті, що мають підвищений ризик або наявний діагноз діабету. 32
КЕТОГЕННА ДІЄТА | Дієтичне управління епілепсією: роль глюкози та кетонових тіл
Голодування та кетогенна дієта
Незважаючи на те, що періодичне голодування є ефективним у боротьбі з розладами нападів, періодичне голодування є недоцільним для довгострокового управління нападами, здебільшого через проблеми дотримання. Отже, дієта з низьким вмістом вуглеводів з низьким вмістом вуглеводів (КД) була розроблена для імітації фізіологічних наслідків голодування (кетозу) без суворого обмеження їжі або голодування. KD ефективний при лікуванні нерозв'язних нападів у дітей, а також може бути ефективним при лікуванні розладів нападів у дорослих. Крім того, КД ефективний у зменшенні епілептогенезу та судом на моделях епілепсії на тваринах. Хоча механізми, за допомогою яких КД інгібує сприйнятливість до припадків, залишаються невирішеними, імовірно, що відбуваються зміни в енергетичному обміні мозку.
Роль кетонових тіл (β-гідроксибутират та ацетоацетат) та глюкози у захисних ефектах від нападів голодування або КД активно досліджується. Підвищений рівень кетонів у плазмі крові був пов’язаний із захистом від судом у деяких дослідженнях, але не в інших дослідженнях. Оскільки використання кетонів у мозку може залежати від рівня кетонів у плазмі крові, глюкози та інших метаболітів, асоціація між захистом від нападів та рівнем кетонів у плазмі крові може бути затемнена. Подібним чином, рівень глюкози в крові залишається незмінним під час лікування КД в деяких дослідженнях, але в інших дослідженнях знижується під час лікування. Мало досліджень досліджували взаємозв'язок між кетонами, глюкозою та сприйнятливістю до судом при тривалій протиепілептичній дієті.
Вплив віку, статі, дієти, фізичних вправ та національної приналежності на результати лабораторних досліджень
Зміни клінічних лабораторних значень, пов’язаних з голодуванням/голодуванням
Голодування (зниження споживання калорій) та голодування (відсутність споживання калорій) ініціюють складні метаболічні порушення. Багато людей поститься відповідно до культури та релігійних традицій, тому розуміння наслідків посту на лабораторних результатах є першорядним. Протягом 3 днів голодування концентрація глюкози зростає на 18 мг/дл, незважаючи на скоординовані зусилля організму щодо збереження білків. Згодом інсулін швидко знижується, тоді як секреція глюкагону збільшується, намагаючись відновити рівень глюкози в крові до концентрації до голодування. Особа, що голодує, піддається як ліполізу, так і печінковому кетогенезу. Стан метаболічного ацидозу включає підвищений вміст ацетооцтової кислоти в сироватці крові, β-гідроксибутират та жирні кислоти та знижений pH, pCO2 та бікарбонат. Вогнищевий некроз печінки відповідає за зменшення печінкового кровотоку та порушення клубочкової фільтрації та кліренсу креатиніну; підвищена концентрація АЛТ, АСТ, білірубіну, креатиніну та лактату в сироватці крові [3] .
Знижені запаси енергії в організмі в основному призводять до значного зниження до 50% як загальної, так і вільної концентрації трийодтироніну. Голодування різним чином впливає на концентрацію ліпідів. Протягом 6 днів холестерин і тригліцериди збільшуються, тоді як концентрація ЛПВЩ знижується. Різке збільшення до 15 разів швидкості концентрації гормону росту в плазмі крові відбувається на початку голодування. Протягом 3 днів після закінчення голодування концентрація гормону росту в плазмі крові повертається до попереднього рівня. Концентрації альбуміну, преальбуміну та комплементу 3 знижуються протягом тривалого голодування. Однак споживання білка після голодування швидко повертає альбумін, преальбумін та доповнення 3 до концентрацій, що передують голодуванню.
Голодування викликає вивільнення альдостерону та надмірне виведення з сечею аміаку, кальцію, магнію та калію. На відміну від цього, виведення з організму із сечею фосфору зменшується. Після короткочасного, 14-годинного швидкого, концентрація ацетоацетату, β-гідроксибутирату, лактату та пірувату починає зростати. Тривале голодування, яке триває 40–48 год, спричиняє до 30-кратного збільшення β-гідроксибутирату. Як повідомляється, голодування протягом 4 тижнів суттєво збільшило рівень АСТ, креатиніну та сечової кислоти (20–40%) та зменшило GGT, тригліцериди та сечовину (20–50%).
При достатньому споживанні калорій організм починає відновлювати компоненти крові до концентрації до голодування і утримує натрій в результаті зменшення виведення з сечею як натрію, так і хлориду. Згодом альдостерон перевищує концентрації натще, а виведення з сечею калію повільно повертається до норми.
СПЕЦІАЛЬНІ ВАРІАНТИ У ПЕДІАТРІЧНОГО ХВОРОГО
Дженніфер С.Сінгер, доктор медицини, Ендрю Л.Фрідман, доктор медицини, Ускладнення урологічної хірургії (четверте видання), 2010
Передопераційне голодування
Голодування призначене для мінімізації ризику аспірації шлункового вмісту при введенні анестетика та після операції. У дітей необхідний час голодування повинен збалансувати ризик аспірації та ризик зневоднення, особливо у маленьких немовлят. Найбільш важливі випадки аспірації трапляються у дітей молодшого віку, які проходять термінові або екстрені процедури з приводу непрохідності кишки або кишечника. 24 Помірні випадки аспірації рідко мають значні клінічні наслідки, важливі для нашої переважно амбулаторної популяції пацієнтів. 24 І навпаки, дегідратація ускладнює інтраопераційний венозний доступ та змінює гемодинаміку при введенні анестетика. У таблиці 55-1 представлені поточні рекомендації щодо рекомендованої тривалості голодування залежно від дієти дитини. Пацієнти, які приймаються до операції, можуть доповнюватися внутрішньовенними (IV) рідинами для запобігання зневоднення.
Оцінка безпеки, включаючи поточні та нові проблеми токсикологічної патології
Дієта/Голодування
Голодування, збільшення або зменшення споживання корму та специфічний склад корму можуть впливати на результати експериментів та впливати на результати клінічної патології. Тварини можуть голодувати, щоб зменшити присутність ліпемії у зразках сироватки або плазми, зменшити варіабельність результатів аналітів, чутливих до тривалості голодування, таких як глюкоза та тригліцериди, а також зменшити вміст кишкового тракту до до розтину та забезпечити більш рівномірну гістологію печінки. Існує ряд посилань, що містять інформацію про голодування різних видів, хоча результати різняться залежно від досліджень, найімовірніше, через тривалість голодування, віку, статі та штаму тварин.
При інтерпретації даних клінічної патології важливо враховувати, що деякі групи тварин можуть мати знижену масу тіла та споживання їжі через наслідки прийому досліджуваних виробів, на додаток до нічного голодування. Індуковані голодуванням результати клінічної патології у щурів відповідали гемоконцентрації через зменшення споживання води та зміну харчування та метаболічних функцій, причому більшість змін відбувалися через 16 годин та мінімальні подальші зміни між 16 та 48 годинами голодування.
Нічне голодування щурів може призвести до збільшення еритроцитів, Hgb, Hct, PT та APTT, Cr, білірубіну, AST, SDH та CK та зниження лейкоцитів, сироваткової глюкози, BUN, ALT, ALP, Ca 2+, холестерину, тригліцеридів і вуглекислий газ. Нічне голодування мишей призвело до статистично значущого зниження маси тіла, глюкози (самки) та тригліцеридів, а також збільшення BUN (самці), ALP (самці), AST, CK, Alb, TP та фос. Величина втрати маси тіла та низькі значення глюкози вважалися несприятливими у мишей, які голодували протягом ночі. Миші, як правило, швидко зневоднюють, і не рекомендується нічне голодування мишей.
Ефекти нічного голодування, годування або добавок сахарози до вскрыття досліджували на щурах. Зниження активності ALP у сироватці крові було визнано у щурів після голодування або обмеження корму, і, швидше за все, це пов’язано зі зменшенням ALP кишкового походження, що є основною формою ALP в циркуляції у щурів. Зниження ALP внаслідок зменшення споживання їжі проілюстровано в таблиці 29.5. Запропоновано забезпечити щурам простий вуглевод протягом ночі, щоб мінімізувати наслідки відмови від їжі. Глюкоза в крові, BUN, ALP, ALT та ваги печінки, а також гістологія печінки та підшлункової залози відрізнялися у щурів, які отримували сахарозу, порівняно з щурами, що голодували або годували чау, і ці зміни, як вважали, могли вплинути на результати дослідження; тому не рекомендували вводити сахарозу.
Результати 2-тижневого дослідження обмеження їжі на щурах показали зниження рівня лейкоцитів, лімфоцитів та тромбоцитів, зниження рівня тригліцеридів, холестерину, ТР, АЛАТ та АЛП, підвищення рівня білірубіну в сироватці крові та порушення електролітів. Ще одне двотижневе дослідження обмеження кормів у щурів Спраг-Доулі відзначало концентрацію гемоконцентрації, зниження рівня глюкози, підвищення рівня АЛФ, АЛАТ і АСТ та гемоглобінурію в групі, що мала суворе обмеження. Ефекти обмеження корму на сироваткові AST, ALT та ALP у щурів змінюються згідно з різними опублікованими посиланнями.
Голодування та голодування: біохімічні аспекти
Тривалий піст
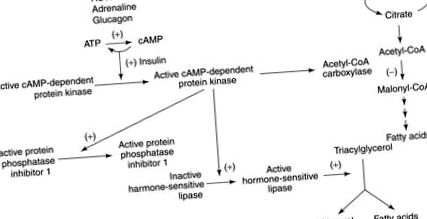
Малюнок 7. Ліполіз стимулюється дією глюкагону, АКТГ та адреналіну. Цей ефект опосередковується циклічною АМФ-залежною протеїнкіназою.
Зі збільшенням окиснення жирних кислот і утворення кетонових тіл відбувається зменшення вироблення глюкози та окислення, зумовлене зниженою регуляцією активності комплексу піруватдегідрогенази. Після 3-тижневого голодування за допомогою позитронно-емісійної томографії спостерігається помітне зниження метаболізму глюкози у всьому мозку. Поглинання мозку мозку вдвічі зменшується через 5 тижнів.
Після періоду голодування більше 3 тижнів процес метаболічної адаптації до голоду завершується. Глюконеогенез та гліколіз були мінімізовані паралельно збільшенню виробництва печінкового кетону. Нирка стає головним глюконеогенним органом і виробляє половину потреб організму в глюкозі. Глютамін є переважним субстратом для глюконеогенезу нирок, а азотний продукт цього процесу забезпечує аміак, необхідний для буферування кетокислот у сечі. Це економить енергію порівняно з енергоємним утилізацією аміаку за допомогою циклу печінкової сечовини. В результаті втрати азоту в сечі зменшуються до 4–6 г на добу -1. Дві третини споживання палива в мозку складаються з кетонових тіл, тим самим помітно зменшуючи потребу в протеолізі м’язів для забезпечення глюконеогенних попередників. При тривалому голодуванні м’язи змінюються від виробництва кетонових тіл до окислення жирних кислот.
По завершенні адаптації відбувається повільне та постійне виснаження білкового відділу та розпад жирової тканини. Смерть настане, коли не вдається поповнити запаси палива за допомогою підживлення та недостатньо доступної енергії для підтримки основних функцій організму. Оскільки жир є основним джерелом енергії, час до смерті при неускладненому голодуванні буде залежати від розміру запасів жиру, що передують. У нормальної дорослої людини запасів жиру буде достатньо для підтримки життя приблизно 60–70 днів. Ступінь втрати білка також пов'язана з виживанням, а втрата більше половини відділу м'язової маси тіла (приблизно половина всього білка в організмі) передбачає смерть.
Цукровий діабет - огляд
Thundiparambil Azeez Sonia, Chandra P. Sharma, in Oral Delivery of Insulin, 2014
1.6 Діагностика цукрового діабету
Середній нормальний рівень глюкози в крові у людини коливається протягом доби. Однак людям старше 30 років рекомендується часом перевіряти рівень глюкози для діагностики діабету.
Для діагностики використовуються наступні тести.
1.6.1 Тест на вміст глюкози в плазмі натще (FPG)
FPG вимірює рівень глюкози людини, яка нічого не їла принаймні 8 годин [63]. Цей тест використовується для виявлення діабету та переддіабету. Завдяки своїй зручності та низькій вартості, FPG є найкращим тестом для діагностики діабету.
1.6.2 Пероральний тест на толерантність до глюкози (OGTT)
Вимірює рівень глюкози в крові людини, яка голодувала щонайменше 8 год та через 2 год після того, як людина випила глюкозосодержащий напій [64]. Цей тест можна використовувати для діагностики діабету, переддіабету та гестаційного діабету.
1.6.3 Випадковий тест на глюкозу в плазмі крові або випадковий цукор
Також називається випадковим тестом на глюкозу в плазмі крові, який вимірює рівень глюкози в крові, не враховуючи, коли особа, яку тестують, їла востаннє [65]. Поряд з оцінкою симптомів, цей тест може бути використаний для діагностики діабету, але не переддіабету.
1.6.4 Тест на глікований гемоглобін або тест A1c або HbA1c
Тест A1c використовується для виявлення діабету 2 типу та переддіабету, але не рекомендується для діагностики діабету 1 типу або гестаційного діабету [66]. Цей тест вимірює середній рівень глюкози в крові людини за останні три місяці і не показує щоденних коливань [67]. Оскільки цей тест можна проводити в будь-який час доби і не вимагає голодування, тест A1c більше підходить для пацієнтів, ніж традиційні тести на глюкозу [30]. Результати тесту A1c зазвичай повідомляються у відсотках. Чим вищий відсоток, тим вищий шанс на діабет [67].
Рекомендується підтверджувати позитивні результати тестів на діабет лише після другого тесту, проведеного в інший день [30].
Терапевтичні напрямки I: Центральна нервова система, біль, метаболічний синдром, урологія, шлунково-кишковий тракт та серцево-судинна система
6.19.3.3.1 Аномалії гомеостазу глюкози
Гіперглікемія натще при T2DM розвивається в основному в результаті збільшення ендогенної продукції глюкози через відносну недостатність інсуліну та печінкову резистентність до інсуліну. Підвищені циркулюючі концентрації глюкагону, жирних кислот та попередників глюконеогенезу посилюють збільшення ендогенної продукції глюкози. У стані голодування периферичне засвоєння глюкози та метаболізм є відносно незалежними від інсуліну процесами. Після їжі глюкоза потрапляє в системний кровообіг через кишкове всмоктування. Зазвичай концентрація глюкози досягає свого піку через 30–60 хв після початку прийому їжі і повертається до основного рівня протягом 2–3 год, головним чином за рахунок придушення вироблення печінкової глюкози та стимуляції периферичного засвоєння глюкози. Підвищений рівень інсуліну пригнічує глюкагон і FFA і зменшує вироблення глюкози в печінці. У T2DM екскурсії глюкозою після їжі перебільшені і тривалі через подвійні дефекти: зниження чутливості до інсуліну та порушення секреції інсуліну. Результатом є субнормальне придушення ендогенного вироблення глюкози та зменшення засвоєння глюкози в м’язах та жировій тканині.
Проксимальна трубчаста обробка фосфату
ПОСТ/ДІАБЕТ
Голодування посилює виведення фосфату з сечею, що пов’язано зі зменшенням канальцевої реабсорбції Пі. Норт-блот-аналіз показав, що голодування протягом 48 годин не призвело до зменшення ниркової експресії мРНК NaPi IIa або NaPi III (13, 43).
Інсулін стимулює котранспорт Na/Pi на межі щітки (52, 67). На узгодження, проксимальна реабсорбція Pi була зменшена при індукованому стрептотоцином цукровому діабеті, хоча без змін мРНК котранспортерів Na/Pi типів IIa або III (43). Більше того, не виявлено зміни кількості чисельності білка котранспортера Na/Pi типу IIa у BBMV. У щурів, які отримували стрептотоцин, адаптивна реакція на дієту з низьким вмістом пі на кількість котранспортерів Na/Pi типу IIa II була притуплена, вказуючи на те, що інсулін може мати дозвільний ефект на реакцію котранспортера Na/Pi типу IIa на зміни дієтичність (63).
Гіпоглікемія у малюка та дитини
Девід Р. Ленґдон, доктор медичних наук,. Марк А. Сперлінг, доктор дитячої ендокринології (четверте видання), 2014
Стійкість до гормону росту та дефіцит IGF-1
Повторювана гіпоглікемія натще поширена у найбільш екстремальній формі стійкості до гормону росту через генетичну відсутність рецептора GH (карликовість Ларона). 300, 301 Гіпоглікемія, як правило, покращується в підлітковому віці, хоча все ще може спостерігатися при тривалому голодуванні. Подібна частота гіпоглікемії (45% і більше) була зареєстрована у двох найбільших популяціях із цим захворюванням в Ізраїлі та Еквадорі, що припускає, що це може бути не повним поясненням нижчих рівнів інтелекту, описаних у ізраїльських пацієнтів. Вразливість до гіпоглікемії натще покращується при лікуванні синтетичним інсуліноподібним фактором росту 1 (мекасермін), хоча одним із інсуліноподібних ефектів лікування може бути гіпоглікемія протягом години після ін’єкції, якщо дитина не їла.
- Про ScienceDirect
- Віддалений доступ
- Магазинний візок
- Рекламуйте
- Зв'язок та підтримка
- Правила та умови
- Політика конфіденційності
Ми використовуємо файли cookie, щоб допомогти забезпечити та покращити наші послуги та адаптувати вміст та рекламу. Продовжуючи, ви погоджуєтесь із використання печива .
- Основна стабільність - огляд тем ScienceDirect
- Підроблення їжі - огляд тем ScienceDirect
- Дидрогестерон - огляд тем ScienceDirect
- Щільність (питома вага) - огляд тем ScienceDirect
- Galliformes - огляд тем ScienceDirect