Підсилення регуляції експресії генів білка 3 у м’язів у мишей після дієти з високим вмістом жиру, дієтичного вживання вітаміну А та лікування гострої ретиноевої кислоти
Анотація
ЦІЛЬ: Проаналізувати вплив добавок вітаміну А як на нормальну жирову (NF) дієту, так і на дієту з високим вмістом жиру (HF), а також на лікування гострої ретиноевої кислоти (RA) на експресію роз’єднуючого білка 3 (UCP3) у мишей.
ДИЗАЙН: Мишей C57BL/6J годували протягом 18 тижнів дієтою NF або HF (відповідно 10 і 45 енергетичних% як жиру), як із нормальним вмістом вітаміну А, так і з надлишком вітаміну А (дієта 8 мг та 320 мг ретинілпальмітату/кг) відповідно). Вага тіла та споживання енергії реєструвались періодично. Рівні мРНК UCP3 та білка UCP3 у скелетних м’язах (soleus/gastrocnemius), а також рівні мРНК UCP1, UCP2 та UCP3 в міжлопатковій коричневій жировій тканині (BAT), а також рівні мРНК UCP2, білків UCP2 та лептин мРНК у складах білої жирової тканини (WAT). Також оцінювали ефект гострого лікування RA (100 мг/кг/добу, 4 дні) на рівні мРНК UCP3 у скелетних м’язах та BAT мишей ЯМР.
РЕЗУЛЬТАТИ: Добавки вітаміну А до дієти NF призвели до підвищення рівня мРНК UCP3 та білка UCP3 у м’язах, мРНК UCP1 у НДТ та мРНК UCP2 у паховій ВАТ, але не вплинуло на масу тіла та ожиріння мишей В6. ВЧ дієта сприяла ожирінню та підвищенню рівня мРНК UCP3 та білка UCP3 в скелетних м’язах, а також іРНК для всіх трьох UCP в НДТ. Доповнення ВЧ-дієти вітаміном А мало впливало на остаточне ожиріння і не призвело до подальшого збільшення мРНК м’язових UCP3 та мРНК BAT UCP1 у порівнянні з рівнями, досягнутими при незміненій ВЧ-дієті. Рівні мРНК жирового лептину знижувались після прийому вітаміну А, незалежно від вмісту жиру в раціоні. Після гострого лікування РА у мишей ЯМР також було виявлено підвищення регуляції м’язів, але не BAT, рівні мРНК UCP3.
ВИСНОВОК: Результати дають докази стимулюючого ефекту ретиноїдів на експресію м’язового UCP3 в природних умовах, і диференціальна ретиноїдна регуляція гена UCP3 у м’язах та BAT.
Вступ
Роз'єднані гени білка 3 (UCP3) і 2 (UCP2) (розглянуті в посиланні 1) були клоновані в 1997 році як гени, що кодують білки з високою послідовністю гомології до UCP1, внутрішнього білка мембрани мітохондрій коричневих адипоцитів, який становить молекулярну основу адаптивних термогенез в коричневій жировій тканині (НДТ). Коли активний, UCP1 може розсіювати енергію як тепло, роз’єднуючи окисне фосфорилювання. 1,2 Різні звіти (див. Посилання 1) показали, що UCP2 та UCP3 знижують потенціал мітохондріальної мембрани при ектопічній експресії у дріжджах, а нещодавно аналіз мишей-нокаутів UCP3 дав докази роз’єднання активності UCP3 в скелетних м’язах в природних умовах, 3,4, хоча результати суперечливі. 5
У цій роботі ми вивчали вплив хронічних дієтичних добавок вітаміну А на експресію UCP і на розвиток ожиріння, спричиненого дієтою, у мишей, схильних до ожиріння. Ми зосередились на UCP3, оскільки його можлива регуляція ретиноїдами раніше не розглядалася в експериментах в природних умовах. Хронічні добавки вітаміну А мало впливали на розвиток ожиріння, спричиненого дієтою, у мишей, схильних до ожиріння, але наші результати показують, що експресія UCP3 у м’язах реагує на дієтичні фактори, зокрема на жир та навантаження вітаміну А в раціоні, диференціальна регуляція UCP3 ретиноїдами в м’язах та BAT.
Методи
Експеримент з добавкою вітаміну А.
Гострий експеримент з лікування РА
Використовували 12-тижневих мишей-самців ЯМР (CRIFFA, Барселона, Іспанія), яких годували регулярною лабораторною чау (Panlab, Барселона, Іспанія) та утримували при 22 ° C з циклом 12:12 год світло-темно. Тварин акліматизували до температури майже нейтралітету (28 ° C) протягом одного тижня, після чого їх випадковим чином розподілили на дві експериментальні групи: тварин, які отримували РА, які отримували щоденну підшкірну ін’єкцію 100 мг/кг загальної транс-РА (Sigma, Мадрид, Іспанія) протягом 4 днів безпосередньо перед тим, як їх було вбито, та контрольних тварин, яким вводили носій (оливкова олія). Було проведено два незалежних експерименти (чотири та п’ять тварин на групу відповідно).
Збір тканин
На початку світлового циклу тварин вбивали СО2 з подальшим вивихом шийки матки та обезголовленням. Кров відбирали з шиї і готували сироватку. Міжлопатковий НДТ (BAT), паховий WAT (iWAT), епідидимальний WAT (eWAT) та заочеревинний WAT (rWAT) були вирізані в цілісності, зважені, швидко заморожені в рідкому азоті та зберігані при -70 ° C; м'яз ніг (gastrocnemius/soleus) також відбирали проби та заморожували в рідкому азоті.
Екстракція РНК та аналіз північного блоттингу
Реагенти та зонди використовувались фірмою Boehringer Mannheim (Барселона, Іспанія). Загальну РНК тканини виділяли за допомогою реагенту Tripure TM, і 10–20 мкг фракціонували за допомогою електрофорезу в агарозному гелі, переносили на нейлонову мембрану шляхом капілярного промокання в 20 × SSC і фіксували ультрафіолетовим світлом, все згідно Roca та ін. 14
РНК, що представляють інтерес, аналізували за допомогою процедури хемілюмінісценції, використовуючи антисмислові олігонуклеотидні зонди, мічені кінцем дигоксигеніном. 31 Були використані такі зонди: для мРНК UCP1, 5 ′ - IndexTerm GTTGGTTTTATTCGTGGTCTCCCAGCATAG-3 ′; 14 для мРНК UCP2, 5 ′ - IndexTerm GGCAGAGTTCATGTATCTCGTCTTGACCAC-3 ′; 14 для мРНК UCP3, 5 ′ - IndexTerm GACTCCTTCTTCCCTGGCGATGGTTCTGTAGG-3 ′; для мРНК лептину, 5 ′ - IndexTerm GGTCTGAGGCAGGGAGCAGCTCTTGGAGAAGGC-3 ′; 32 та для 18S рРНК, 5 ′ - IndexTerm CGCCTGCTGCCTTCCTTGGATGTGGTAGCCG-3 ′. 32
Фіксовані мембрани попередньо гібридизували при 42 ° C протягом 15 хв у DIG-Easy Hyb, а потім гібридизували з відповідним олігонуклеотидним зондом (34 нг/мл, крім зонда 18S рРНК, який використовували при 70 пг/мл) у DIG -Легкий Hyb при температурі 42 ° C протягом ночі і подається на 2 × 15 хв промивання в розчині 2 × SSC/0,1% (мас./Об.) SDS при кімнатній температурі, після чого 2 × 15 хв. Промивання в 0,1 × SSC/0,1% (w/v) SDS при 48 ° C. Після блокування мембрани інкубували з кон'югатом анти-дигоксиген-лужна фосфатаза, потім з хемілюмінесцентним субстратом CDP-Star TM і, нарешті, піддавали впливу Hyperfilm TM ECL (Amersham, Buckinghamshire, UK). Смуги у плівках аналізували за допомогою сканерної фотоденситометрії, кількісно визначали за допомогою програми BioImage (Millipore, Бедфорд, штат Массачусетс, США), і нормалізували за допомогою відповідних значень 18S рРНК. РНК, що представляють інтерес, аналізували послідовно на одній і тій же мембрані після видалення з кип'ятінням 0,1% (мас./Об.) SDS.
Вестерн-блот-аналіз
Зразки заморожених eWAT, iWAT та м'язів ніг гомогенізували у забуференному фосфатом сольовому розчині (137 мМ NaCl, 3 мМ KCl, 6,5 мМ Na2HPO4 та 3,5 мМ KH2PO4) у гомогенізаторі тефлон/скло. Гомогенати центрифугували при 500 g протягом 10 хв при 4 ° C, а загальний вміст білка в супернатантах визначали методом Бредфорда. 33 Білок (50 мкг) фракціонували за допомогою електрофорезу в полі-акриламідному гелі на 10% поліакриламідних гелях згідно з Леммлі 34, а потім електроблотували до нітроцелюлозної мембрани. Фарбування Понсо S дало візуальні докази правильного навантаження та електрофоретичного перенесення білків на нітроцелюлозну мембрану. Блокування та розвиток імуноблотів проводили з використанням посиленої системи аналізу вестерн-блот-методів хемілюмінісценції (Amersham Pharmacia Biotech, Бакінгемшир, Великобританія). Первинні кролячі антитіла проти UCP2 та UCP3 були придбані в Alpha Diagnostics (Сан-Антоніо, Техас, США); специфічність цих антитіл була раніше підтверджена Sivitz та ін. 35 смуг у плівках аналізували за допомогою сканерної фотоденситометрії та кількісно визначали за допомогою програми BioImage (Millipore, Бедфорд, Массачусетс, США).
Визначено інші параметри
М'язові ліпіди визначали за методом Фолча. 36 Рівні нестерифікованих жирних кислот у сироватці крові визначали кількісно, використовуючи колориметричний метод ацил-КоА-синтетази та ацил-КоА-оксидази (Wako Chemicals GmbH, Neuss, Німеччина).
Статистичний аналіз
Значення виражаються як середні значення ± ед. М. У експериментах з добавкою вітаміну А відмінності між групами оцінювали шляхом двостороннього дисперсійного аналізу (ANOVA); Студентська т-тест застосовували для середнього порівняння, коли двостороння ANOVA виявила взаємодію між змінними. В експериментах з гострим лікуванням РА відмінності між контрольними тваринами та тваринами, які отримували TRA, оцінювали за Стьюдентом т-тест. Результати вважалися статистично значущими на P
Результати
Вплив довгострокових добавок вітаміну А на ожиріння, спричинене дієтою, у мишей В6
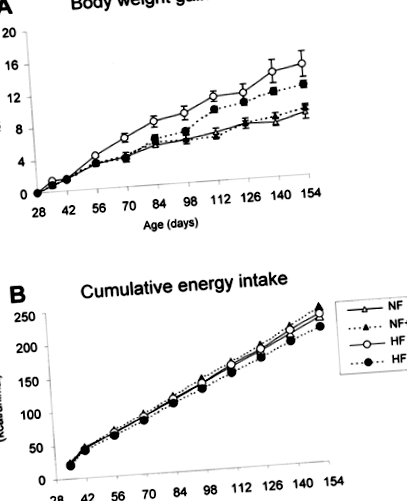
Вплив дієти з високим вмістом жиру та добавок вітаміну А на збільшення маси тіла (А) та кумулятивне споживання енергії (В) мишей В6. Тварин годували звичайною дієтою з нормальним вмістом жиру з вітаміном А (NF), нормальною дієтою з високим вмістом вітаміну A (NF + A), нормальним раціоном з високим вмістом жиру та вітаміном A (HF) або дієтою з високим вмістом жиру з високим вмістом вітаміну A (HF + A ). Детальна інформація про дієти наведена в розділі матеріалів та методів. Дані в А є середніми ± е.м.м. з чотирьох тварин на групу. Споживання енергії оцінювалось на основі клітини (чотири тварини/клітка) протягом 24 годин, від фактичної кількості споживаної тваринами їжі та її калорійної еквівалентності.
Вплив тривалого дієтичного годування з високим вмістом жиру та добавок вітаміну А на експресію лептину та UCP2 у складах WAT мишей В6
Рівні мРНК лептину підвищувались у гіпертрофованих складах iWAT та eWAT у мишей В6 з високим вмістом жиру, що харчувались відповідно до загальновідомої загальної позитивної кореляції між експресією лептину та вмістом жиру, і, як правило, знижувались після дієтичного вживання вітаміну А незалежно від вміст жиру в раціоні, тенденція, яка досягла статистичної значущості в eWAT (таблиця 2).
На рівні мРНК UCP2 у складах WAT не впливали як в iWAT, так і в eWAT під час дієтичного годування з високим вмістом жиру, і вони збільшувались в iWAT після дієтичного вживання вітаміну А, незалежно від вмісту жиру в раціоні (табл. 2). Слід зазначити, що рівні мРНК UCP2 у складах WAT, особливо в iWAT, виявились дуже низькими, напівкількість шляхом північного блот, що вимагає тривалого експонування плівок до плям. Рівні білка UCP2, виміряні за допомогою вестерн-блот, також виявилися дуже низькими, і як в iWAT, так і в eWAT, виявлено, що не впливає дієтичне харчування з високим вмістом жиру або дієтичне вживання вітаміну А (результати не показані). Таким чином, підвищений рівень мРНК UCP2 у iWAT тварин, що отримують вітамін А, не супроводжувався паралельним підвищенням рівня білка UCP2 в тканинах.
Вітамін А доповнює регульовану експресію м’язового UCP3 у мишей В6
Було виявлено, що рівень микроНКР UCP3 в скелетних м’язах підвищений у мишей В6 після 18 тижнів дієтичного вживання вітаміну А при нормальній жировій дієті (на + 116%, значущо т-тест) і, більш помітно (на + 174%), після 18 тижнів дієтичного годування з високим вмістом жиру; існувала чітка тенденція до взаємодії між двома змінними дієти, при цьому регулюючий ефект добавки вітаміну А був очевидним лише при звичайній жировій дієті (рис. 2А). Зміни рівнів білка UCP3 в скелетних м'язах показали схожий профіль із збільшенням у відповідь як на добавки вітаміну А, так і на дієту з високим вмістом жиру, яка не накопичувалась у групі HF + A (рис. 2B). В окремому експерименті ми виявили рівень мРНК в м’язах UCP3 вже збільшився у мишей В6 після 4 тижнів дієтичного вживання вітаміну А при нормальній жировій дієті (на + 124%) та через 4 тижні дієти з високим вмістом жиру (на + 46%); як і в довгостроковому експерименті, в цьому короткостроковому експерименті ефект добавки вітаміну А був очевидним лише за нормальної жирової дієти (відносні рівні експресії: група NF, 100 ± 7; група NF + A, 224 ± 11; Група ВЧ, 146 ± 3; група ВЧ + А, 155 ± 20, n= 4 для кожної групи. Значення ANOVA, P Малюнок 2
Вплив дієти з високим вмістом жиру та добавок вітаміну А на експресію мРНК (A) та білка (B) UCP3 у скелетних м’язах мишей В6. Чотири тижнів мишей В6 годували протягом 18 тижнів нормальною жировою дієтою з нормальним вмістом вітаміну А (група NF), нормальною дієтою з високим вмістом вітаміну А (група NF + A), нормальним вмістом вітаміну А з високим вмістом жиру (група ВЧ) або дієта з високим вмістом жиру та вітаміном А (група HF + A). Детальна інформація про дієти наведена в розділі матеріалів та методів. Дані є середніми ± е.м.м. з 4 тварин на групу і виражаються відносно середнього значення групи NF, яке було встановлене на рівні 100%. Співвідношення кожної мРНК до 18S рРНК були розраховані для корекції кількості РНК. Репрезентативні північні та західні плями показані внизу (А, 20 мкг загальної РНК/доріжки; В, 50 мкг загального білка/доріжки). Значення ANOVA, P †, ВЧ проти NF.
Вплив експериментальних дієт на експресію всіх трьох UCP у БАТ аналізували на рівні мРНК (табл. 3). Довготривала дієта з високим вмістом жиру призвела до підвищення рівня мРНК BAT UCP1, UCP2 та UCP3 (на + 124%, + 66% та + 70% відповідно), тоді як довгострокові добавки вітаміну А мали лише значний вплив на мРНК UCP1 рівнів, які зросли на + 44%. Була негативна взаємодія між двома змінними дієти, що призвело до зниження рівня мРНК BAT UCP1 у групі HF + A, ніж у групі HF.
Гостра RA-терапія регульованої експресії м'язового UCP3 у мишей NMRI
Щоб підтвердити стимулюючий ефект ретиноїдів на експресію UCP3 у м’язах та диференціальну регуляцію UCP3 у м’язах та BAT ретиноїдами, ми проаналізували рівні мРНК м’язів та BAT UCP3 у мишей NMRI, які гостро лікувались загальним транс-RA, порівняно з контролем миші, що приймають лише транспортний засіб. Раніше було показано, що це лікування призводить до втрати ваги тіла, зниження ожиріння та посилення термогенної здатності із збільшенням рівня експресії іРНК як UCP1, так і UCP2 (але не UCP3) у НДТ. 22,28,29 Як показано на малюнку 3, загальне лікування транс-RA призвело до значного збільшення мРНК UCP3 у скелетних м’язах, але, згідно з нашими попередніми результатами, 28 воно не вплинуло на рівень мРНК UCP3 у НДТ. Рівень NEFA в сироватці крові не впливав на лікування RA (контрольні миші: 1,77 ± 0,12 мЕкв/л; миші, оброблені RA: 1,66 ± 0,17 мЕк/л; n= 9 для обох груп).
Обговорення
Наскільки нам відомо, ця робота є першим свідченням регуляції експресії м'язового UCP3 ретиноїдами в природних умовах. Ми виявили цю підвищену регуляцію у відповідь як на гостре лікування РА, так і на дієтичні добавки вітаміну А у двох штамів мишей (В6 та ЯМР), причому як на рівні мРНК, так і на рівні білка. Ці результати узгоджуються з дослідженнями в пробірці демонструє індукцію експресії UCP3 РА у диференційованих міотрубках у культурі клітин. 24,25 Незважаючи на можливість посттранскрипційних ефектів, вплив ретиноїдів на експресію UCP3 може відображати посилену активність гетеродимерів рецептора ретиноїєвої кислоти: рецептора ретиноїду X (RAR: RXR) та/або рецептора, що активується проліфератором пероксисом: RXR ( Гетеродимери PPAR: RXR), для обох елементів відповіді яких описано промотор гена UCP3, 25,39, а також промотор гена UCP1 (див. Посилання 1). Перші гетеродимери трансактивують транскрипцію після зв'язування всього-транс-RA або 9-цис-RA з фрагментом RAR, тоді як останні вимагають зв'язування 9-цис-RA з фрагментом RXR, на додаток до ліганда PPAR, для максимальної транскрипції діяльність. 40,41
Підвищений регулюючий ефект дієтичних добавок вітаміну А та гострого лікування РА на рівні мРНК UCP3 був виявлений у м’язах, але не в НДТ. Тому ретиноїди слід додати до списку гормонів та станів, які різним чином впливають на експресію гена UCP3 у двох тканинах, які включають Т3 та голодування. 42 Можна пояснити кілька гіпотез для пояснення м’язоспецифічного ефекту ретиноїдів. По-перше, стимульована RA експресія гена UCP3 може вимагати взаємодії гетеродимерів RAR: RXR із специфічним для м’язів фактором транскрипції. Насправді в експериментах з трансфекції було показано, що RAR: RXR-опосередкований стимулюючий ефект RA на експресію гена UCP3 повністю залежить від котрансфекції MyoD, 25 головного регулятора диференціації м'язових клітин, який вибірково експресується в клітинах міогенний рід. Інша можливість полягає в тому, що ізоформи RAR та/або RXR диференційовано експресуються в м’язах та BAT опосередковують вплив ретиноїдів на ген UCP3. У цьому контексті повідомлялося, що з трьох відомих ізоформ RXR RXRγ демонструє обмежену експресію в міогенному лінії. 43
Було показано, що примусове підвищення рівня циркулюючого NEFA стимулює експресію UCP3 в м’язах щурів 49, і повідомляється про позитивну кореляцію між концентраціями циркулюючого NEFA та рівнями мРНК в м’язах UCP3 у людей. 50 Однак підвищення регуляції UCP3 в скелетних м'язах у цьому дослідженні, спричинене дієтичним годуванням з високим вмістом жиру, дієтичним введенням вітаміну А або гострим лікуванням РА, не можна пояснити підвищенням рівня циркулюючого НЕФА. Це узгоджується з прямим впливом RA на ген UCP3 і з концепцією, що регулювання експресії UCP3 жиром може бути більше пов'язане з фактичним збільшенням швидкості окислення жиру, ніж з високим рівнем NEFA як такі. Насправді, дослідження на людях під час дієт з високим вмістом жиру показали збільшення окиснення жиру та експресії UCP3 у м’язах, що не супроводжувалося підвищенням рівня циркулюючого NEFA. 47,51
Зниження рівня мРНК жирового лептину у мишей В6, що харчуються дієтами з добавкою вітаміну А, узгоджується з регулюванням рівня мРНК жирового лептину після гострого лікування РА у щурів та мишей 27,28 та зниженням рівня циркулюючого лептину після дієтичного вживання вітаміну А у щурів. 30 Наші результати також дозволяють припустити, що ретиноїди можуть самі по собі чинити інгібуючий ефект на експресію лептину, що не є вторинним щодо зменшення вмісту жиру, оскільки виявлені рівні пригніченого жирового лептину мРНК не корелюють із порівнянним зменшенням маси жирових депо.
Підводячи підсумок, наші результати не підтримують роль м'язового UCP3 як головного детермінанта метаболічної ефективності та енергетичного балансу, відповідно до результатів мишей з дефіцитом UCP3, 3,8, але вони показують, що експресія м'язового UCP3 реагує як на жир, так і на навантаження вітаміну А в раціоні та свідчить про диференційоване регулювання UCP3 ретиноїдами в м’язах та НДТ гризунів.
- Дієта для схуднення Схудліші вправи та план з високим вмістом білка пролили 12-е місце
- Вузькі загар Декссо Бан Високобілкова дієта - Джон Мак-Каллум (липень 1966)
- Вплив короткочасної гіпокалорійної дієти на експресію генів печінки та метаболічні фактори ризику в
- Найкращі ліки для схуднення Високобілкова дієта та схуднення Movimento Rete
- Дієтичний рецепт VegStart Triple Berry Bowl Recipe для сніданку