Підказки баріатричної хірургії: Зміна інсулінорезистентності для зцілення серця
Анотація
Ожиріння - це стан метаболічної дисрегуляції всього організму і головний фактор, що сприяє епідемії інсулінорезистентного діабету. Нефармакологічне лікування ожиріння за допомогою баріатричної хірургії призводить до різкого і майже миттєвого зміни інсулінорезистентності. У цьому огляді колективно розглядаються докази цього явища в літературі та обговорюються потенційні метаболічні та нейрогуморальні механізми. Ми припускаємо, що обмеження поживних речовин знижує захисні механізми клітини від перевантаження поживних речовин в органах, що реагують на інсулін.
Вступ
Ожиріння - це стан метаболічної дисрегуляції всього організму та основний фактор, що сприяє епідемії діабету [1]. Серед американців віком від 20 років старше близько 150 мільйонів людей із надмірною вагою або ожирінням становлять майже половину населення [2]. Хоча Американська діабетична асоціація (ADA) та Всесвітня організація охорони здоров'я (ВООЗ) різняться між собою у визначенні та діагностичних критеріях "переддіабету" або "порушення регуляції глюкози" [3], вони повністю погоджуються щодо руйнівного ожиріння та діабету. має і буде продовжувати надавати медичну допомогу.
Доктор Уолтер Порі почав проводити шунтування шлунка в 1980-х. Він швидко зрозумів, що коли він оперував хворих на цукровий діабет із ожирінням, пацієнтам більше не потрібен інсулін [4]. Крім того, така рання зміна метаболізму глюкози, здавалося, відбулася ще до значної втрати ваги. Коли було вперше запропоновано, уявлення про те, що діабет можна вилікувати шлунковим шунтуванням, здавалося досить дивним. З моменту першої процедури шунтування шлунка минуло 15 років, перш ніж доктор Порі опублікував свої дані, які показують, що серед його когорти діабетиків, що перебуває у 146 людей, 121 (83%) після операції втратив діабет [5].
Цей хірургічний успіх породжує питання про механізми, що лежать в основі зміни інсулінорезистентності після операції зі зниження ваги. Молекулярні механізми, що лежать в основі інсулінорезистентності та метаболічного синдрому, надзвичайно складні, особливо щодо серцево-судинної системи [6–8]. Вплив баріатричної хірургії на резистентність до інсуліну та інші метаболічні маркери ожиріння забезпечили нам шлях до цієї чудової галузі досліджень.
Наслідки резистентності до інсуліну
Інсулінорезистентність визначається як знижена здатність м’язів та інших тканин, що реагують на інсулін, транспортувати глюкозу з кровотоку в клітину [9]. Однак насправді резистентність до інсуліну є метаболічним розладом надзвичайної складності, який ще не до кінця зрозумілий. Резистентність до інсуліну через надлишок поживних речовин - відоме явище [10]. Наприклад, резистентність до інсуліну та змінений метаболізм вільних жирних кислот (ВЖК) є внутрішньо пов’язаними [11]. Підвищений рівень вільних жирних кислот у плазмі та посилений печінковий ліпогенез зазвичай спостерігаються в інсулінорезистентному стані [12] [13]. Крім того, кілька досліджень показали сильний взаємозв'язок між резистентністю до інсуліну та збільшенням вмісту внутрішньоклітинних тригліцеридів за допомогою біопсії м'язів та ядерно-магнітно-резонансної томографії [14, 15]. Ця концепція надзвичайно важлива щодо ліпотоксичності, про яку буде сказано далі.
З 1960-х років відомо, що жирні кислоти конкурують з глюкозою за окислення субстрату; Звичайно вважалося, що ця внутрішньоклітинна війна включає підвищений рівень цитрату та накопичення глюкозо-6-фосфату та пригнічення активності гексокінази II [11]. Інгібування жирних кислот гліколізу в кінцевому підсумку призводить до збільшення внутрішньоклітинних концентрацій глюкози та зменшення споживання глюкози [11]. Цю загальноприйняту гіпотезу оскаржували нещодавно, і зараз вважається, що накопичення метаболітів жирних кислот може безпосередньо перешкоджати передачі сигналів рецепторів інсуліну нижче, зменшуючи активність транспорту глюкози через рецептор GLUT-4 [16].
Найважливішим ефектом інсулінорезистентності є розбіжність у збільшеній подачі субстратів, що забезпечують енергію, та їх зниженому окисленні. По суті, надлишкове надходження палива та зменшення окислення є ключовими ознаками резистентності до інсуліну з глибокими наслідками для клітинного метаболізму. Було запропоновано, що дисбаланс у розподілі між адипоцитом на м’язи та печінку є найбільш відповідальним за порушення обміну глюкози та резистентність до інсуліну. Наслідки ожиріння та резистентності до інсуліну включають високий рівень глюкози та вільних жирних кислот, підвищену концентрацію інсуліну та лептину та низький рівень адипонектину; інші метаболічні маркери включають високий рівень С-реактивного білка (СРБ) та альфа-фактор фактора некрозу пухлини (ФНО) [17].
Минуло досить багато часу, перш ніж експерти досягли консенсусу щодо діагностичних критеріїв метаболічного синдрому [18], і необхідна коротка дискусія щодо метаболічного синдрому в контексті ожиріння та резистентності до інсуліну. Шарнірним пунктом у його визначенні є центральне ожиріння, що проявляється збільшенням окружності талії; інші параметри включають підвищений рівень тригліцеридів, підвищений рівень глюкози в крові та рівень артеріального тиску на додаток до низького рівня холестерину ЛПВЩ. Корисність метаболічного синдрому як предиктора серцево-судинних захворювань (ССЗ) та діабету поділяють не всі. У 2004 році ADA представила звіт, в якому пропонується, що "постачальники повинні уникати маркування пацієнтів терміном метаболічний синдром", стверджуючи, що "дорослих з будь-яким основним фактором ризику ССЗ слід оцінювати на наявність інших факторів ризику ССЗ", і "що всі ССЗ Фактори ризику слід розглядати індивідуально та агресивно »[19]. У той же час критерії метаболічного синдрому існують у людей із ожирінням із нормальною вагою, що метаболічно [20].
Небажання прийняти метаболічний синдром як точну науку є дещо зрозумілим. Наприклад, не всі люди з ожирінням мають резистентність до інсуліну, але існує сильна кореляція між ожирінням та резистентністю до інсуліну. У дослідженні, в якому взяли участь майже 5000 учасників, Національне обстеження здоров’я та харчування (NHANES) [21] класифікувало популяцію пацієнтів за ваговими групами на основі індексу маси тіла (ІМТ). Використовуючи діагностичні критерії метаболічного синдрому, оцінку моделі гомеостазу (HOMA) резистентності до інсуліну та вимірювання СРБ, 32% пацієнтів із ожирінням виявилися «метаболічно здоровими», а 24% осіб із нормальною вагою мали метаболічні відхилення. Що ми робимо із «здорових із метаболізмом» людей із ожирінням, які не виявляють особливостей метаболічного синдрому, крім округлої талії? Відповідь досі незрозуміла.
Зміни метаболізму при баріатричній хірургії
Зміни метаболізму, що супроводжують баріатричну хірургію, таке скасування інсулінорезистентності, відбуваються ще до того, як відбулася значна втрата ваги [22] [23] [24, 25]. Це несподіване відкриття було дещо протиінтуїтивним, але це цілком відомий факт. Не фактична втрата ваги є найбільш відповідальною за поліпшення метаболічного профілю після баріатричної хірургії. У цьому контексті зміна гормонів кишкової залози та їх «перехресні перешкоди» з мозку стали цікавою сферою. Тип хірургічного втручання також відіграє певну роль у прогнозуванні зворотних порушень метаболізму [25, 26]. Довготривале дослідження нещодавно показало, що баріатрична хірургія, ймовірно, є більш ефективною, ніж стандартна допомога у профілактиці діабету 2 типу у людей із ожирінням [27].
Незважаючи на те, що всі форми успішної баріатричної хірургії демонструють поліпшення супутніх захворювань, порушення всмоктування, такі як шлунковий шунтування Roux-en-Y (RYGB), продемонстрували більш різке покращення стану діабету в порівнянні з більш обмежувальними процедурами (тобто шлунковий зв'язок) [28]. . Це доповнює одне з наших попередніх досліджень, яке показало, що порівняно з пацієнтами, які перенесли RYGB, втрата ваги та нормалізація метаболічних показників були менш вираженими через 2 роки у пацієнтів, які перенесли шлунковий зв'язок [26].
Наші попередні дослідження також демонструють різкий зворотний розлад в м’язовому обміні [24]. Перспективна реєстрація включала 43 пацієнтів, які пройшли широке метаболічне та серцево-судинне профілювання, а також біопсію скелетних м’язів, виконану під час операції, 3 та 9 місяців після операції. У таблиці 1 показано зниження рівня глюкози та інсуліну натще, а також покращення чутливості до інсуліну та рівня лептину через 3 місяці після операції. Між 3 та 9 місяцями після операції ми також спостерігали значне зниження концентрації FFA у плазмі крові, тригліцеридів та лептину. Важливо, що покращення обміну глюкози та резистентності до інсуліну були явищем відносно рано сприйнятим.
Таблиця 1
Фізичні та гемодинамічні та метаболічні зміни після операції
| Вимірювання | ||||
| Вага | ||||
| Вага (кг) | 21,5 (18.07–25.00) | 2) | 7,7 (6,70–8,89) | ‡ |
| DBP (мм рт. Ст.) | 3,9 (−1,11–8,95) | 0,12 | 1,7 (−3,45–6,79) | 0,51 |
| ЧСС (уд/хв) | 10,0 (5,53–14,53) | * Середня різниця - це зменшення значення результату, якщо це не позначено негативним значенням. | ||
CI 95% - довірчий інтервал різниці; ІМТ - індекс маси тіла; Талія Коло. - Окружність талії; SBP - систолічний артеріальний тиск; DBP - діастолічний артеріальний тиск; ЧСС - ЧСС; FFA - жирні кислоти, що не містять плазми.
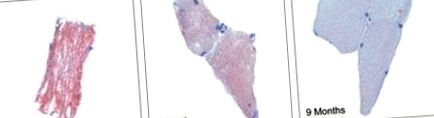
Добре встановлено, що нежирова тканина, така як серце і скелетні м'язи, буде зберігати додаткові жири у вигляді внутрішньоміоклітинних тригліцеридів [29], які досить легко можна гістологічно оцінити за допомогою масляно-червоного плями. На малюнку 1 показано масляно-червоні плями O зразків біопсії скелетних м’язів під час операції, 3 та 9 місяців після операції [24]. Ми продемонстрували вражаюче зменшення фарбування через дев'ять місяців; зменшення фарбування від трьох до дев'яти місяців суттєво корелювало зі зменшенням ваги та маси жиру. Крім того, існує також зв'язок між інтенсивністю фарбування та рівнем FFA у плазмі крові. Зниження внутрішньоміоклітинних тригліцеридів, швидше за все, є наслідком зменшення надходження FFA, збільшення швидкості гідролізу тригліцеридів і збільшення швидкості окислення FFA. Таке явище, швидше за все, є поетапним, складним процесом, спрямованим на скасування наслідків ліпотоксичності.
Масляно-червоний-O пляма біоптатів м’язів. Зразки отримували на початковому рівні, через 3 та 9 місяців після операції. Слайди є репрезентативними для розділів для кожного пацієнта в кожну з часових точок (вихідний рівень, 3 та 9 місяців). Базовий рівень проти 3 місяців 4,2 а.е. (-2,4–10,9), p Haffner S, Taegtmeyer H. Епідемічне ожиріння та метаболічний синдром. Тираж. 2003; 108: 1541–1545. [PubMed] [Google Scholar]
- Зміни у бажаній формі тіла після баріатричної хірургії
- Шеф-кухар Маріо Іццо вважає, що рецепт для схуднення включає баріатричну хірургію
- Зміни сексуальної активності після баріатричної хірургії - Ольде Дель Мар
- Процедура баріатричної хірургії дванадцятипалої кишки
- Дефіцит ”мітохондрій у м’язах не спричиняє інсулінорезистентного діабету