Первинні війки на горизонтальних базальних клітинах регулюють регенерацію нюхового епітелію
Аріелл М. Столяр
1 Кафедра фармакології, Медична школа Мічиганського університету, Ен-Арбор, Мічиган 48109-5632,
Уоррен В. Грін
2 Кафедра фармакології та терапії, Університет Флориди, Медичний коледж, Гейнсвілль, Флорида 32610-0267,
Джеремі К. Макінтайр
2 Кафедра фармакології та терапії, Університет Флориди, Медичний коледж, Гейнсвілль, Флорида 32610-0267,
Бенджамін Л. Аллен
3 Відділ клітинної біології та розвитку, Медичний факультет Університету Мічигану, Ен-Арбор, штат Мічиган 48109-2200, та
Джеймс Е. Швоб
4 Кафедра розвитку, молекулярної та хімічної біології, Медична школа Університету Тафтса, Бостон, штат Массачусетс 02111
Джеффрі Р. Мартенс
1 Кафедра фармакології, Медична школа Мічиганського університету, Ен-Арбор, Мічиган 48109-5632,
2 Кафедра фармакології та терапії, Університет Флориди, Медичний коледж, Гейнсвілль, Флорида 32610-0267,
Вклади авторів: A.M.J., J.C.M. та J.R.M. розроблені дослідження; A.M.J., W.W.G. та J.C.M. виконані дослідження; A.M.J., W.W.G., J.C.M. та J.R.M. проаналізовані дані; A.M.J., W.W.G., J.C.M., B.L.A., J.E.S. та J.R.M. написав роботу.
Анотація
ЗАЯВА ПРО ЗНАЧЕННЯ Ми вперше показуємо присутність первинних війок у спокійній популяції базальних стовбурових клітин, горизонтальних базальних клітин (HBC), в нюховому епітелії (OE). Важливо, що наші дані демонструють, що війки на ГБК необхідні для регенерації ОЕ після травми. Більше того, порушення ресничок HBC змінює нейрогенез під час розвитку ОЕ, забезпечуючи докази того, що HBC беруть участь у встановленні цієї тканини. Ці дані свідчать про те, що механізми проникнення ціліопатій в ОЕ виходять за рамки дефектів нюхових сенсорних нейронів і можуть включати зміни в підтримці та регенерації ОЕ.
Вступ
Нейрогенез відбувається внаслідок самообновлення та диференціації нервових стовбурових клітин (NSCs; Gage, 2000). Незважаючи на те, що НСК поширені в процесі розвитку, також є в нервовій системі дорослих, в нюховому епітелії (ОЕ), субвентрикулярній зоні (СВЗ) бічного шлуночка та субкристалічній зоні гіпокампу (Gage, 2000; Альварес-Буйлла та Гарсія -Вердуго, 2002; Lie et al., 2004). Фактори та механізми, що регулюють проліферацію, міграцію, диференціацію та виживання клітин під час розвитку, можуть бути активними в нервовій системі дорослих, дозволяючи відновлення тканин та нейропластичність (огляд див. Lie et al., 2004). На відміну від більшості сенсорних систем, ОЕ здатний відновлювати як нейронні, так і ненейронні популяції після пошкодження та загибелі нейронів за допомогою дії резидентних популяцій нюхових стовбурових клітин (Graziadei and Graziadei, 1979; Calof and Chikaraishi, 1989; Edge and Chen, 2008). Нюхові сенсорні нейрони (OSN) унікальні тим, що вони безпосередньо контактують як із зовнішнім середовищем, так і з мозком. Хоча цей прямий контакт дозволяє ОСН виявляти запахи, він також піддає ОЕ образам токсинів, бактерій та вірусів, що призводять до загибелі клітин. Тому здатність до нейрогенезу та заміни ОСН є критично важливою для підтримки цієї важливої сенсорної системи.
Первинні вії відіграють важливу роль у проліферації, диференціації та регуляції клітинного циклу (для огляду див. Irigoín and Badano, 2011). Зростає кількість доказів того, що первинні вії регулюють нейрогенез та/або правильну диференціацію стовбурових клітин дорослих на ампліфікуючі клітини-попередники або гліальні клітини в SVZ та гіпокампі (Amador-Arjona et al., 2011; Kumamoto et al., 2012; Tong et al. ., 2014). Отже, коли в цих системах порушені війки, також порушуються опосередковані війками сигнальні шляхи, такі як звуковий їжак, та модульовані віями сигнальні шляхи, такі як Wnt (Kumamoto et al., 2012; Tong et al., 2014) . Ці висновки демонструють важливу роль, яку інфузорії відіграють у сигнальних шляхах, необхідних для правильної диференціації клітин під час розвитку та гомеостазу дорослих.
Тут ми показуємо, що HBC мають первинні вії, що припускає потенційний механізм молекулярної регуляції нюхових базальних стовбурових клітин в ОЕ. У мишей, у яких HBC не мали війок, ОЕ продемонстрував обмежену регенерацію після ураження зі значним зменшенням зрілих ОСН. Крім того, коли віруси HBC були видалені на початку розвитку, було виявлено, що конкретні регіони ОЕ мають значне зменшення OSN. Ці дані визначають реснички HBC як раніше невпізнану сигнальну структуру в ОЕ, забезпечують механістичне розуміння регуляції ГБК під час нюхової регенерації та вказують на потенційну роль ГБК у розвитку ОЕ.
Матеріали і методи
Штами миші та генотипування.
Індукція трансгеном доксицикліну та ураження нюхового епітелію.
Мишей годували доксицикліновим чау (200 мг/кг доксицикліну, Bio-Serv) та водою (200 мкг/мл доксицикліну, 5% сахарози, Thermo Fisher), починаючи з ембріонального 16-го дня (E16) або постнатального 28-го дня (P28) і залишалися на дієті, що містить доксициклін, доки їх не вбили. Виходячи із приблизного щоденного споживання їжі 4 г/мишу та споживання води 6 мл/мишу (Бахманов та ін., 2002), миші споживали ∼2 мг доксицикліну/добу (0,8 мг у чау-чані та 1,2 мг у воді). Оброблені доксицикліном P28 миші K5rtTA; TetOcre; миші Ift88 fl/fl або K5rtTA; TetOcre; миші Arl13b fl/fl та відповідні контрольні однолітки отримали внутрішньочеревну ін'єкцію метимазолу (2-меркапто-1-метилімідазол, 75 мг/кг у стерилізованому 1 × PBS; Sigma-Aldrich) через 4 тижні після початку дієти, що містить доксициклін. Ці миші перебували на дієті, що містить доксициклін, до тих пір, поки їх не вбили через 8 тижнів після лікування метимазолом.
Збір і підготовка тканин.
Мишей знеболювали 30% флурізо (ізофлуран, VetOne), перкардіровали перфузію 4% параформальдегідом (PFA) і обезголовлювали, і їх голови фіксували в 4% PFA протягом 12-16 годин при 4 ° C. Потім тканину декальцинировали в 0,5 м EDTA (Thermo Fisher)/1 × PBS протягом ночі при 4 ° C; кріозахищений через 10% (1 год), 20% (1 год) і 30% сахарози/1 × PBS протягом ночі при 4 ° C; і заморожений у сполуці OCT (Tissue Tek). Зрізи нюхового епітелію та нюхової цибулини (ОВ) розміром 10–12 мкм збирали на кріостаті Leica CM1860.
Імуногістохімія.
Для виявлення Cre зрізи тканини промивали в 1 × PBS для видалення ОСТ, калюжили з цитратним буфером і пропарювали протягом 10 хв у скляній банці на гарячій водяній бані. Зрізи блокували 2% ослиної або козячої сироватки/5% сухого нежирного молока/4% BSA/1% TTX100 в 1 × PBS і інкубували протягом ночі в первинному антитілі. Для виявлення GFP зрізи тканини промивали в 1 × PBS для видалення OCT, калюжили з цитратним буфером і пропарювали протягом 10 хв у скляній банці на гарячій водяній бані. Зрізи блокували 2% ослячої або козячої сироватки/0,3% TTX100 в 1 × PBS і інкубували протягом ночі в первинному антитілі. Для потрійного фарбування MASH1, SEC8 та LSD1 або OMP та ATub мишачі антитіла або OMP інкубували разом протягом ночі, а LSD1 або ATub, відповідно, інкубували протягом 1 години наступного дня.
Обробка та кількісна оцінка зображень.
Зображення були зроблені за допомогою конфокального мікроскопа Nikon A1R. Програмне забезпечення ImageJ використовувалося для вимірювання довжини ОЕ (у мікрометрах) на кожному зображенні, для підрахунку певних типів комірок за допомогою плагіна лічильника клітин та вимірювання інтенсивності TH. Для кількісної оцінки типів клітин було зроблено 10–15 зображень із дорсально-медіальної, дорсально-латеральної, вентрально-медіальної та вентрально-латеральної областей через три-чотири ділянки ОЕ. Кількість клітин усереднювали і перетворювали на кількість клітин на міліметр ОЕ. Кількісне визначення проводили для N = 3–6 мишей у всіх контрольних групах, iHBC-IFT88 та iHBC-ARL13B, якщо не зазначено інше. Повідомлені значення N представляють кількість обстежених мишей. Вимірювання інтенсивності TH було кількісно визначено для всіх клубочків у кожному з трьох-чотирьох ділянок OB у чотирьох iHBC-IFT88 та чотирьох контрольних мишах за допомогою програмного забезпечення ImageJ. Сліпа експериментальна парадигма була використана для усунення упередженості під час обробки зображень та кількісної оцінки.
Статистика.
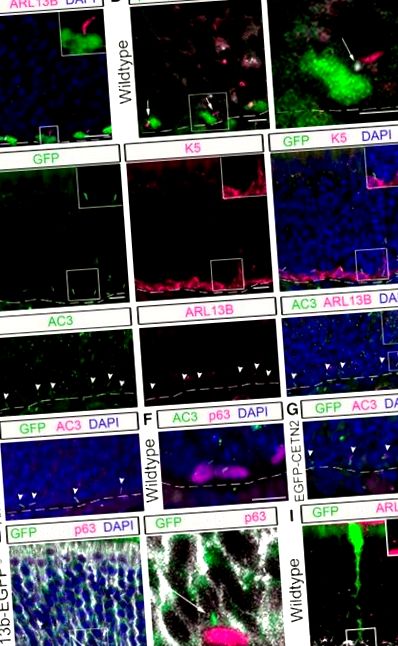
В ОЕ апікально розташовані клітини SUS мають виступи, відомі як кінцеві стопи, які супроводжують нюхові базальні клітини на шляху до контакту з базальною пластиною (Doyle et al., 2001). Мета цих зв’язків ще не з’ясована; однак було висловлено припущення, що це місце для спілкування між базальними клітинами та клітинами SUS (Jia та Hegg, 2010). Під час нашого аналізу ми спостерігали, що більшість війок HBC проектуються від вершини HBC до кінця стопи клітини SUS. Щоб визначити, чи були реснички HBC асоційовані з кінцевими стопами клітин SUS, аналіз p63 + HBC і клітин SUS, імуномічених K18 (Holbrook et al., 2011), проводили у мишей Arg13b-EGFP tg. Як видно на репрезентативному зображенні (рис. 1 Н), війки, що виступають з ГБК, розташовані в кінці стопи. Щоб поліпшити роздільну здатність однієї кінцівки стопи SUS, ми проаналізували ОЕ мишей, яким інтраназально вводили аденовірус, що експресує GFP, в якому трансдукується невелика частина клітин SUS (для методів див. McIntyre et al., 2012). Використовуючи такий підхід, стає зрозумілим, що миготливий віск ARL13B + виходить у проміжний простір між клітиною HBC та SUS (рис. 1 I). Ці дані свідчать про можливість війок діяти як антена для зв'язку між базальними клітинами та клітинами SUS, можливо, способом, аналогічним імунологічному синапсу (Bromley et al., 2001; Finetti et al., 2011).
Війки присутні в окремих субпопуляціях нюхових стовбурових клітин
HBC - це переважаючі миготливі нюхові базальні стовбурові клітини. Імунофлуоресцентне фарбування проводили в нюховому епітелії мишей дикого типу. A, Канонічний маркер GBC MASH1 колокалізується з підмножиною SEC8 + GBC, тоді як LSD1 колокалізується з більшим підмножиною SEC8 + GBC. B, Нечисленні GBC, позначені SEC8, мають мічені ARL13B війки (див. Стрілки) порівняно з HBC, мічені K5 (вставка, збільшене зображення). Стрижні шкали, 10 мкм. Пунктирна лінія, базальна мембрана. † Випадкові мігруючі GBC. C., Кількісні дані клітин SEC8 +, які є або MASH1 + (N = 4), або LSD1 + (N = 4). D, Відсоток HBC (N = 6) та GBC (N = 6), які мають вії. **** p fl/fl і K5rtTA; TetOCre; Ift88 fl/Δ) і надалі іменуються мишами iHBC-IFT88, тоді як миші дикого типу (K5rtTA; TetOCre; Ift88 fl/wt) і далі - контрольними мишами.
Контролю та мишам iHBC-IFT88 вводили дієту, що містить докс, для активації експресії Cre (Gunther et al., 2002; Grachtchouk et al., 2011) при P28, коли ОЕ дозріла (Murdoch and Roskams, 2007). Через тиждень після введення доксу, ~ 90% HBC у мишей з алелями TetOCre і K5rtTA показали експресію Cre (рис. 3 А). Експресія Cre не була виявлена у HBC мишей, у яких не було алелю TetOCre (рис. 3 B). Що ще важливіше, миші iHBC-IFT88 продемонстрували значну втрату (88,5%) миготливих HBC після 4 тижнів вживання дієти, що містить докс (рис. 3 C, D; N = 5). Цікаво, що втрата інфузорій не призвела до зміни кількості HBC (рис. 3 E; N = 5). Імунофарбування зрілим маркером OSN OMP та ацетильованим α-тубуліном (Acet-Tub) не виявило змін у складі OSN (рис. 3 F). Збільшення втрат інфузорій на ГБК (95,6%) було виявлено через 8 тижнів введення доксу (рис. 4 А, Б), без впливу на кількість ГБК (рис. 4 С), ГБК (рис. 4 D, E) та OSN (рис. 4 F, G; контрольні миші, N = 2; миші iHBC-IFT88, N = 4). Ці дані демонструють, що генетична абляція Ift88 ефективно видаляє війки з HBC, не змінюючи спокою HBC або звичайного підтримання OE.
- Насиплені кремнеземом мезохімічні стовбурові клітини, закріплені до доксорубіцином, для пухлинно-тропічної терапії ACS Nano
- За пряму первинну медичну допомогу Parsley Health бере 150 доларів на місяць - Business Insider
- RSK2 захищає клітини раку молочної залози людини під впливом ендоплазматичного ретикулума шляхом активації
- Здійснення стискання жирових клітин - ScienceDaily
- Розлади запаху (нюху) - Аносмія, Фантосмія та інші NIDCD