Остеопетроз, гіпофосфатемія та фосфатурія у молодої людини: презентація випадку та диференціальна діагностика
1 Медичний факультет, Медична школа Університету Еморі, 101 Вудрафф Кругл NE, Атланта, Джорджія 30322, США
2 Відділ ендокринології, метаболізму та ліпідів, Медичний факультет, Медичний факультет та Медичний центр Атланти, Університет Еморі, Декатур, штат Джорджія 30300, США
Анотація
Ми повідомляємо про випадок 30-річного чоловіка-афроамериканця з остеопетрозом та гіпофосфатемією, який страждає на дифузні міалгії. Проведена лабораторна оцінка показала низький рівень фосфору в сироватці крові при втраті фосфатів у сечі, низькій концентрації кальцію та 25-гідроксивітаміну D, а також підвищену лужну фосфатазу. Рентгенограми черепа та тазу виявили високу щільність кісткової тканини, що відповідає високій кістковій масі, виявленій у звітах про мінеральну щільність кісток. Аналіз мутації гена PHEX був негативним. Пацієнту розпочали заміщення кальцію та фосфору, і він клінічно покращився. У цій роботі буде розглянуто різні підтипи остеопетрозу та оцінка гіпофосфатемії.
1. Вступ
У цьому рукописі буде представлено випадок 30-річного чоловіка-афроамериканця, який звернувся до лікаря з дифузними міалгіями та кістковим болем. Спочатку пацієнта лікували симптоматично від болю в стегнах, який поступово погіршувався і був пов’язаний із втратою слуху та розладами зору. Його направили на подальшу оцінку, коли було виявлено подвійний діагноз: остеопетроз та гіпофосфатемія. Ця стаття в основному буде зосереджена на діагностичній оцінці та диференційованості для кожного стану, а також на потенційному об'єднуючому діагнозі.
2. Презентація справи
Його сімейна історія важлива для молодшого брата з дифузними болями в кістках та головними болями, а також низьким вмістом фосфору в сироватці крові. Його брат не проводив подальших обробок. Він повідомляє про одного двоюрідного брата та племінника із схиленими ногами та невисоким зростом, а другого двоюрідного брата, який страждає від сильного болю в опорно-руховому апараті та низького зросту. Жоден з членів сім'ї не пройшов оцінку щодо причин їх низького зросту або м'язово-скелетного болю. Жодна жінка не постраждала в сім'ї, і всі постраждалі особи походять з материнської сторони.
Спочатку йому призначили заміну кальцію та знеболюючі препарати. Йому також порадили кинути військову службу. Пацієнт не покращив лікування та звернувся за другою думкою до дитячого ендокринолога. Початкові тести були повторені, включаючи мінеральну щільність кісткової тканини, що підтвердило діагноз високої мінеральної щільності кісткової тканини. Додаткове тестування виявило низький вміст фосфору в сироватці крові та низький фосфор у сечі протягом доби. Його канальцева максимальна реабсорбція фосфору на швидкість клубочкової фільтрації (TMP/GFR) становила 1,1 мг/дл (2,6–4,4 мг/дл). Він розпочав прийом кальцитріолу та фосфату калію/фосфату натрію.
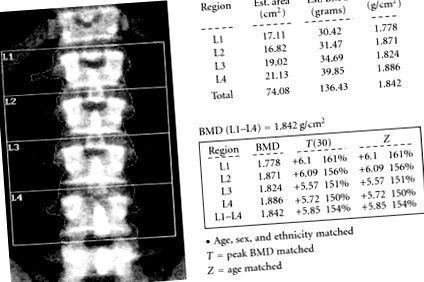
Пацієнта направили до нашого закладу приблизно через два роки після первинного представлення. Повторне вимірювання щільності кісткової тканини методом DEXA виявило високу щільність кісткової тканини в загальному стегні (+2,31 Т-оцінка) та у хребетному хребті (L1 – L4) (+5,85 Т-оцінка) (рисунок 1). Рентгенограми його черепа були чудовими для товстого кальварію з нормальною та симетричною щільністю (рис. 2). Огляд скелета та обстеження поперекового відділу хребта були в межах норми. Пацієнт мав нормальний вміст кальцію в сироватці крові (9,7 мг/дл), фосфор у сироватці з низьким вмістом голоду (1,8 мг/дл) (2,4–4,5 мг/дл) і 24-годинний збір сечі, який демонстрував втрату фосфатів (2666,38 мг/24 години) ( 800–2000 мг/24 години). Його 25-гідроксивітамін D становив 17 нг/мл (30-100 нг/мл). Його концентрація ПТГ була в межах норми 46 пг/мл (15–65 пг/мл), а рівень лужної фосфатази був підвищений до 139 МО/л (30–115 МО/л). Подальше досліджували гіпофосфатемію за допомогою секвенування ДНК, шукаючи потенційну мутацію гена PHEX. Двадцять два сегменти послідовності PHEX були виявлені негативними щодо значущої мутації PHEX.
Йому починали приймати кальцитріол по 0,25 мкг двічі на день, фосфат калію/фосфат натрію (250 мг фосфору) кожні 3 години до 8 разів на день. Йому давали ергокальциферол 50 000 МО один раз на тиждень через його дефіцит вітаміну D, що покращило його сироватку 25 (OH) D до 27 нг/мл Він підтримує кальцитріол по 0,75 мкг двічі на день і фосфору 225 мкг 4 рази на день. Його біль покращується і приймає лише трамадол, що трапляється при опорно-руховому болі. З тих пір у нього все було добре, він страждав лише від періодичного м’язово-скелетного болю, не заважаючи його повсякденній діяльності.
3. Обговорення
3.1. Остеопетроз
Остеопетроз включає клінічно та генетично неоднорідну групу захворювань, що мають спільну ознаку підвищеної щільності кісток на рентгенограмах. Підвищена щільність кісток може бути нормальною знахідкою, коли вона присутня у всьому скелеті у гімнасток та інших спортсменів. Однак асиметричне збільшення щільності або висоти кісток набагато вище норми, як правило, пов'язане з певною основною патологією. Підвищена щільність кісткової тканини при остеопетрозі є наслідком відхилень у диференціації або функції остеокластів [1].
Існує кілька різних типів остеопетрозу, серед яких 2 найпоширенішими є доброякісний аутосомно-домінантний тип та рецесивний злоякісний тип [1]. Остеопетроз викликає неоднорідність симптомів залежно від конкретної мутації, яка лежить в основі кожної форми захворювання [1].
Аутосомно-рецесивний тип (ARO), як правило, проявляється в грудному віці, викликаючи анемію, лейкопенію, гепатомегалію та нездатність процвітати, а також симптоми черепно-мозкових нервів, що іноді призводять до ранньої смерті [2]. Варіант ARO зустрічається вторинно по відношенню до дефекту ферменту карбоангідрази II (CAII), відомого як "синдром мармурового мозку" [3]. Він має легший перебіг із супутнім канальцевим ацидозом нирок (RTA) та мозковими кальцинатами [3]. Інші клінічні прояви включають підвищену частоту переломів, низький зріст, аномалії зубів, здавлення черепно-мозкового нерва та затримку розвитку [3]. Нервова недостатність при остеопетрозі, що виявляється у вигляді розумової відсталості та втрати зору та слуху, швидше за все, є вторинною внаслідок здавлення нерва шляхом звуження нервових отворів [4]. Хворі ARO зазвичай мали висококісткову лужну фосфатазу (BALP) [2]. Канальцевий ацидоз також був описаний як вторинна мутація подвійного гена, одна в гені ATP6i, а інша в гені ATPV1B1, що кодує специфічну для нирок субодиницю B1 вакуолярної H + -ATPase [5]. Лабораторна оцінка у нашого пацієнта не виявила жодних доказів RTA. Він не страждав від розумової відсталості, і його огляд скелета не виявив жодних переломів.
Автосомно-домінантний тип, також відомий як хвороба Альберса-Шонберга, має 2 основних підтипи, а саме ADO-I та ADO-II, ADO II є найбільш поширеною формою. Існує припущення, що мутації білка 5, пов’язаного з ліпопротеїновими рецепторами низької щільності (LRP5), важливих для функції остеокластів, можливо пов’язані з ADO-I [6, 7], тоді як мутації гена CLCN7 нещодавно лежать в основі ADO -II, що виробляє широкий спектр тяжкості захворювання [8, 9].
Ці 2 форми відрізняються рентгенологічними та клінічними характеристиками. ADO-II характеризується потовщенням кінцевих пластин хребців та ендокостей в малому тазу, тоді як у ADO-I пацієнти зазвичай мають виражений остеосклероз склепіння черепа. ADO-I, швидше за все, не зазнає переломів [6, 10]. Також було відзначено, що у пацієнтів з ADO-II підвищений рівень креатинінкінази BB [11], підвищений вміст тартратфосфатази в сироватці крові та низький рівень BALP. У нашого пацієнта не було класичних рентгенологічних ознак ADO-I або ADO-II. У нашого пацієнта в більш пізньому віці було більш доброякісне передлежання. Це свідчить про більш м’яку форму АДО.
3.2. Гіпофосфатемія
4. Співіснування підвищеної щільності кісток, гіпофосфатемії та фосфатурії
У нашого пацієнта спостерігався парадокс збільшення щільності кісткової тканини зі зниженням міцності кісток, що проявляється як підвищений показник МЩКТ із переломом хребця Т11. У його фільмах не було виявлено жодного з класичних рентгенологічних ознак, щоб розрізняти ADO-I або ADO-II. Також у пацієнта спостерігалася гіпофосфатемія та втрата фосфату сечі. Лабораторна оцінка потенційної мутації гена PHEX була негативною. ПТГ пацієнта знаходився в межах норми, і він не застосовував жодних діуретиків, що робить їх менш вірогідними для нашого диференціалу. Він також страждав від дефіциту вітаміну D, але не мав жодних клінічних ознак рахіту.
Інший потенційний діагноз у нашого пацієнта включає ARO, вторинний до дефіциту CAII. Однак він не виявляє жодних доказів канальцевого ацидозу нирок із нормальним вмістом бікарбонату в сироватці від 28 до 31 ммоль/л. Повідомлялося про випадки дефіциту CAII без RTA, але цей клас пацієнтів страждав від розумової відсталості. Наш пацієнт має нормальний психічний розвиток; він закінчив коледж і є соціальним працівником. Більше того, у нього немає переломів кісток або важкого прикусу зубів [19, 20].
5. Висновок
Ми представили випадок, коли молода людина страждає як на остеопетроз, так і з гіпофосфатемією. У нього був дефіцит вітаміну D, але він ніколи не страждав клінічно рахітом. У нього також не було рентгенологічних висновків, що свідчать про остеомаляцію. Біохімічні оцінки цього пацієнта були чудовими для легкої анемії, підвищеного рівня лужної фосфатази, низького рівня фосфатів у плазмі крові з витратою фосфатів у сечі та рентгенологічно підвищеної мінеральної щільності кісток. У пацієнта не було мутації гена PHEX. Пацієнт представився в більш пізньому віці і добре реагував на терапію. Він також не мав класичних висновків щодо аутосомно-рецесивного остеопетрозу, який є більш важким і спостерігається у набагато більш ранньому віці. З огляду на ці висновки, ймовірно, що наш пацієнт страждає на легку форму аутосомно-домінантного остеопетрозу. На жаль, для підтвердження наших клінічних підозр у нас не було ДНК-тестування. Наш пацієнт повідомив про покращення скелетного болю за допомогою добавок кальцію та фосфору.
Фінансування
Цей документ був підтриманий грантом NIH. K23AR054334/NIH/NIAMS.
Застереження
Цей документ раніше не був представлений у будь-якій формі.
Список літератури
- З. Старк і Р. Саварірайян, "Остеопетроз", Orphanet Journal з рідкісних хвороб, вип. 4, № 1, стаття 5, 2009. Переглянути на: Сайт видавця | Google Scholar
- Д.М. Браун та П.Б. Дент, “Патогенез остеопетрозу: порівняння спектрів людини та тварин”, Дитячі дослідження, вип. 5, с. 181–191, 1971. Перегляд за адресою: Google Scholar
- C. Jacquemin, P. Mullaney та E. Svedberg, «Синдром мармурового мозку: остеопетроз, нирковий ацидоз та кальцифікація мозку» Нейрорадіологія, вип. 40, № 10, с. 662–663, 1998. Переглянути на: Сайт видавця | Google Scholar
- C. Letizia, A. Taranta, S. Migliaccio та співавт., “Доброякісний остеопетроз II типу (хвороба Альберса-Шенберга), спричинений новою мутацією CLCN7, що має незвичні клінічні прояви”. Міжнародний кальцифікований тканин, вип. 74, ні. 1, с. 42–46, 2004. Переглянути на: Сайт видавця | Google Scholar
- К. Дж. Бортвік, Н. Кандемір, Р. Топалоглу та ін., “Фенокопія дефіциту CAII: нове генетичне пояснення спадкового інфантильного остеопетрозу з дистальним канальцевим ацидозом нирок” Журнал медичної генетики, вип. 40, № 2, с. 115–121, 2003. Перегляд за адресою: Google Scholar
- L. Van Wesenbeeck, E. Cleiren, J. Gram et al., «Шість нових мутаційних помилок у гені, пов’язаному з рецептором LDL, білка 5 (LRP5) в різних умовах із підвищеною щільністю кісткової тканини». Американський журнал генетики людини, вип. 72, ні. 3, с. 763–771, 2003. Переглянути на: Сайт видавця | Google Scholar
- E. Van Hul, J. Gram, J. Bollerslev et al., "Локалізація гена, що викликає аутосомно-домінантний остеопетроз I типу, до хромосоми 11q12-13", Журнал досліджень кісток та мінералів, вип. 17, № 6, с. 1111–1117, 2002. Перегляд за адресою: Google Scholar
- Z. L. Zhang, J. W. He, H. Zhang et al., "Ідентифікація мутацій гена CLCN7 у двох китайських сім'ях з аутосомно-домінантним остеопетрозом (тип II)" Журнал кісткового та мінерального обміну, вип. 27, ні. 4, с. 444–451, 2009. Переглянути на: Сайт видавця | Google Scholar
- E. Cleiren, O. Bénichou, E. Van Hul et al., "Хвороба Альберса-Шенберга (аутосомно-домінантний остеопетроз, тип II) є результатом мутацій гена хлорного каналу CICN7" Молекулярна генетика людини, вип. 10, № 25, с. 2861–2867, 2001. Перегляд за адресою: Google Scholar
- Дж. Боллерслев та Л. Мосекільде, “Аутосомно-домінантний остеопетроз”, Клінічна ортопедія та супутні дослідження, ні. 294, с. 45–51, 1993 р. Перегляд за адресою: Google Scholar
- J. Gram, S. Antonsen, M. Horder і J. Bollerslev, "Підвищений рівень креатинкінази BB у сироватці крові при аутосомно-домінантному остеопетрозі II типу", Міжнародний кальцифікований тканин, вип. 48, ні. 6, с. 438–439, 1991. Перегляд за адресою: Google Scholar
- А. Гасбек та А. Е. Мендерс, “Гіпофосфатемія: оновлення щодо її етіології та лікування”, Американський медичний журнал, вип. 118, ні. 10, с. 1094–1101, 2005. Переглянути на: Сайт видавця | Google Scholar
- А. С. Алізаде Надері та Р. Ф. Рейлі, “Спадкові розлади ниркового фосфатного розтрати”, Нефрологія, вип. 6, № 11, с. 657–665, 2010. Переглянути на: Сайт видавця | Google Scholar
- Д. Тіосано та З. Хохберг, “Гіпофосфатемія: спільний знаменник усіх рахітів”, Журнал кісткового та мінерального обміну, вип. 27, ні. 4, с. 392–401, 2009. Переглянути на: Сайт видавця | Google Scholar
- Ф. С. Каплан, Ч. С. Август, М. Д. Фаллон, Ф. Ганнон та Дж. Г. Хаддад, “Остеопетрокікет: парадокс достатку. Патофізіологія та лікування ” Клінічна ортопедія та супутні дослідження, ні. 294, с. 64–78, 1993. Перегляд за адресою: Google Scholar
- Ю. Бюкте, Ф. Гюркан, М. Давутоглу, А. Гьозю та М. Білічі, “Дитячий остеопетроз, пов’язаний з рахітом”, Європейський журнал загальної медицини, вип. 2, № 1, с. 32–34, 2005. Перегляд за адресою: Google Scholar
- К. Кірубакаран, К. Р. Ранджіні, Дж. X. Скотт, М. Баскер та Г. Срідхар, “Остеопетрокінети”, Журнал тропічної педіатрії, вип. 50, ні. 3, с. 185–186, 2004. Переглянути на: Сайт видавця | Google Scholar
- В. Датта, Н. С. Праджапаті, М. Кембл і С. Патак, “Остеопетрокікет”, Індійська педіатрія, вип. 37, ні. 1, с. 98–99, 2000. Перегляд за адресою: Google Scholar
- W. S. Sly, S. Sato та X. L. Zhu, “Оцінка ізоферментів карбоангідрази при розладах, пов’язаних з остеопетрозом та/або канальцевим ацидозом нирок”, Клінічна біохімія, вип. 24, ні. 4, с. 311–318, 1991. Переглянути за адресою: Google Scholar
- К. Сенел, М. Угур, А. Ердал та Х. Оздемір, “Аутосомно-домінантний остеопетроз II типу”, Міжнародна ревматологія, вип. 22, ні. 3, с. 116–118, 2002. Переглянути на: Сайт видавця | Google Scholar
- Обмежувальне годування та надмірний голод у маленьких дітей із ожирінням Серія випадків - Eagleton -
- Пруріго Пігментоза - "Кето-висип", огляд літератури та нещодавнє тематичне дослідження Natural
- Тематичне дослідження дорожньої дієти, що підбадьорює Ingersoll
- Плеоморфна аденома м’якого піднебіння малої слинної залози Незвичайна презентація
- Рівень ожиріння серед маленьких дітей падає на 43% за десятиліття - The New York Times