Опісторхоз з прозапальними цитокінами (ІЛ-1β і TNF-α) Поліморфізми впливають на ризик розвитку внутрішньопечінкової холангіокарциноми в Таїланді: вкладене дослідження «випадок-контроль»
Анотація
Передумови
Хронічне запалення та повторне зараження Opisthorchis viverrini (O. viverrini) індукує внутрішньопечінкову холангіокарциному (ICC). Запальні цитокіни, такі як інтерлейкін (ІЛ) та фактор некрозу пухлини (ФНО), є речовинами в імунній системі, які сприяють запаленню та викликають прогресування захворювання. Гени, які допомагають експресувати прозапальні цитокіни, можуть впливати на сприйнятливість людини до хвороб, особливо при хронічному запаленні, пов'язаному з раком. Це дослідження мало на меті дослідити фактори ризику розвитку ІКК із акцентом на описторхоз та поліморфізм прозапальних цитокінів (ІЛ-1β і TNF-α).
Методи
Це дослідження було вкладеним дослідженням випадків контролю в рамках когортного дослідження. 219 суб'єктів, які розробили первинний ICC, були ідентифіковані та зіставлені з двома нераковими контролями з тієї самої когорти на основі статі та віку при наборі (± 3 роки). Ан O. viverrini-Антитіла IgG оцінювали за допомогою імуноферментного аналізу. ІЛ-1β і TNF-α поліморфізми аналізували за допомогою ланцюгової реакції полімерази з аналізом плавлення з високою роздільною здатністю. Асоціації між змінними та ICC оцінювали за допомогою умовної логістичної регресії.
Результати
Суб'єкти з високою інтенсивністю зараження мали вищий ризик МКК, ніж ті, хто мав низький рівень (АБО = 2,1; 95% ДІ: 1,2–3,9). Суб'єкти з усіма генотипами TNF-α (GG, GA, AA) та висока інтенсивність зараження були суттєво пов’язані з підвищеним ризиком ICC (стор
Передумови
Рівень захворюваності внутрішньопечінковою холангіокарциномою (ICC) на північному сході - найвищий рівень захворюваності в Таїланді - з останнього звіту, Рак у Таїланді, вип. VII, 2007–2009, показали, що це найпоширеніший рак у чоловіків (стандартизований за віком рівень захворюваності, ASR = 67,1 на 100 000) і третій за поширеністю рак у жінок (ASR = 30,9). У місті Хон-Каен, розташованому на північному сході Таїланду, захворюваність на ICC становить 57,4 ASR у чоловіків та 23,1 у жінок на 100 000 [1].
Методи
Вивчати дизайн
Це дослідження було частиною більш масштабного дослідження, відомого як когортне дослідження Кхон Каена (KKCS), яке раніше проводилося [17,18,19,20]. Це була підходяща платформа для перевірки гіпотези про ризик впливу взаємодії господар-середовище з МКК. Коротко кажучи, в цих експериментах використовували позитивних суб'єктів МТП (МКБ-10: 22.1) та вибірку незахищених контролів, які були включені до складу КККС.
Вивчення предметів
Серед 23 584 суб'єктів, які потрапили в КККС (чоловіки 32,6%: жінки 67,4%), було виявлено 219 учасників когорти (0,9%), у яких розвинулося первинне злоякісне утворення внутрішньопечінкових жовчних проток печінки (C22,1) (чоловіки 57,0%: жінки 43,0%). Оскільки ICC рідко діагностується за допомогою біопсії печінки та гістопатології (6,9%), критеріями включення як випадок був діагноз принаймні за допомогою УЗД, з контрастною рентгенологією або без неї (9,6%) та онкомаркерами, такими як CA19–9 (83,5%) . Життєвий стан та дата смерті для потенційних випадків були встановлені шляхом зв’язку з картою про смерті в Таїланді в базі даних Національного управління охорони здоров’я (NHSO) разом із демографічною базою даних Міністерства внутрішніх справ. Усі випадки МТП померли протягом 2 років після встановлення діагнозу. Два випадки контролю раку з тієї самої когортної популяції були випадковим чином обрані для відповідності кожному випадку на основі статі та віку при наборі (± 3 роки).
Виявлення O. viverrini-Антитіла IgG
Виявлення O. viverrini-Антитіла IgG оцінювали в паразитологічній лабораторії медичного факультету університету Хон Каен, Таїланд. Непрямий фермент, пов'язаний з імуносорбентним аналізом (ІФА), використовували для аналізу сироватки випадків та їх відповідних контролів, як повідомлялося раніше [21, 22]. Зразки аналізували як дублікати з оптичною щільністю (OD) при 620 нм під зчитувачем ELISA. Середнє значення OD було використано як граничне значення, OD ≤0,24 та OD> 0,24.
Аналіз ІЛ-1β і TNF-α поліморфізми
Геномну ДНК витягували з фракцій матової оболонки 170 випадків (77,6%) з 219 відповідних випадків МКК та 355 (81,0%) з 438 відповідних контролів, використовуючи стандартні протоколи міні-набору геномної ДНК з протеїназою К (Geneaid Biotech).
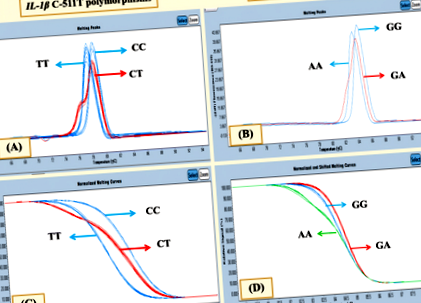
Посилення ІЛ-1β C-511 T було досягнуто за допомогою двох праймерів, [F]: 5′- AATTTCTCAGCCTCCTACTTC-3 ′ і [R]: 5′- GTTTGGTATCTGICCGTTTC-3 ′. TNF-α Ген G308A ампліфікували, використовуючи [F]: 5′- TAGGTTTTGAGGGGCATG -3 ′ та [R]: 5′- CTGGGICCCTGACTGATTT-3 ′ в реакції ПЛР. Обидва генетичні поліморфізми проводили в системі ПЛР LightCycler® 480 у реальному часі з кінцевим об’ємом 20 мкл, що містить 10 мкл основного суміші, 4,4 мкл H2O, 3 мМ MgCl2, 0,3 мкМ кожного праймера та 200 нг ДНК шаблон. Дані аналізу плавлення з високою роздільною здатністю аналізували за допомогою програмного забезпечення для сканування генів LightCycler 480® версії 1.5 (Roche). Нормалізовані криві плавлення та піки плавлення варіації послідовності оцінювали та порівнювали із зразком дикого типу. Різні графіки піків плавлення проілюстровані на рис. 1а для ІЛ-1β C-511 T та рис. 1b для TNF-α G-308A. Варіації послідовності відрізнялися різною формою кривих плавлення (рис. 1в для ІЛ-1β C-511T та рис. 1d для TNF-α G-308A). Для поліпшення якості генотипування та валідації, 10% випадкових зразків генотипування були підтверджені методом ПЛР із використанням методів поліморфізму довжини фрагментів рестрикції (PCR-RFLP).
Поліморфізми в ІЛ-1β C-511T та TNF-α G-308A аналізували за допомогою полімеразної ланцюгової реакції з високим дозволом аналізу плавлення (PCR-HRM)
Статистичний аналіз
Зв'язок між O. viverrini інтенсивність інфекції та прозапальні поліморфізми цитокінів (ІЛ-1β і TNF-α) з ризиком розвитку ICC та коефіцієнти шансів (OR) були оцінені та оцінені на рівні 95% довіри та умовної логістичної регресії. Інформація про куріння, алкоголь та дієту, яка використовувалась для скоригованих ОР з багатовимірного аналізу в Таблиці 2, вже повідомлялась раніше [19, 20]. Можливі модифікації ефектів O. viverrini інтенсивність зараження поліморфізмами прозапальних цитокінів (ІЛ-1β і TNF-α) також були проаналізовані. Результати, які показали a стор-значення
Результати
З 23 584 учасників 219 (0,9%) суб’єктів розробили ICC. Це було 92 жінки та 127 чоловіків із середнім віком 57 років (Таблиця 1). Крім того, для кожного випадку існували два контролі однієї статі та віку.
У таблиці 2 наведено скориговані співвідношення шансів (OR) та 95% ДІ в результаті багатовимірного аналізу, включаючи 10 факторів, визначених як зростаючий ризик при однофакторному аналізі ICC, пов'язаних з O. viverrini інтенсивність зараження, ІЛ-1β і TNF-α поліморфізми. Учасники, які мали O. viverrini-Антитіла IgG (OD> 0,24) мали більш високий ризик для ICC, ніж ті, хто цього не робив (OD ≤0,24) (скориговане АБО 2,1; 95% ДІ: 1,2–3,9). Для порівняння, учасники з ТТ варіантом ІЛ-1β Поліморфізми C-511 T мали знижений ризик ICC (скоригований OR 0,4; 95% ДІ: 0,2–0,8). Результати взаємодій між O. viverrini інтенсивність зараження та ІЛ-1β і TNF-α Поліморфізми щодо ризику ICC показані в Таблиці 3. Учасники з TNF-α у всіх генотипів (GG, GA, AA), які мали високу інтенсивність зараження (IgG антитіла> 0,24), мали підвищений ризик розвитку ICC і були статистично значущими (OR 2,1 для GG дикого типу, OR 2,4 для GA гетерозиготу та OR 2,8 для AA варіант). Між ними не було взаємодії O. viverrini інтенсивність зараження та поліморфізми ІЛ-1β і TNF-α що вплинуло на ризик ICC.
Обговорення
У цій роботі наші результати успішно продемонстрували фактори ризику для МТП. Наприклад, O. viverrini інтенсивність інфекції, виявлена антитілами IgG, була фактором ризику для МКК і була порівнянна з раніше повідомленими дослідженнями на північному сході Таїланду - Хон Каеном, [21] Накхон Фаном [22] та Убоном Ратчатхані [23]. Результати, отримані в цій роботі, показали модифіковані ефекти O. viverrini зараження с TNF-α кодон 308 АА варіант. Тільки учасники O. viverrini інтенсивність інфекції була скоригована АБО 2,1 (95% ДІ: 1,2–3,9), але учасники, які мали і те, і інше O. viverrini інтенсивність зараження разом з варіантом АА TNF-α мали підвищений АБО 2,8 (95% ДІ: 1,4–5,8).
Частоти генотипу ІЛ-1β C-511 T та TNF-α Поліморфізми G308A, виявлені в контролі, узгоджувались з іншими дослідженнями в Таїланді [16, 24]. Поширеність алелів C і T ІЛ-1β кодон 511 становив 45,9% проти 46,4% та 54,1% проти 53,6% відповідно. Крім того, розподіл алелів TNF-α G308A також був послідовним, як повідомлялося раніше [24].
В Таїланді існує дуже обмежена інформація, яка повідомляє про асоціації Росії ІЛ-1β C-511 T та TNF-α Поліморфізми G-308A з ризиком різних видів раку, особливо при хронічному HCC, пов’язаному з вірусом гепатиту В [16, 24]. Хоча, жодного дослідження про асоціацію Росії не було ІЛ-1β C-511 T та TNF-α Поліморфізми G308A щодо ризику ICC до цього часу повідомлялося про дослідження раку, пов'язаного з експресією цитокінів, який діє як діагностичний маркер раку. Виявлення сироваткових рівнів цитокінів (таких як IL-6 або IL-10) може бути пов'язане з процесом канцерогенезу або поганим прогнозом [25,26,27,28]. У нашому поточному дослідженні ICC нещодавно була опублікована роль TNF-α у індукуванні епітеліально-мезенхімального переходу (EMT) клітин ICC [6]. Більше того, профіль продукції цитокінів у одноядерних клітинах периферичної крові, зібраних у суб'єктів із і без них O. viverrini інфекцію оцінювали. Одинадцять цитокінових профілів (IFN-γ, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, TNF-α та LT-α), виміряні за допомогою проточної цитометрії, виявили, що як протизапальні, так і протизапальні цитокіни були збільшені в O. viverrini-асоційований ICC порівняно з неінфікованими нормальними контролями [29].
Основою діагностики МКК рідко робилася гістологія (6,9%), і не виключено, що інші випадки летальних захворювань печінки, що виявляють особливості жовчної обструкції, з низьким вмістом альфа-фетопротеїну в сироватці крові, можливо, були включені до групи випадків. Незважаючи на це, загальні результати підтверджують нашу гіпотезу і є ключовим фактором у формулюванні експериментів для майбутніх проектів.
Висновки
Існував відомий зв'язок між поліморфізмами Росії ІЛ-1β і TNF-α. поліморфізм ІЛ-1β C-511 T та TNF-α G-308A - це не ризик ICC, а людина з O. viverrini інфекція впливає на всі генотипи TNF-α ген (GG, GA, AA), який може сприяти розвитку ICC. Первинна профілактика МТП у районах високого ризику базується на зусиллях щодо зменшення O. viverrini інфекція.
- Прозапальні цитокіни при впливі на ожиріння цукрового діабету 2 типу та шлункового шунтування
- Ожиріння Маркер ризику або незалежний фактор ризику захворювання на коронарні артерії
- Проспективне дослідження трьох основних режимів харчування та ризику раку шлунка в Японії - Кім - 2004
- Освіта пацієнтів Здорова дієта та зменшення ризику діабетичної ретинопатії
- Збільшення ожиріння ставить 2 мільйони людей під загрозу діабету 2 типу - BBC Science Focus Magazine