Огляд антигіпертензивного та проти ожиріння ефекту вторинних метаболітів морських водоростей
Ана М. Л. Сека
1 cE3c - Центр екології, еволюції та змін навколишнього середовища/Азорська група з питань біорізноманіття та факультет наук і технологій, Університет Азорських островів, Rua Mãe de Deus, 9501-321 Понта-Делгада, Португалія
Діана Ч. Г. А. Пінто
Анотація
1. Вступ
Гіпертонія та ожиріння є ключовими показниками несприятливого стану здоров’я, які мають катастрофічні наслідки для здоров’я. Ожиріння, що визначається як надлишок жиру в організмі, вважається умовою шлюзу для ряду хронічних захворювань і є основним фактором розвитку серцево-судинних та метаболічних розладів, таких як гіпертонія, ішемічний інсульт, резистентність до інсуліну, порушення толерантності до глюкози, гіперінсулінемія та дисліпідемія [1] . Гіпертонія, стан високого кров'яного тиску, який називається "тихим вбивцею", оскільки протягом багатьох років може бути безсимптомним, перш ніж бути клінічно діагностовано, є основним фактором ризику серцево-судинних захворювань, таким як ішемічний та геморагічний інсульт, інфаркт міокарда, серцева недостатність, хронічна хвороба нирок, захворювання периферичних судин, когнітивний спад та передчасна смерть [2]. Хоча існує багато питань без відповіді щодо причин ожиріння та гіпертонії, проте, схоже, вони мають загальні патофізіологічні механізми.
Ожиріння посилює рух симпатичного нерва завдяки гіперінсулінемії та нирковому переносу норадреналіну, які посилюють ниркову канальцеву реабсорбцію натрію та, як наслідок, активні ренін-ангіотензинову систему (РАН) [3,4]. Крім того, в процесі ожиріння спостерігається посилення дисфункції ендотелію та судинний окислювальний стрес, що частково пов’язано з циркулюючими адипокінами (збільшення продукції лептину, зменшення продукції адипонектину), посилення активних форм кисню та зниження доступності оксиду азоту, що разом з ендотеліном та RAS є найважливішими факторами, що регулюють судинний тонус [3,4,5]. Патогенез гіпертонії є багатофакторним і складним, пов’язаний з різними концентраціями натрію та калію в організмі, ожирінням, резистентністю до інсуліну, високим споживанням алкоголю, низьким споживанням кальцію, стресом та захворюваннями старіння. Трьома основними факторами, що визначають артеріальний тиск, є ниркова екскреція натрію (і наслідковий вплив на плазму та загальний об'єм тіла), судинний тонус та серцева діяльність, і ці фактори контролюють серцевий викид, внутрішньосудинний об'єм та системний судинний опір [3,6 ].
З іншого боку, пошук нових препаратів від макроводоростей з фармацевтичним застосуванням у профілактиці та лікуванні гіпертонії та ожиріння передбачає виявлення чистих сполук з морських водоростей, які мають такі властивості. Насправді морські водорості утворюють велику структурну різноманітність дрібних молекул з дуже цікавою біоактивністю. Тут будуть представлені та обговорені найновіші та найсучасніші дослідження чистого вторинного метаболіту бурих, червоних та зелених макроводоростей, які виявляють значну антигіпертензивну та проти ожиріння активність. Ці властивості, безумовно, зроблять їх привабливими для фармацевтичної промисловості як сполуки свинцю при розробці нових кардіопротективних препаратів і, звичайно, звернуть увагу на цінність морських водоростей для здоров’я.
2. Антигіпертензивні сполуки водоростей
2.1. Пептиди
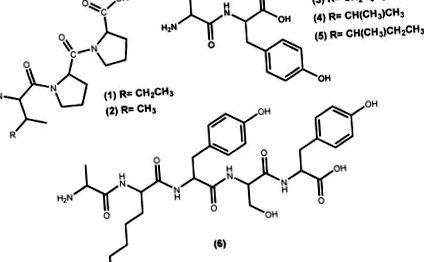
Біоактивні пептиди, отримані з білків макроводоростей, мають кілька корисних фармакологічних властивостей; серед них здатність діяти як гіпотензивні засоби [29]. Пептиди - це найбільш часто досліджувані природні сполуки, що пригнічують активність АПФ I, навіть ті, що виділені з інших джерел, крім макроводоростей [10,30,31]. Прикладами гіпотензивних комерційних пептидів, що генеруються з макроводоростей та із затвердженими Міністерством охорони здоров'я, праці та соціального захисту Японії FOSHU ("харчові продукти для певних цілей здоров'я") є Ameal-S 120 ® (Calpis Co., Ltd., Токіо, Японія) з Японії та Evolus ® (Valio Ltd, Гельсінкі, Фінляндія) з Фінляндії, які знижують артеріальний тиск завдяки наявності в їхній формі інгібіторів АПФ I пептидів IPP (1) і VPP (2) (Малюнок 1) [32]. Інші японські продукти включають желе Вакаме, отримане з макроводорості Undaria pinnatifida (Harvey) Suringar (добре відоме як wakame), яке містить пептиди FY (3), VY (4) та IY (5) (Малюнок 1) та пептид Nori S, отриманий з макроводорості Porphyra yezoensis (відповідно до поточної назви водорості [33] - це Pyropia yezoensis (Ueda) M.S. Hwang & H.G.Choi), що містить пептид AKYSY (6) (Малюнок 1) [29,32,34].
Активні пептидні структури комерційних базових продуктів з морських водоростей, що використовуються для контролю артеріального тиску.
Є дані, що невеликі пептиди розміром від 2 до 20 залишків амінокислот виявили перспективні антигіпертензивні властивості, і цей тип пептидів можна отримати з білкових гідролізатів морських водоростей [35]. Насправді ці пептиди з антигіпертензивним потенціалом виявляються, коли вони вивільняються з материнського білка шлунково-кишковими ферментами, переробкою їжі або ферментацією мікробів [29,35]. Більше того, пептиди, що інгібують АПФ I, повинні виявляти стійкість як до шлунково-кишкових протеаз, так і до пептидаз, що межують з щітками, і транспортуватися цілими до системи кровообігу для збереження фізіологічної активності [35]. Дійсно, Thierney et al. звертає увагу на той факт, що наявність інгібуючої активності АПФ I in vitro не обов'язково корелює з антигіпертензивним ефектом in vivo [36].
Антигіпертензивні пептиди, виділені з Pyropia yezoensis (Ueda) M.S.Hwang & H.G.Choi (син. Porphyra yezoensis) та Undaria pinnatifida (Harvey) Suringar.
З Undaria pinnatifida (Harvey) Suringar, дуже популярної їжі з морських водоростей у східних країнах, яка містить 15% білка, Suetsuna et al. [42] виділив та встановив амінокислотні послідовності десяти дипептидів з інгібуючою активністю АПФ I. Серед них чотири дипептиди FY (3), IY (5) (Малюнок 1), YH (9) і KY (10) (Рис. 2), демонструють значну активність in vitro, зі значеннями IC50 3,7, 2,7, 5,1 та 7,7 мкМ відповідно [35,42], тоді як KY (10) демонструє найвищий гіпотензивний ефект in vivo (аналіз безперервного перорального прийому з 10 мг/добу/кг маси тіла у спонтанно гіпертонічних щурів), можливо, завдяки більшій стійкості до протеази, ніж до інших дипептидів [42].
Нещодавно було продемонстровано, що тетрапептид PAFG (11) (Малюнок 3) є справжнім інгібітором АПФ I і може ефективно знижувати артеріальний тиск, може застосовуватися перорально та має низьку чутливість до ферментів шлунково-кишкового тракту [43]. PAFG (11) три гідрофобні амінокислотні послідовності на С-кінці можуть сприяти його in vitro потужній неконкурентній інгібуючій активності АПФ I (IC50 35,9 мкМ). Автори стверджували, що PAFG (11) було отримано в результаті гідролізу білка Enteromorpha clathrata, і що ця водорість є однією з найпопулярніших їстівних морських зелених водоростей у країнах Північно-Східної Азії, яка з’являється майже цілий рік [43]. На жаль, морські водорості не визначені належним чином, і в AlgaeBase [33] можна знайти 58 видів з такою ж назвою. Крім того, існують автори, які припускають, що Enteromorpha та Ulva є однаковими родами [44]. Правильна ідентифікація джерела є дуже важливою, але використання позитивного контролю ще важливіше для підтвердження повідомленої діяльності, аспект, який не згадується авторами. Для наших читачів ми можемо запропонувати використання каптоприлу, синтетичного клінічного препарату, який широко застосовується як гіпотензивний засіб, що є дуже ефективним, хоча і має деякі суттєві побічні ефекти [34,45].
Антигіпертензивні пептиди, виділені з Enteromorpha clathrata, Ulva rigida C.Agardh та Palmaria palmata (Linnaeus) F.Weber & D.Mohr.
Два невеликих пептиди, IP (12) та AFL (13) (Малюнок 3), були отримані з білка Ulva rigida C.Agardh за допомогою процедури, яка передбачає гідролізацію пепсином плюс бромелайн та кілька етапів очищення [46]. Ці пептиди виявили інгібуючу активність АПФ I, ІР (12) (IC50 87,6 мкМ) та AFL (13) (IC50 65,9 мкМ), а пептид (12) були показані неконкурентними, тоді як пептид (13) діє як конкурентний інгібітор АПФ [46]. Аналізи стабільності показали, що обидва пептиди термостійкі і пептид (13) гідролізується пептидазами слизової оболонки кишечника до більш активного дипептиду, FL (14) (Рисунок 3) (IC50 16,0 мкМ), що діє як неконкурентний інгібітор АПФ I, навіть якщо він менш активний, ніж каптоприл (IC50 0,77 мкМ) [46].
Гідроліз термолізину Palmaria palmata (Linnaeus) F.Weber & D.Mohr (добре відомий як імпульсний) білок створив кілька пептидів інгібіторів АПФ I, причому найбільш перспективним є LRY (8) (Малюнок 2), а потім VYRT (15) (Малюнок 3) [40]. Абсолютні кількості пептидів для інгібування 50% 1,0 U ACE I складають, відповідно, 0,044 мкмоль та 0,14 мкмоль. Хоча автори виражали значення активності у відомій і прийнятній одиниці із відповідними вказівками на кількість ферменту, перетворення її в більш часту та порівнянну одиницю, як значення IC50, в мкМ є важким, і через це неможливо просувати потенціал пептидів. Пептид (15) був отриманий з оригінального фікобіліпротеїну Palmaria palmata, зокрема з α-субодиниці фікоеритрину, тоді як пептид (8) отримували з β-субодиниць фікоеритрин, фікоціанін та алофікоціанін [40].
Зовсім недавно новий пептид з інгібуючою активністю АПФ був виділений з основної культивованої червоної макроводорості в Китаї з потужним економічним та екологічним значенням Gracilariopsis lemaneiformis (Bory de Saint-Vincent) EYDawson, Acleto & Foldvik після гідролізу білка водоростей із трипсином [47 ]. Новий пептид був ідентифікований як QVEY (16) (Рисунок 3) і показав значення IC50 474,36 мкМ [39], нецікавий рівень активності з огляду на його застосування як лікарського засобу.
З вищезазначених результатів можна зробити висновок, що регулярний прийом морських водоростей може бути ефективним для підтримання артеріального тиску на здоровому рівні завдяки їх пептидам, потужним інгібіторам АПФ. З пептидів, про які повідомляється до сьогодні, очевидно, що дипептид (5) і пентапептид (6) (Рисунок 1) є найпотужнішими інгібіторами АПФ I, виділеними з морських водоростей.
Пептид-інгібітор реніну, виділений з Palmaria palmata (Linnaeus) F.Weber & D.Mohr.
Система кінін-оксид азоту працює спільно з системою RAS для регулювання артеріального тиску. Проміжний продукт, який бере участь у системі кінін-оксид азоту, брадикінін, активує Ca 2+/кальмодулін-залежну ендотеліальну оксид азоту синтазу (eNOS), яка каталізує перетворення аргініну в оксид азоту (NO), що призводить до падіння артеріального тиску. Існують докази того, що нокаут eNOS та дефіцит NO можуть призвести до клінічної гіпертензії [57]. Отже, багаті аргініном пептиди також можна розглядати як стратегію терапії гіпертонії, коли вони діють як джерело оксиду азоту, який, у свою чергу, відіграє важливу фізіологічну роль у судинному ендотелії і, отже, може надавати in vivo судинорозширювальні ефекти під час гіпертонії [58]. . Нещодавно було розглянуто вплив багатих аргініном пептидів як антигіпертензивних засобів [59], і більшість багатих аргініном пептидів отримували з продуктів харчування. Однак деякі види макроводоростей, такі як Porphyra spp., Chondrus crispus spp. та Ulva pertusa Kjellman містять високий рівень аргініну [60]; таким чином, принаймні ці види слід розглядати як потенційні джерела антигіпертензивних багатих аргініном пептидів.
Беручи до уваги широке застосування інгібіторів АПФ I пептидів у зміцненні серцево-судинного здоров'я, оптимізація процедур екстракції зібрала декілька уваги та обговорення щодо критеріїв вибору методів екстракції та якості екстрактів [22,35,61]. Наприклад, нещодавно екстракцію гідролізом целюлази та α-амілази порівнювали із звичайним методом мацерації. Ці дві процедури були протестовані на кількох бурих водоростях, і було очевидно, що екстракти процедури мацерації були менш багатими сполуками з інгібуючою активністю АПФ I [62]. Однак автори припустили, що інгібуюча активність АПФ I екстрактів, отриманих ферментативною екстракцією, може бути обумовлена присутністю флоротанінів та вуглеводів, а не пептидів [62].
2.2. Флоротаніни
Полімеризація флороглюцинолу дає сімейство важливих природних сполук - флоротаніни, які мають високу гідрофільність та мають широкий діапазон молекулярних розмірів, коливаючись від 126 Da до 650 kDa. Їхнє поширення в бурих морських водоростях дуже поширене, головним чином у видів еклонії, і також визнано їх різноманітну корисну біологічну активність, таку як протипухлинна, протидіабетична, протиалергічна, антиоксидантна та гіпотензивна дії [63,64,65,66].
Залучення флоротанінів до інгібуючої активності АПФ I, запропоноване Оліваресом-Моліною та Фернандесом [62], не є дивним, оскільки це було раніше виявлено. Наприклад, з етанольного екстракту порожнистої еклонії Кельмана були виділені флоротанніни, які виявляли потенційну активність АПФ та з яких найбільш активним був діекол (18) (Малюнок 5), з інгібітором АПФ IC50 1,47 ± 0,04 мМ [67]. Dieckol (18) було виявлено, що він не є конкурентоспроможним інгібітором проти АПФ I, має індуцибельний ефект на вироблення NO в клітинах EAhy926 і не має цитотоксичних ефектів, хоча його інгібуюча здатність не порівнянна з такою, представленою каптоприлом (IC50 0,025 ± 0,90 мкМ) [67]. Звертаємо увагу читача на той факт, що каптоприл є клінічним препаратом, який широко застосовується як гіпотензивний засіб. Здається, низький рівень IC50 відповідає цьому; однак пов'язане із цим стандартне відхилення в кілька разів перевищує середнє значення IC50, що є неприпустимим. На наш погляд, це може бути друкарською помилкою.
Антигіпертензивні флоротаніни, виділені з порожнистої еклонії Кельмана та еклонії столоніферної Окамури.
З'єднання діеккол (18) також був виділений із їстівної бурої водорості Ecklonia stolonifera Okamura разом із флорофукофуроекколем A (19) (Малюнок 5), із сполукою 19 будучи інгібітором АПФ I набагато сильнішим (зі значенням IC50 12,74 ± 0,15 мкМ), ніж сполука 18, хоча і не такий активний, як каптоприл [68].
6,6′-біеккол (20) (Малюнок 5), виділений з еклокнії порожньої Кельман, інгібує фермент АПФ зі значенням IC50 0,42 мМ [69], будучи менш активним, ніж флорофукофуроеккол А (19) (Малюнок 5). Крім того, Ko et al. [69], використовуючи док-дослідження, встановив, що 6,6′-біеккол (20) (Малюнок 5), може взаємодіяти з S1, S′1 і S′2 кишенями ACE, а потім стримувати активність ACE; використовуючи аналіз ендотеліальних клітин пуповинних вен (HUVEC), вони демонструють, що 6,6′-бієккол генерує ендотеліальний оксид азоту (eNOS), опосередкований оксидом азоту (NO), активуючи Akt; та використовуючи спонтанно гіпертонічні моделі щурів, 6,6′-біеккол (20) (Малюнок 5) спричиняє значне зниження систолічного артеріального тиску в дозі 20 мг/кг маси тіла та вводиться перорально. Ці результати є хорошими показниками того, що 6,6′-біеккол (20) може бути використаний для лікування гіпертонії.
Взаємозв'язки структури та активності флоротанінів неповні, але, здається, частина дибензо-1,4-діоксину може мати вирішальне значення для сприяння інгібуванню АПФ I. Більше того, додаткове кільце дибензофурану може також посилити інгібуючий ефект [68]. Є дані, що інгібуюча активність АПФ I до флоротанінів зумовлена їх здатністю до зв’язування з білками та, як наслідок, зниженням ефективності АПФ I після зв’язування [67]. Ця здатність до зв’язування білків залежить від довжини та структури флоротаніну, мабуть, пентамери або гексамери флороглюцинолу є кращими інгібіторами [70].
2.3. Полісахариди
Ендотелін1 (ЕТ 1), переважна сполука ендотелінової системи, діє через внутрішньоклітинні шляхи двох ендотелінових рецепторів (ЕТА та ЕТВ). Ендотеліальні клітини регулюють судинний тонус і провокують мітогенні та прозапальні реакції. Є дані, що блокада рецепторів ендотеліну, особливо підтипу ЕТА, може бути стратегією лікування основних серцево-судинних патологій [71,72,73].
D-поліманнуроновий сульфат (21) (Рисунок 6), сполука вуглеводного типу, може бути отримана з бурої водорості Pelvetia canaliculata (Linnaeus) Decaisne & Thuret, а також демонструє in vivo гостру та профілактичну гіпотензивну ефективність. D-поліманнуроновий сульфат (21) виявляв терапевтичну ефективність (50 мг/кг), порівнянну з ефективністю каптоприлу (14 мг/кг). Результати показують, що D-поліманнуроновий сульфат (21) сприяє підвищенню вмісту NO та зниженню концентрацій Ang II та ET 1 [74], головним чином шляхом залежного від дози зниження та/або запобігання підвищенню систолічного артеріального тиску та зменшення частоти серцевих скорочень із зниженням артеріального артеріального тиску [74].
- Екстракти листя женьшеню Panax проявляють ефект проти ожиріння у щурів із ожирінням з високим вмістом жиру
- Харчування та загоєння ран Огляд, зосереджуючи увагу на корисних ефектах куркуміну
- Мікоз - огляд тем ScienceDirect
- Лікування мієлофіброзу, побічні ефекти та альтернативні методи лікування
- Penzer 40mg Tablet View Застосування, побічні ефекти, ціна та замінники 1mg