Обмеження калорій та профілактика раку: метаболічні та молекулярні механізми
Вальтер Д Лонго
1 Геронтологічний центр Андруса, Університет Південної Каліфорнії, Лос-Анджелес, Каліфорнія, США
Луїджі Фонтана
2 Кафедра внутрішньої медицини, Медична школа Вашингтонського університету, Сент-Луїс, штат Міссурі, США
3 Відділ харчування та старіння, Istituto Superiore di Sanità, Рим, Італія
Анотація
Важливим відкриттям останніх років стало те, що способи життя та фактори навколишнього середовища впливають на ініціювання, просування та розвиток раку, вказуючи на те, що багато злоякісних пухлин можна запобігти. Епідеміологічні дослідження настійно припускають, що надмірне ожиріння, зниження фізичної активності та нездорова дієта є ключовими гравцями патогенезу та прогнозу багатьох поширених видів раку. Крім того, було показано, що обмеження калорій (CR) без недоїдання є широко ефективним у профілактиці раку у лабораторних штамів гризунів. Помірний ХР у дорослих також зменшує рівень захворюваності на рак на 50% у мавп. Чи застосовуватиметься протипухлинні ефекти CR для людей, невідомо, але CR призводить до постійного зниження рівня циркулюючих факторів росту, анаболічних гормонів, запальних цитокінів та маркерів окисного стресу, пов’язаних з різними злоякісними захворюваннями. Тут ми обговорюємо зв’язок між харчовими втручаннями та профілактикою раку, зосереджуючись на механізмах, які можуть бути відповідальними за ці ефекти у простих системах та ссавцях з метою розробки хіміопрофілактичних засобів.
ВСТУП
90% смертей від раку серед людей (8, 9).
Метаболічні, гормональні та фактори росту, пов’язані із збільшенням споживання їжі, зниженням фізичної активності та надмірною ожирінням, впливають на регуляцію та експресію генів, що беруть участь у відновленні ДНК, проліферації та диференціації клітин або апоптозі, дозволяючи клітинам накопичувати пошкодження та мутації, виживати, проліферують і в дозвільних умовах зазнають злоякісної трансформації (10, 11). Ці згубні ефекти можуть бути посилені під впливом негенотоксичних канцерогенів (наприклад, етанолу, сахарину, 1,4-дихлорбензолу, 17-бета-естрадіолу, миш'яку та берилію), які спричиняють пошкодження клітин запаленням, підвищеним окислювальним стресом та секрецією анаболічних гормонів, імуносупресія та активація шляхів передачі сигналу, що призводять до геномної нестабільності, втрати контролю проліферації та стійкості до апоптозу (12).
Обмеження калорій (CR) без недоїдання є найпотужнішим і відтворюваним фізіологічним втручанням для збільшення тривалості життя та захисту від раку у ссавців (13, 14). CR зменшує рівень ряду анаболічних гормонів, факторів росту та запальних цитокінів, зменшує окислювальний стрес та проліферацію клітин, підсилює аутофагію та кілька процесів відновлення ДНК (13, 14). Отже, розуміння метаболічних та молекулярних механізмів, відповідальних за CR-опосередковану профілактичну дію раку, може призвести до ліків та терапії для широкого спектру профілактики та лікування раку. Тут ми обговорюємо дієтичні втручання, які, як було показано, запобігають раку та покращують прогноз раку. Ми також описуємо генетичні шляхи та механізми, які виявляються вирішальними для наслідків CR, та обговорюємо докази потенційно захисних, але також шкідливих наслідків для людини.
Харчування та рак
Надмірне ожиріння та ризик раку
Кілька епідеміологічних досліджень послідовно демонстрували зв'язок між ожирінням та підвищеним ризиком раку ендометрію, молочної залози (постменопауза), товстої кишки, стравоходу (аденокарцинома), нирок (ниркових клітин), підшлункової залози, жовчного міхура та печінки (10, 23). Не спостерігається зв'язку між ожирінням та ризиком розвитку раку легенів та передміхурової залози, тоді як рак молочної залози в пременопаузі обернено корелює з індексом маси тіла (10, 21).
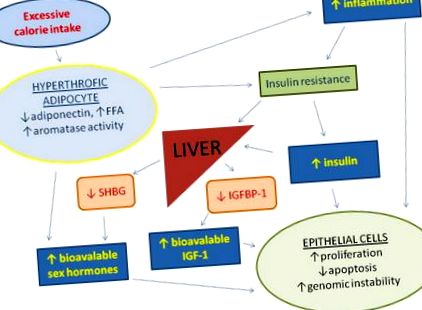
Надмірне споживання калорій та малорухливий спосіб життя сприяють гіпертрофії жирової тканини, зменшують вироблення адипонектину та збільшують циркулюючі вільні жирні кислоти (ЗЖК) та запалення, що призводить до інсулінорезистентності та компенсаторної гіперінсулінемії. Підвищена концентрація інсуліну в сироватці крові спричиняє зменшення печінкового синтезу інсуліноподібного фактора росту, що зв’язує білок 1 (IGFBP1) та глобуліну, що зв’язує стероїдні гормони (SHBG), що призводить до збільшення біодоступності інсулінового фактора росту 1 (IGF-1) та статевих гормонів. Жирова тканина також є основним джерелом поза залозистих естрогенів. Хронічно підвищений рівень циркуляції інсуліну, IGF-1, статевих гормонів та запальних цитокінів сприяє проліферації клітин, геномної нестабільності та інгібує апоптоз у багатьох типах клітин.
Обмеження калорій та рак
У 1909 р. Морескі опублікував першу наукову роботу, яка повідомляла, що CR інгібує ріст пухлин, трансплантованих мишам (53). Згодом дані показали, що CR, який визначається як зменшення споживання калорій нижче звичайного споживання без обмеження харчування, пригнічує спонтанні, хімічно індуковані та індуковані радіацією пухлини у кількох моделях раку на тваринах (54–60). Зовсім недавно було показано, що помірний ЗР у 30% випадків зменшує захворюваність та смертність від раку також у приматів, які не є людьми. Частота раку (переважно аденокарциноми шлунково-кишкового тракту) була зменшена на 50% у мавп CR, порівняно з випадками у контрольних груп (61). Вік початку CR, ступінь тяжкості CR та штам/генетичний фон тварин визначають ступінь запобігання або затримки раку (54–60, 62). У гризунів зменшення споживання калорій на 15% -53% нижче звичайного споживання за умови лібіту спричинило пропорційне лінійне зниження захворюваності на пухлину на 20% -62% (63). Тим не менше, вплив CR на рак не є однорідним. Деякі види раку виявляють більшу реакцію на CR, ніж інші, і невелика частина пухлин стійка до впливу CR (54, 56, 57, 60, 62).
CR викликає кілька ключових метаболічних/гормональних адаптацій, які змінюють експресію декількох генів і сигнальних шляхів (регуляція вгору певних генів/сигнальних шляхів та зниження регуляції інших, як зазначено стрілками), які виробляють основні клітинні адаптації (наприклад, зменшення проліферації клітин, збільшення видалення пошкоджених органел або клітин через аутофагію або апоптоз, підвищення регуляції систем відновлення ДНК та геномну стабільність), що призводить до зниження рівня захворюваності на рак (див. текст). Т3 = трийодтиронін; PI3K = фосфатидилінозитол-3-кіназа; AKT = кіназа AKT, також відома як протеїнкіназа B; S6K1 = рибосомна S6 протеїнкіназа 1; mTOR = ціль рапаміцину у ссавців; MAPK = мітоген-активована протеїнкіназа; NRF2 = фактори транскрипції NF-E2-пов'язаний фактор 2; SIRT-1 = тихий тип спарювання інформації, регулювання 2 гомолог 1; AMPK = аденозинмонофосфат (AMP) –активована протеїнкіназа; FOXO = фактори транскрипції Forkhead; PTEN = фосфатаза та гомолог тензину.
Ендокринна регуляція раку за допомогою інсуліноподібних сигналів
Інсуліноподібний фактор росту 1 (IGF-1), фактор росту, що виробляється головним чином із печінки, діє синергічно з іншими анаболічними гормонами (наприклад, інсуліном, статевими стероїдами), а також щодо калорійності та доступності білків регулює енергетичний обмін, клітини проліферація, диференціація клітин, розмір тіла та тривалість життя (31, 35, 36). Крім того, IGF-1 надає потужний мітогенний ефект на різні ракові клітини, збільшуючи швидкість проліферації та інгібуючи апоптоз (31, 88).
Тривале обмеження калорій, але не вправи на витривалість, зменшують концентрацію IGF-1 у сироватці крові приблизно на 30–40% у гризунів, і, як вважають, це опосередковане CR зниження рівня IGF-1 відіграє ключову роль у захисті від раку та уповільненні старіння (11, 64, 89–90). Потужний CR-опосередкований захисний ефект проти канцерогенезу у гризунів скасовується шляхом введення гормону росту або IGF-1 (91–93), додатково підкреслюючи критичну роль цих факторів росту в патогенезі раку. Крім того, миші, що нокаутують рецептори гормону росту (GHR), які мають низьку концентрацію IGF-1 у сироватці крові, демонструють
Зниження на 50% пухлинного навантаження та частоти летальних ракових захворювань за погодженням із результатами розвитку карликового горба Снелл з дефіцитом гормону росту (ГР), у якого рак або зменшується, або відкладається (94, 95). Більш низький рівень мутації у карликових мишей Еймса з дефіцитом GH середнього віку спостерігався в нирках, печінці та кишечнику, забезпечуючи деяке механістичне пояснення затримки новоутворень (96). На відміну від цього, миші з надмірною експресією GH мають дуже високі концентрації IGF-1, збільшені розміри тіла до 100%, збільшення частоти та ранніх стадій пухлин, а також помітне скорочення тривалості життя порівняно з нормальними братами та сестрами (97). Тим не менше, зниження регуляції сигналізації IGF-I може пояснювати лише частину наслідків недоліків CR, GH та GHR у захисті від раку. Наприклад, опосередковане КР збільшення кортикостерону може також відігравати важливу роль у запобіганні раку, оскільки адреналектомія скасовує ракові захисні ефекти КР, а добавки глюкокортикоїдів відновлюють гальмування (98).
Роль IGF-1 у патогенезі деяких видів раку людини підтверджується епідеміологічними дослідженнями, які виявили, що високі концентрації IGF-I у сироватці крові пов'язані з підвищеним ризиком ряду поширених видів раку, включаючи рак простати, молочної залози та товстої кишки (99). Підвищена частота пухлин спостерігається також у пацієнтів з акромегалією, у яких підвищений рівень IGF-I (100). Харчування є одним з основних регуляторів рівня циркулюючого IGF-1. Голодування у людей помітно знижує концентрацію IGF-1 у сироватці крові до діапазону, який спостерігається у пацієнтів із дефіцитом GH (101), але довготривала важка ХР не зменшує рівень циркулюючого IGF-1 у здорових чоловіків та жінок середнього віку, якщо споживання білка велике (102, 103). На відміну від цього, суворі вегетаріанці, які вживають білкову дієту з помірним обмеженням (
0,75 г білка/кг маси тіла/день) демонструють значно нижчі концентрації загального та вільного IGF-1 у сироватці крові (102). Більше того, зменшення споживання білка у осіб, які практикують важкий КР з високим споживанням білка (
МОЛЕКУЛЯРНІ ЦІЛІ ОБМЕЖЕННЯ КАЛОРІЇ
Оскільки CR продовжує тривалість життя всіх основних модельних організмів, що використовуються для вивчення старіння, шляхи реакції поживних речовин, які регулюють старіння та вікову залежність геномної нестабільності в цих організмах, можуть дати уявлення про механізми, що пов'язують CR та зменшення раку. Незважаючи на те, що глисти та мухи є чудовими модельними організмами для вивчення старіння, їх переважно неділиться клітинна мережа та рідкісні фенотипи пухлини обмежують їх значення у дослідженнях механізмів вікового туморогенезу. Навпаки, прості S. cerevisiae можуть надати докази основних молекулярних механізмів вікової залежності геномної нестабільності, тоді як мишей можна вивчати, щоб визначити, чи застосовуються подібні механізми для ссавців. Тут ми розглядаємо основні шляхи та механізми, які, як вважають, пов’язують CR та геномну нестабільність та/або рак.
Шляхи, що опосередковують CR-залежне продовження тривалості життя, регулюють геномну нестабільність та ракоподібні фенотипи у S. cerevisiae
S. cerevisiae має переваги, мабуть, найпростіша та найкраще охарактеризована модельна система для вивчення старіння. Як спостерігали у ссавців (114), мутації, які з віком зростають у S. cerevisiae у 10 разів, зменшуються на CR (115–117). Делеція або TOR/SCH9, дріжджових гомологів ссавців-мішеней рапаміцину (mTOR) та S6-кінази (S6K) та/або AKT-генів, відповідно, і зниження регуляції Ras/аденилілциклази (AC)/шлях протеїнкінази А (РКА) відкладає це вікове збільшення спонтанних мутацій (118–120). Примітно, що регулювання зниження шляху Tor/Sch9 та Ras/AC/PKA необхідне для продовження тривалості життя у дріжджів за допомогою механізму, який передбачає регулювання вгору факторів транскрипції стійкості до стресу, описаних нижче.
На додаток до систем окисного стресу, шляхи Tor/Sch9 та Ras/AC/PKA регулюють експресію ряду генів відновлення ДНК (125). Серед них - ген REV1, який функціонує в системі відновлення трансляції, схильній до помилок, разом з полімеразою Polzeta. Саме система Rev1/Polzeta відповідає за більшу частину вікових мутацій ДНК (119). Докази свідчать про те, що шлях Tor/Sch9 сприяє виробленню супероксиду та зменшує антиоксидантний захист, регулюючи зниження Msn2/4 та Gis1. Ці зміни призводять до збільшення окисного пошкодження ДНК, а також до збільшення експресії гена REV1, що разом сприяє віковим точковим мутаціям (119). Активація схильної до помилок Rev1/Polzeta, як видається, генерує точкові мутації як частину процесу, необхідного для запобігання потенційно більш згубним валовим хромосомним перебудовам, які відбуваються при зупинці реплікації. Чи бере участь Rev1/Polzeta у CR-залежному впливі на захист ДНК, невідомо.
Молекулярні шляхи, що опосередковують протиракові наслідки обмеження калорій
Дослідження дріжджів, глистів та мух вказують на те, що шляхи інсуліну та IGF-I можуть бути важливими для старіння та раку у ссавців (рис. 3). У мишей мутації в генах Prop-1 або Pit-1, які спричиняють серйозні дефіцити GH та IGF-I, подовжують тривалість життя на 25-65% та викликають карликовість (126, 127). Ці недоліки, мабуть, опосередковують вплив мутацій Prop-1 та Pit-1 на тривалість життя, оскільки миші, які не можуть вивільняти GH у відповідь на вивільнення гормону росту, також живуть довше (128). Насправді карликові миші з високим рівнем GH у плазмі, але на 90% нижчим IGF-I (нульові миші GHR/BP) та гетерозиготні миші-нокаути рецепторів IGF-I живуть довше, ніж контролери дикого типу (129, 130).
Висновки та майбутні вказівки
Ймовірність захворіти на рак надзвичайно висока в США, де приблизно 44% чоловіків і
Подяка
Фінансування/підтримка: Підтримується грантовим номером UL1 RR024992 від Національного центру дослідницьких ресурсів (компонент Національних інститутів охорони здоров’я та Дорожньої карти медичних досліджень NIH), грантом Istituto Superiore di Sanità/Національного інституту охорони здоров’я, гранти від Ministero della Salute, грант Фонду «Довше життя» (Партнерство РГА/Університет Вашингтона), грант Фонду Бейкуелла та пожертва Благодійного фонду Скотта та Енні Епплбі.
Роль спонсора: Організація фінансування не мала жодної ролі в аналізі чи інтерпретації даних або в рішенні подати звіт для публікації.
Виноски
Розкриття інформації про фінанси: Автори не мали конфлікту інтересів.
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Обмеження калорій, старіння та профілактика раку Механізми дії та застосовності до людей
- Чи є періодичне голодування і обмеження калорій однакові метаболічні страви
- BBC Radio 4 - BBC Inside Science, обмеження калорій; Місячний вік; Марсовий двір; МГЕЗК
- Почергове денне голодування та обмеження калорій дають подібні результати у людей; Боротьба зі старінням!
- 7 способів обмеження калорій шкідливо - приготування їжі на Fleek ™