Нітрофурантоїн
Пов’язані терміни:
- Метаболіт
- Фуразолідон
- Циметидин
- Нітрофуразон
- Фармакологічний метаболізм
- Металеві органічні рамки
- Протимікробний засіб
Завантажити у форматі PDF
Про цю сторінку
Протимікробні препарати
Нітрофурантоїн
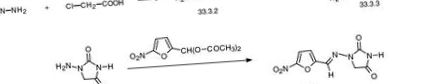
Нітрофурантоїн, 1- (5-нітрофурфуриліденаміно) гіддантоїн (33.3.5), синтезується з гідразинооцтової кислоти (33.3.2), яка синтезується взаємодією хлороцтової кислоти з гідразином. Реакція гідразинооцтової кислоти з ціанатом калію дає напівкарбазидоцтову кислоту (33.3.3), яка при нагріванні циклізується в 1-аміноідантоїн (33.3.4). Взаємодія цього з діацетилацеталем 5-нітрофурфуролу дає бажаний нітрофурантоїн [89–93].
Як і нітрофуразон, нітрофурантоїн є ефективним препаратом, що діє на ряд грампозитивних та грамнегативних мікроорганізмів (стафілококи, стрептококи, дизентерійна паличка, паличка товстої кишки, паратифозна паличка та інші). В основному застосовується для лікування інфекційних захворювань сечовивідних шляхів (пієліт, пієлонефрит, цистит, уретрит). Синонімами цього препарату є фурадонін, ітуран, фенурин, уролонг, цистофуран, нітрофурин та багато інших.
Тематичні дослідження в галузі виявлення наркотиків
Нітрофурантоїн: дивно успішний препарат
У 1953 р. Для лікування інфекцій сечовивідних шляхів був введений нітрофурантоїн (рис. 13.11), комерційно відомий як Macrobid ®, Macrodantin ® та Furadantin ®. Тоді ніхто не міг передбачити, що він врешті-решт буде включений до Переліку основних лікарських засобів Всесвітньої організації охорони здоров’я. Незважаючи на розробку широкого спектру сучасних антибіотиків, нітрофурантоїн залишається передовим засобом лікування неускладнених інфекцій сечовивідних шляхів. Крім того, незважаючи на десятиліття клінічного досвіду, повідомлення про стійкість бактерій залишаються рідкісними. Це суттєво контрастує з основними класами антибіотиків (наприклад, пеніциліни, хінолони), кожен з яких зазнав розвитку стійких штамів в результаті широкого клінічного застосування. З огляду на низький рівень стійкості до антибіотиків, який склався з моменту його первісного введення в продаж, може здатися логічним застосовувати цей препарат до інших типів бактеріальних інфекцій, але це неможливо. Нітрофурантоїн унікально здатний лікувати інфекцію сечовивідних шляхів, але інші бактеріальні інфекції не ефективно лікуються цим препаратом.
Малюнок 13.11. Нітрофурантоїн.
Для того, щоб зрозуміти, як цей препарат зберіг свою позицію в аптечці, слід вивчити як його механізм дії, так і його фармакокінетичні властивості. У випадку нітрофурантоїну існує безліч механізмів дії, які вбивають бактерії, що вторглися. Дослідження показали, що цей препарат вбиває бактерії через пошкодження ДНК, пошкодження РНК, пошкодження білка та інгібування циклу лимонної кислоти. 25 Той факт, що він діє за допомогою багатьох механізмів, пояснює відсутність розвитку опору. Стійкість розвивається в результаті природного відбору та мутації. Щоб бактерії розвинули стійкість до пеніциліну, потрібно подолати лише один механізм дії. Однак у випадку нітрофурантоїну мутації, які надають стійкість принаймні чотирьом перерахованим механізмам, повинні відбуватися в одному організмі. Шанси цього відбутися настільки малі, що це майже ніколи не відбувається.
Цікаво, що антибактеріальна активність нітрофурантоїну зумовлена структурною особливістю, якої не можна було б уникнути в сучасних програмах відкриття ліків, арил нітрогрупою. Цю особливу функціональність уникають у більшості сучасних програм виявлення наркотиків, оскільки вона є відомим фактором ризику канцерогенності, мутагенності та тератогенності. Як у людини, так і у бактерій арил нітрогрупи активуються ферментом нітроредуктазою, який перетворює нітрогрупу в нітрозогрупу, реактивну функціональність, яка пошкоджує ДНК, РНК та білки за допомогою нуклеофільних реакцій та окисно-відновної хімії. 26 Коли ці події відбуваються з бактерією, організм гине, і пацієнт щасливий (Рисунок 13.12 (а)), але якщо ці події відбуваються в клітинах пацієнта, результати можуть бути катастрофічними (наприклад, рак, токсичність, Рисунок 13.12 (б)). Як це, що сполука, яка, як відомо, виробляє потенційні канцерогени, мутагени та тератогени, може залишатися на ринку, особливо у світлі сильної уваги до безпеки в сучасну епоху розкриття наркотиків?
Малюнок 13.12. (а) Бактеріальна нітроредуктаза перетворює нітрофурантоїн у відповідну нітрозосполуку (червону), яка вбиває бактерії через пошкодження ДНК, пошкодження РНК та пошкодження білків. (b) Нітроредуктаза людини також перетворює нітрофурантоїн у відповідну нітрозосполуку (червону), яка є потенційним канцерогеном, мутагеном та тератогеном.
Відповідь на це питання полегшує вивчення фармакокінетичних властивостей нітрофурантоїну. При пероральному застосуванні доза 100 мг швидко виводиться після первинного всмоктування. Приблизно 75% дози метаболізується при першому проходженні, тоді як решта ∼25% виводиться у сечовивідні шляхи у вигляді незміненого препарату. Як результат, пікова концентрація дози нітрофурантоїну в дозі 100 мг у плазмі становить менше 1 мкг/мл, а проникнення в тканини незначне у всіх частинах тіла, крім сечових шляхів. З іншого боку, концентрація ліків у сечовивідних шляхах може перевищувати 200 мкг/мл. Це перевищує концентрацію, необхідну для знищення вторгнутих бактерій. 27 По суті, фармакокінетичні властивості нітрофурантоїну заважають йому потрапляти в інші частини тіла, обмежуючи його корисність для інфекцій сечовивідних шляхів і запобігаючи пошкодженню, пов’язаному з його механізмом дії. Розподіл тканин, метаболізм та виведення - це ключ до десятиліть успіху, який бачив цей препарат. Цікаво, що навряд чи цей препарат був би розроблений у сучасних програмах виявлення наркотиків. Це майже напевно було б відкинуто вбік на основі можливого ризику, пов'язаного з арил нітрогрупою.
Капілярний електрофорез - антибіотики
Нітрофурани
Нітрофурани фуразолідон, фуралтадон, нітрофурантоїн та нітрофуразон (які містять характерне 5-нітрофуранове кільце) зазвичай використовувались як кормові добавки для стимулювання росту та для запобігання бактеріальним та найпростішим зараженням худоби, аквакультури та бджолосімей (тобто шлунково-кишкового ентериту) спричинені E. coli та Salmonella spp., холерою птиці та чорними головками кокцидіозу). 26 Проте, з 1995 р. Використання цих антибіотиків повністю заборонено в ЄС, 27 США, Австралії, Філіппінах, Таїланді та Бразилії через побоювання щодо канцерогенності залишків ліків та їх потенційного шкідливого впливу на здоров'я людини. Однак аналіз метаболітів нітрофурану в продуктах харчування як і раніше необхідний як важливе питання безпеки харчових продуктів, оскільки, оскільки вони дешеві та ефективні, вони легко доступні та все ще використовуються в деяких країнах, що не входять до ЄС.
Одночасний контроль чотирьох нітрофуранів фуразолідону, фуралтадону, нітрофурантоїну та нітрофуразону (і навіть з їх метаболітами) здійснювався за допомогою MEKC-UV, використовуючи жовчну сіль (дезоксихолат натрію, SDC) у борат-фосфатному буфері при рН 9,0, MEEKC-UV з тетраборатним буфером натрію (рН 9,7) у присутності SDS, октану та бутан-2-олу ( Таблиця 8 ). Через відсутність у їх метаболітах ультрафіолетової хромофорної групи їх дериватизували агентом 2-нітробензальдегіду (2-NBA). Варто підкреслити, що фуралтадон з'являвся в аналізованих зразках (наприклад, риба-калкан) із вмістом, що перевищує дозволений європейським законодавством. Отже, ці методології сприяють виявленню та усуненню джерела забруднення для забезпечення хімічної безпеки харчових продуктів, а отже, і безпеки споживачів.
Біотрансформація
П. Jungsuwadee, M.E. Vore, у Комплексній токсикології, 2010
4.26.13.6 Селективність підкладки
Субстрати BCRP структурно різноманітні і включають численні лікарські засоби (нітрофурантоїн, циметидин), харчові канцерогени (PhIP), а також вітаміни рибофлавін та фолієву кислоту (Jonker et al. 2002; van Herwaarden et al. 2003). Сульфатовані кон'югати ліків та стероїдні гормони (наприклад, E1SO4), а також кон'югати глюкуронідів, також є чудовими субстратами (van Herwaarden and Schinkel 2006), хоча більше у мишей, ніж у щурів (Zamek-Gliszczynski et al. 2006b). Великі молекули, такі як метафоліт хлорофілу феофорбід та протопорфірин IX, також є субстратами BCRP, як показано у нульових мишей BCRP, які розвинули фототоксичність через накопичення дієтичного феофорбіду та продемонстрували підвищений рівень проторифірину IX у еритроцитах (Jonker et al. 2002). Як зазначалося вище, Крішнамурті та ін. (2007) продемонстрували роль BCRP у транспорті тетрапірольних структур. З огляду на його виявлення в стійких клітинних лініях пухлини, численні хіміотерапевтичні засоби, включаючи мітоксантрон, доксорубіцин, даунорубіцин та топотекан, були визначені як субстрати BCRP.
Намагаючись зрозуміти основу для різних специфік субстратів BCRP, клонованих із стійких клітинних ліній (R482G, R482T), порівняно з білком дикого типу (Sarkadi et al. 2006), Miwa et al. (2003) досліджували вплив мутантів BCRP з різними замінами амінокислот у регіонах ТМ на клітинну стійкість до лікарських засобів. Клітини, трансфіковані будь-якою з кДНК R482X-BCRP (X = N, C, M, S, T, V, A, G, E, W, D, Q та H, але не Y і K), виявляли вищу стійкість до мітоксантрону та доксорубіцину, ніж клітини, трансфіковані BCRP дикого типу. Мутант R482G також продемонстрував втрату транспортної активності для MTX, тоді як N557D продемонстрував подібну стійкість до мітоксантрону, але меншу стійкість до SN-38, ніж аналог дикого типу (Volk and Schneider 2003). Ці та інші дослідження показують, що E446 у TM2, R482 у TM3, N557 у TM5 та H630 у TM6 BCRP відіграють важливу роль у розпізнаванні їх субстрату (Miwa et al. 2003).
Печінкова токсикологія
Р. І. Санчес, Ф. К. Кауфман, у Комплексній токсикології, 2010
9.05.2.3 Скорочення
Подібно до номенклатури, що використовується для ферментів CYP, АКР класифікували на основі їх гомології послідовності (Penn Medicine). Надродина AKR налічує 14 сімей (AKR1–14), деякі з яких мають широкі субстратні особливості. АКР метаболізують стероїди, цукри, простагландини, поліциклічні ароматичні вуглеводні та нестероїдні альдегіди та кетони. AKR містяться майже в кожному живому організмі, але сімейства AKR1 та AKR7 є переважаючими AKR ссавців.
Надродина SDR включає ферменти, що беруть участь у метаболізмі стероїдів, цукрів, ароматичних вуглеводнів та простагландинів. Незважаючи на подібну специфіку субстрату, СПЗ структурно відрізняються від АКР. Зазвичай СПЗ містять 250–350 амінокислот і мають низьку гомологію послідовності (15–30%) (Kallberg et al. 2002), але їх тривимірні структури вкрай накладаються (Ghosh et al. 2001; Krook et al. 1993). Карбонілредуктази надродини SDR мають подібні субстратні специфіки до характеристик членів надродини AKR, але здатні приймати ароматичні кетони та хінони як субстрати (Wermuth et al. 1982). Менадіон та хінони поліциклічних ароматичних вуглеводнів є чудовими субстратами карбонільних редуктаз людини (Wermuth et al. 1986). Антрациклінові антибіотики, що використовуються як протипухлинні препарати, є субстратами карбонілредуктаз. Інактивація цих препаратів за допомогою редукції ферментів AKR або SDR була пов'язана з розвитком стійкості до карбонілсодержащих антрациклінів (Soldan et al. 1996). Наприклад, доксорубіцин відновлюється карбонілредуктазою до доксорубіцинолу, виду, пов’язаного з кардіотоксичністю (Olson et al. 2003).
Хінони, що походять з дієти, медикаментозної терапії або забруднювачів навколишнього середовища або генеруються ендогенно, підлягають зниженню на кількість ферментів. Одноелектронне відновлення за допомогою мікросомальної CYP-редуктази, мікросомально-редукованого нікотинаміду адениндинуклеотиду (NADH) -цитохрому b5-редуктази або мітохондріальної NADH-убихінон-оксидоредуктази призводить до утворення семіхінонів. Ці сполуки нестійкі у присутності молекулярного кисню і швидко реоксидуються, утворюючи вихідну сполуку та супероксидний аніон, що призводить до окисного стресу (Monks et al. 1992). В якості альтернативи за допомогою двоелектронної редукції цитозольні NAD (P) H-хінон-оксидоредуктази (NQO1, DT-діафораза) та дигідронікотинамід рибозид-хінон-оксидоредуктаза (NQO2) каталізують відновлення хінонів до гідрохінонів, які можна легко кон'югувати та усунути (Anusevicius 2002, Deller та співавт. 2008). Карбонілредуктази також каталізують двоелектронне відновлення хінонів (Wermuth et al. 1986).
Підходи до проектування та синтезу протипаразитарних препаратів
Сатьяван Шарма, Нітья Ананд, у Бібліотеці фармакохімії, 1997
2 НІТРОФУРАНИ
Нітрофурани в першу чергу відомі своєю антибактеріальною активністю; однак виявлено, що кілька сполук мають помітну активність проти філяріатозу та шистосомозу. При експериментальному філяріатозі нітрофуразон (1 ), нітрофурантоїн ( 2), ніфуртімокс (3), фуразолідон (4) і фурапіримідон (5) було показано, що вони знищують як мікрофілярії, так і дорослих глистів L. carinii у парентеральних дозах від 15 до 150 мг/кг протягом 5 днів [4–9]. З них ніфуртімокс (3), фуразолідон (4) і фурапіримідон (5) показали хорошу активність проти філяріатозу людини.
Після спостереження китайських вчених, що нітрофуразон (1) має профілактичну активність щодо S. japonicutn у щурів-альбіносів [10,11], велика кількість нітрофуранів синтезовано як потенційні шистосоміцидні засоби, з них F-30066 (фурапромідій, 6) та F-30385 (7) виникла як потужний антигельмінтний засіб [12,13]. Інший нітрофуран, SQ-18506 (8), також було показано, що він виявляє високу активність щодо грамнегативних та грампозитивних бактерій, грибів та шистосом [14–16]. На жаль, мутагенний потенціал різних нітрогетероциклів робить цей клас сполук підозрою як терапевтичні засоби [17,18] .
Репродуктивна та ендокринна токсикологія
Е.Дж. Жебрак,. C.M.J. Кіркпатрік, у Комплексній токсикології, 2010
11.22.2.2 Активний транспорт
Метаболічна активація та токсичність фуранотерпеноїдів
4 Висновок
Фуранотерпеноїди стають популярними через їх протипухлинну, антиоксидантну та багато інших фармакологічних ефектів. На жаль, оцінка безпеки цінних фуранотерпеноїдів відстає, і ще не проведено невеликої механістичної роботи щодо токсичних дій цих природних продуктів. Біоактивація цих сполук, що містять фуранові кільця, виявляється критичним етапом їх токсичності. Окислення фрагмента кільця фурану Р450, очевидно, ініціює токсичну дію фуранотерпеноїдів. Два типи реактивних проміжних продуктів, фураноепоксид та цис-ендіаль, утворюються під час біотрансформації фуранотерпеноїдів шляхом епоксидування та окислювального відкриття фуранового кільця, каталізованого Р450. Обидва проміжні продукти є електрофільними та реагують на нуклеофіли білків та нуклеїнових кислот. Пропонується модифікація макромолекул, щоб викликати різновиди токсичності.
Однак не обов'язково робити висновок, що всі фурансодержащие сполуки можуть метаболізуватися до двох типів реакційноздатних проміжних сполук. Нітрофурантоїн (NFT), похідне 5-нітрофурану, давно використовується для лікування специфічних інфекцій сечовивідних шляхів [255]. На жаль, повідомляється, що тривале використання NFT може призвести до гепатотоксичності [256–265]. Нещодавно ми продемонстрували, що біоактивація NFT може спричинити епоксидування фуранового фрагменту з окисленням P450, а потім денітрацію за допомогою реакції елімінації (схема 2.9), в той час як цис-ендіали не були виявлені в результаті захоплення [266]. Ми вважаємо, що заступники на кільці фурану будуть диктувати шляхи метаболізму сполук, що містять фуран. Структурні характеристики замінників можуть впливати на біоактивацію фуранового кільця.
Схема 2.9. Запропоновані шляхи утворення NFT-кон'югатів шляхом опосередкованого окисленням P450 [266] .
Крім того, утворення цис-ендіалів як реактивних метаболітів сполук фурану не обов'язково означає, що ці фурани є токсичними. Празозин, 2-заміщений похідний фурану, є антигіпертензивним засобом, і жодних проблем із безпекою не повідомлялося, незважаючи на те, що розкриття кільця фурану, опосередковане Р450, є основним шляхом метаболізму цього препарату [267-269]. Відповідний метаболіт алкоголю, виявлений у мікросомальних інкубаційних сумішах, припускає, що відсутність токсичності, яка спостерігається при празозині, може бути наслідком швидкого відновлення/окислення реактивного метаболіту (схема 2.10). Іншими словами, швидка детоксикація реактивного проміжного продукту, ймовірно, є критичним процесом, що запобігає потенційній токсичності.
Схема 2.10. Запропоновані метаболічні шляхи утворення алкоголю празозину та відповідних кон’югатів GSH [267,268] .
- Крокомір - огляд тем ScienceDirect
- Статична вправа - огляд тем ScienceDirect
- Ротаційні сушарки - огляд тем ScienceDirect
- Культура початківців - огляд тем ScienceDirect
- Пікосульфат натрію - огляд тем ScienceDirect