Нікотинамід фосфорибозилтрансфераза
NAMPT - це обмежуючий швидкість фермент, який перетворює нікотинамід у нікотинамід-мононуклеотид у біосинтетичному шляху NAD із нікотинаміду у ссавців (Revollo et al., 2004, 2007).
Пов’язані терміни:
- Нікотинамід
- Анаболізм
- Нікотинамід аденин динуклеотид
- АМФ-активована протеїнкіназа
- Сіртуїн
- Вкладений ген
- Добовий ритм
- Ссавці
Завантажити у форматі PDF
Про цю сторінку
Регенерація та старіння: регулювання Сіртуїнами та шляхами NAD + Salvage
Ніка М. Боррадейле,. Дж. Джеффрі Пікерінг, Регенеративна нефрологія, 2011
Nampt - це NAD + -регенеруючий фермент
З біохімічної та функціональної точки зору існують цікаві паралелі між Nampt та одним із ферментів, який виявляє опосередковування тривалості життя дріжджів. Першим етапом регенерації NAD + з нікотинаміду у S. cerevisiae є дезамідування нікотинаміду продуктом гена PNC1 з утворенням нікотинової кислоти. PNC1 індукується стресом клітин та обмеженням поживних речовин. Збільшення дози гена PNC1 продовжило тривалість життя цього організму, виснажуючи нікотинамід та активуючи Sir2 [99]. Однак ген, гомологічний PNC1 у людини, схоже, не існує. Замість початкової стадії дезамідації, порятунок NAD + у людей вимагає перетворення нікотинаміду в нікотинамід-мононуклеотид, реакція каталізується Nampt. Nampt був суттєво підвищений, коли SMC піддавалися стресу повного виведення сироватки [77]. Ян та ін. виявили подібну регуляцію Nampt після виведення сироватки з клітин фібросаркоми HT1080 та з первинних кардіоміоцитів [100], підтверджуючи концепцію, що Nampt є реагуючим на стрес геном. Таким чином, ссавці Nampt можуть бути функціональним еквівалентом дріжджів Pnc1 [91,99,100] .
Кофактори
Леонардо Сорчі,. Андрій Л. Остерман, у "Комплексні природні продукти II", 2010
7.08.2.2.3 Нікотинамід фосфорибозилтрансфераза
На відміну від деяких представників сімейства NAPRT, охарактеризовані ферменти NMPRT ссавців не продемонстрували жодних доказів поведінки активації АТФ. Тривимірні структури людських та мишачих NMPRT вирішували в апоформі та в комплексі з продуктом реакції NMN. 138–140 Ці дані показали, що, незважаючи на значну загальну схожість з НАПРТ, цей фермент є гомодимером. Структурне порівняння NMPRT з двома іншими сімействами ферментів показало, що сигнальний залишок Asp-219 NMPRT є ключовим фактором, що визначає перевагу його субстрату до амідованої форми піридинового субстрату. 3D-структура NMPRT в комплексі з його потужним інгібітором малих молекул APO866 (також відомим як FK-866) показала, що він зв'язується в тунелі на межі розділу димеру NMPRT, безпосередньо конкуруючи з Nm-підкладкою. 138141
Деякі інші ферменти, про які відомо, що беруть безпосередню участь у біогенезі мононуклеотидів піридину шляхом утилізації та переробки піридинів та піридинових нуклеозидів, менш повсюдні, ніж описані вище три сімейства фосфорибозилтрансфераз. Тут ми коротко опишемо деякі з найбільш вивчених ферментів, що врятувались, що потрапили в Малюнок 2 і Таблиця 1 .
Ожиріння
Габріель Анхель Мартос-Морено,. Хесус Аргенте, у “Вітаміни та гормони”, 2013
5.2 Вісфатин/фактор, що підвищує колонію пре-В-клітин/нікотинамід фосфорибозилтрансфераза
Позитивна кореляція між рівнями NAMPT/вісфатину в сироватці крові та вмістом жиру в організмі та зниженням рівня його циркуляції після зменшення ваги була описана у дорослих (Haider, Holzer, et al., 2006). Однак дані, що свідчать про те, що його експресія вища у вісцеральній, ніж у підшкірній жировій клітковині, суперечливі (Berndt et al., 2005; Revollo et al., 2007), причому деякі автори припускають, що цей адипокін може бути лише маркером загальної маси ВАТ . Більше того, вплив втрати ваги на рівень вісфатину в сироватці крові у дорослих залишається предметом обговорення, як зменшення (Manco et al., 2007), так і збільшення (Krzyzanowska, Mittermayer, Krugluger, Kopp, & Schernthaner, 2006) циркулюючого вісфатину після Повідомлялося про значну втрату ваги у дорослих із ожирінням після хірургічних процедур.
Кілька авторів вивчали рівень NAMPT/вісфатину протягом життя плода та у новонароджених, а також їх взаємозв'язок із гестаційним віком та вагою при народженні. Ці звіти продемонстрували високий рівень NAMPT/вісфатину протягом життя плода, ймовірно, похідний від експресії плаценти та перенесення цього адипокіну на плід (Malamitsi-Puchner, Briana та ін., 2007), з позитивною кореляцією між рівнями NAMPT/вісфатину та вага при народженні як у здорових недоношених, так і у доношених новонароджених (Malamitsi-Puchner, Briana, et al., 2007; Siahanidou, Margeli, Kappis, Papassotiriou, & Mandyla, 2011). Це узгоджується з більшістю (Cekmez et al., 2011; Meral et al., 2011), але не з усіма (Evagelidou et al., 2010) дослідженнями, що демонструють більш високі рівні NAMPT/вісфатину у великих для гестаційного віку (LGA) новонароджених. Ефект обмеження внутрішньоутробного росту на рівні вісфатину залишається суперечливим, повідомляється, що новонароджені СГА мають подібні (Mazaki-Tovi et al., 2010) або вище (Malamitsi-Puchner, Briana, et al., 2007) NAMPT/вісфатин, ніж ті, що народилися з адекватною антропометрією для їх GA (AGA). Одним із можливих пояснень відмічених відмінностей є вплив статі на ці стосунки, оскільки, як повідомляється, жінки мають вищий рівень, ніж чоловіки (Ibáñez et al., 2008).
Дослідження рівня NAMPT/вісфатину у худорлявих дітей є рідкісними (Dedoussis, Kapiri, Kalogeropoulos, et al., 2009; Friebe et al., 2011), причому більшість даних надходять від худих суб’єктів, включених як контрольні групи для порівняння з дітьми з ожирінням ( Evagelidou et al., 2010; Jin et al., 2008). Ці дослідження виявляють позитивну кореляцію між NAMPT/вісфатином та ІМТ навіть у худорлявих дітей (Dedoussis, Kapiri, Kalogeropoulos та ін., 2009), без статевого диморфізму або змін під час статевого дозрівання у будь-якої статі (Friebe et al., 2011). Крім того, не спостерігали кореляції NAMPT/вісфатину з висотою або сурогатними маркерами росту (IGF-I) або розвитку пубертату (андрогени надниркових залоз, тестостерон та естрадіол) (Dedoussis, Kapiri, Kalogeropoulos, et al., 2009; Friebe та ін., 2011; Jin та ін., 2008).
Вищий рівень циркуляції NAMPT/вісфатину у дітей із ожирінням та їх позитивна кореляція з ІМТ та його сурогатними маркерами (лептин та sLEP-R) повідомляється у різних серіях дітей та підлітків (Araki et al., 2008; Friebe et al., 2011; Haider, Schindler, et al., 2006; Kolsgaard et al., 2009), а також у дітей допубертатного періоду, що навчались окремо (Martos-Moreno, Kratzsch, et al., 2011). У цьому віковому діапазоні взаємозв'язок між НАМФТ/вісфатином та сусцератами вісцерального жиру є невизначеним, оскільки його кореляція з обхватом талії зникає після контролю за ефектом ІМТ. Це свідчить про те, що на рівень вісфатину у дітей із ожирінням впливає насамперед загальна кількість жиру в організмі, а не його розподіл (Haider, Schindler та ін., 2006; Martos-Moreno, Kratzsch та ін., 2011). Втрата ваги призводить до початкового зниження рівня NAMPT/вісфатину у дітей та підлітків (Krzystek-Korpacka, Patryn, Bednarz-Misa, Hotowy, & Noczynska, 2011; Martos-Moreno, Kratzsch, et al., 2011), які залишаються стабільними після більш масштабної втрати ваги (Martos-Moreno, Kratzsch, et al., 2011).
Було запропоновано взаємозв'язок між рівнем NAMPT/вісфатину та метаболізмом ліпідів, з прямою кореляцією між рівнем NAMPT/вісфатину в циркулюючій і мРНК тканини та рівнем холестерину у дорослих та ожирілих дорослих (Chang, Chang, Lee, & Chuang, 2010). Враховуючи вплив вмісту жиру в організмі на рівень вісфатину, припускають, що це може бути епіфеноменом, зумовленим змінами ІМТ та/або метаболізму вуглеводів. Цю гіпотезу підтверджує той факт, що у дітей спостережувані кореляції NAMPT/вісфатину із загальним та холестерином ЛПНЩ, але не з ЛПВЩ (Jin et al., 2008), втрачають свою значимість після контролю обох параметрів (Мартос-Морено, Kratzsch та ін., 2011).
NAMPT/вісфатин виробляється переважно лейкоцитами як у кровотоці (Friebe et al., 2011), так і в стромально-судинній фракції жирової тканини, особливо макрофагами підтипу M1 та іншими мононуклеарними клітинами, інфільтруючими жирову тканину при ожирінні під впливом запальні сигнали (Curat et al., 2006; Dedoussis, Kapiri, Samara, et al., 2009). Це, на додаток до позитивних кореляцій між цим адипокіном та іншими прозапальними факторами, такими як IL-6 (Martos-Moreno, Kratzsch, et al., 2011; Romanowska & Lebensztejn, 2010), TNF-α (Dedoussis, Kapiri, Kalogeropoulos, та ін., 2009), або резистин (Martos-Moreno, Kratzsch, et al., 2011), незалежно від ІМТ, підкреслює свій внесок у формування слабо запального стану, пов’язаного з ожирінням.
NAD + -залежні деацетилази та медична терапія
А. Кумар,. М. Двір-Гінзберг, у Медичній епігенетиці, 2016
Регулювання ферментним шляхом NAMPT, що обмежує норму
Регуляція сиртуїнів шляхом системного НАД + біосинтезу
2.5 Заключні зауваження
Жирові гормони, адіпокіни
Вісфатин
На сьогоднішній день кілька досліджень зафіксували підвищення рівня вісфатину в плазмі крові у різних когортах пацієнтів із ожирінням та/або іншими компонентами метаболічного синдрому. Однак є також суперечливі дані досліджень, згідно з якими повідомляється, що концентрація вісфатину у плазмі крові залишається незмінною або нижча у пацієнтів із ожирінням порівняно зі здоровими людьми із нормальною вагою. Результати метааналізу, що вивчав цю суперечку шляхом систематичного перегляду наявної літератури, показали, що рівень вісфатину в циркуляції був вищим у пацієнтів із ожирінням, метаболічним синдромом, СД2 та ССЗ, а також позитивно асоціювався з резистентністю до інсуліну. 23 Ця асоціація свідчить про те, що секреція вісфатину стимулюється гіперглікемією в контексті компенсаторного механізму, оскільки вісфатин збільшує секрецію інсуліну та фосфорилювання рецепторів інсуліну в бета-клітинах підшлункової залози миші. 24
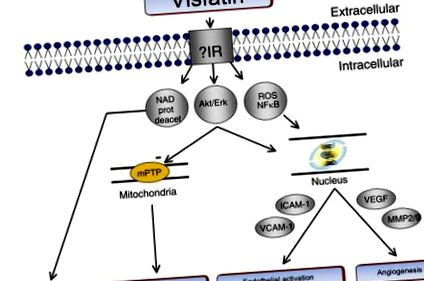
Малюнок 7.5. Схематичне зображення індукованих вісфатином сигнальних шляхів, які потенційно можуть включати рецептор інсуліну (ІЧ). NAD: нікотинамід аденін динуклеотид; ERK: позаклітинна регульована сигналом кіназа; Akt: серин/треонінкіназа, також відома як протеїнкіназа В; АФК: реактивні форми кисню; NF-κB: ядерний фактор-каппаB; mPTP перехідна пора проникності мітохондрій; ICAM-1: молекула міжклітинної адгезії-1; VCAM-1: молекула адгезії судинних клітин-1; VEGF: судинний фактор росту ендотелію; ММП: матричні металопротеїнази; VSMC, судинна клітина гладких м’язів.
Від ді-джея Хаузенлой. Можливості виявлення наркотиків від кардіопротекції вісфатину? Curr Opin Pharmacol 2009;9(2): 202–7.
Крім того, вісфатин стимулював проліферацію ендотелію та формування капілярної трубки в ендотеліальних клітинах пуповинної вени людини (HUVEC) завдяки збільшенню продукції судинного фактора росту ендотелію (VEGF) та матричних металопротеїназ (MMP-2 та MMP-9), опосередкованих MAPK/PI3K-Akt/Сигнальні шляхи VEGF. 116 Вісфатин також стимулював проліферацію судинних клітин гладком’язової мускулатури за допомогою активованої нікотинамідом мононуклеотидом активації позаклітинної регульованої сигналом кінази (ERK 1/2) та сигнальних шляхів p38. 117 Цікаво, що вісфатин знижував апоптоз у HUVEC та індукував дозрівання в клітинах гладких м’язів судин людини. 116118 Відповідно до вищезазначених ефектів на ендотеліальні та судинні клітини гладких м’язів, клінічні дані підтверджують, що рівні вісфатину в плазмі крові негативно корелювали з функцією ендотелію судин у пацієнтів із СД2. 119 Нарешті, вісфатин чинив ендотелійзалежний судинорозширювальний ефект на ізольовані кровоносні судини щурів, який не опосередковується за допомогою рецепторів інсуліну, а через одержуваний ендотелієм NO. 120
Метаболічний синдром у педіатрії
Ромі Курсаве, Нікола Санторо, «Досягнення клінічної хімії», 2014
9.7 Вісфатин
Вісфатин також відомий як фактор, що підвищує кількість колоній перед В-клітиною, або Nampt, оскільки він є обмежуючим ферментом у біосинтезі нікотинаміду адениндинуклеотиду (NAD) [195]. Вперше вісфатин був виділений з вісцерального жиру людини та мишей, але також експресується у лейкоцитах, адипоцитах, м’язових клітинах та гепатоцитах [196–199]. Однак у жировій тканині він може бути головним продуктом інфільтруючих макрофагів на відміну від адипоцитів. У моноцитах CD14 + вісфатин індукував експресію IL-1β, TNF-α, IL-6 та інших молекул CD [200] .
Хоча вісфатин часто може підвищувати регуляцію в стані ожиріння, його вплив на чутливість до інсуліну та основні механізми поки не ясні. Не спостерігали кореляції експресії вісфатину в плазмі та експресії вісфатину в підшкірній клітці або ПДВ [201,202], хоча рівні вісфатину в сироватці крові значно зменшувались після шлункового шунтування у хворих із ожирінням пацієнтів [203], а також рівень сироватки вісфатину вище у пацієнтів з діабетом та діабетичною нефропатією [204]. В даний час вісфатин розглядається як позаклітинний нікотинамід фосфорибозилтрансфераза (eNampt), і, схоже, він відіграє важливу роль у секреції інсуліну з β-клітини підшлункової залози шляхом системного біосинтезу NAD [199]. In vitro та in vivo вісфатин імітує дію інсуліну, але в дослідженнях на людях він парадоксально збільшується в умовах захворювання і демонструє кореляцію із системним запаленням, судинними ускладненнями та секрецією інсуліну [200,205] .
Том І
AMPK та SIRT1
Фармакоепігенетичні процесори: епігенетичні препарати, резистентність до наркотиків, токсикоепігенетика та нутрієпігенетика
Рамон Какабелос,. Пабло Какабелос, Фармакоепігенетика, 2019
6.3.3.32 Подвійні/гібридні інгібітори
Розроблено інгібітори подвійного індолеамін 2,3-діоксигенази 1 (IDO1) та інгібіторів гістону деацетилази (HDAC). З'єднання 10 демонструє прийнятні фармакокінетичні профілі як перорально активного протипухлинного агента та як цінного зонду для з'ясування взаємозв'язку та механізмів між імунотерапією раку та епігенетикою. 162
Романі подвійні інгібітори нікотинаміду фосфорибозилтрансферази (NAMPT) та гістондеацетилази (HDAC) також були розроблені з використанням методу злиття фармакофори. Інгібітори тіазолокарбоксаміду були високоактивними для обох мішеней, при цьому сполука 7f демонструє потужну протипухлинну ефективність in vivo на моделі ксенотрансплантата HCT116. 163 Про перші малі молекули, що одночасно інгібують нікотинамід фосфорибозилтрансферазу (NAMPT) та гістону деацетилазу (HDAC), повідомляють Dong et al. 164 З'єднання 35 має чудові та збалансовані дії проти NAMPT та HDAC1, ефективно індукуючи апоптоз клітин та аутофагію.
Інгібітори HDAC та донори NO поєднуються в гібридних молекулах. Нітроокси-групи або заміщені похідні фуроксану приєднували до α-положення піридинового кільця селективного інгібітора HDAC класу I MS-275. Їх асоціація з динітроокси-сполукою 31 або похідним фуроксану 16 надає гібридним сполукам здатність зберігати однокомпонентну активність. Ці сполуки можуть представляти нові терапевтичні засоби для серцево-судинних, нервово-м’язових та запальних захворювань. 165
Як HDAC1/2, так і LSD1 виявляються у поєднанні з репресорним білком CoREST у транскрипційному комплексі корепресорів, який відповідає за приглушення генів. Комбінована модуляція обох цілей призводить до синергетичної антипроліферативної активності. Була розроблена нова серія інгібіторів подвійного зв’язування HDACs-LSD1 на основі поліаміну, отриманих шляхом зв’язування вориностату та транилципроміну. 166
Метилювання гістону 3 лізином 9 (H3K9Me2) та глобальне деацетилювання білків гістону пов’язані з множинними фенотипами раку, включаючи лейкемію, карциному передміхурової залози, гепатоцелюлярну карциному та легеневу карциному. Занг та ін. 167 повідомили про першу малу молекулу, здатну діяти як подвійний інгібітор, націлений як на G9a, так і на HDAC.
Тваринні моделі для розладів хронобіології
NAD Біосинтез та сиртуїни
Подібно до сімейства білків рецепторів ядерних гормонів, існування цього шляху, пов’язаного з годинником, є особливо інтригуючим, оскільки NAMPT та SIRT1 регулюються не тільки годинником, але й харчовим статусом організму. Наприклад, Nampt регулюється у відповідь на зниження рівня глюкози в скелетних м’язах способом, що залежить від активованої аденозину монофосфатом протеїнкінази (AMPK), 54, 55, а обмеження натще або калорій підвищує рівень SIRT1 у багатьох тканинах. 56-59 NAD та SIRT1 регулюють безліч метаболічних процесів, що стимулюються, включаючи стимульовану глюкозою секрецію інсуліну, диференціацію адипоцитів та глюконеогенез, 60 на додаток до регулювання основного годинникового механізму. Таким чином, об’єднуючою гіпотезою є те, що шлях NAMPT-SIRT1-CLOCK/BMAL1 є метаболічним циклом зворотного зв’язку, який координує щоденні цикли годування, використання палива, сну та активності.
- Тіосульфат натрію - огляд тем ScienceDirect
- Сметана - огляд тем ScienceDirect
- Relaxin 3 - огляд тем ScienceDirect
- Короткий зріст - огляд тем ScienceDirect
- Шкірний кровотік - огляд тем ScienceDirect