Немовля з гіпералертністю, гіперкінезами та недостатнім процвітанням: рідкісний діенцефальний синдром через анапластичну астроцитому гіпоталамуса
Алесія Стіваль
1 відділення нейроонкології, кафедра дитячої медицини, дитяча університетська лікарня імені Ани Мейєр та кафедра наук про здоров'я, Університет Флоренції, Флоренція, Італія
Мауріціо Луккезі
1 відділення нейроонкології, кафедра дитячої медицини, дитяча університетська лікарня імені Ани Мейєр та кафедра наук про здоров'я, Університет Флоренції, Флоренція, Італія
Сільвія Фаріна
1 відділення нейроонкології, кафедра дитячої медицини, дитяча університетська лікарня імені Ани Мейєр та кафедра наук про здоров'я, Університет Флоренції, Флоренція, Італія
Анна Марія Букколієро
2 Патологічне відділення, Дитяча університетська лікарня імені Ани Мейер, Флоренція, Італія
Франческа Кастільоне
2 Патологічне відділення, Дитяча університетська лікарня імені Ани Мейер, Флоренція, Італія
Лоренцо Геніторі
3 відділення нейрохірургії, відділення нейронаук, дитяча університетська лікарня імені Ани Мейер, Флоренція, Італія
Мауріціо де Мартіно
1 відділення нейроонкології, кафедра дитячої медицини, дитяча університетська лікарня імені Ани Мейєр та кафедра наук про здоров'я, Університет Флоренції, Флоренція, Італія
Якопо Сарді
1 відділення нейроонкології, кафедра дитячої медицини, дитяча університетська лікарня імені Ани Мейєр та кафедра наук про здоров'я, Університет Флоренції, Флоренція, Італія
Анотація
Передумови
Діенцефалічний синдром - рідкісний клінічний стан, коли не вдається процвітати, незважаючи на нормальне споживання калорій, гіпералертність, гіперкінези та ейфорію, як правило, пов’язані з низькоякісними астроцитомами гіпоталамуса.
Презентація справи
Ми повідомили про незвичайний випадок диенцефальної кахексії через анапластичну астроцитому гіпоталамуса (ІІІ ступінь ВООЗ). Базова оцінка ендокринної функції була проведена у цього пацієнта до операції. Після гістологічного діагнозу він записався на програму хіміотерапії з послідовною хіміотерапією у високих дозах з подальшим порятунком гемопоетичних стовбурових клітин. Остання оцінка МРТ показала хороший відгук. Пацієнт досі живий з хорошими зоровими функціями через 21 місяць після початку хіміотерапії.
Висновки
Діенцефалічна кахексія рідко може бути наслідком високоякісної астроцитоми гіпоталамуса. Ми вважаємо, що дієтична підтримка хіміотерапії, що застосовується у високих дозах без променевої терапії, може бути ефективною стратегією лікування захворювання з поганим прогнозом.
Передумови
Неможливість процвітати (FTT) є важливою і відносно частою проблемою у грудному віці. У розвинених країнах, за наявності ФТТ у дитячому віці, слід підозрювати незвичайне захворювання, якщо дієтичні та поведінкові втручання були невдалими. Недостатнє споживання калорій, неадекватне поглинання калорій або підвищена потреба в енергії можуть спричинити стан гіпотрофії, і всі прийняті діагностичні зусилля повинні бути спрямовані на розрізнення джерела [1]. Поширеними педіатричними станами, пов'язаними з FTT, є гастро-стравохідний рефлюкс, хвороба Крона, целіакія, муковісцидоз, психічні розлади, такі як нервова анорексія та інші хронічні захворювання (неврологічні, серцеві, нефрологічні, ревматологічні, онкологічні, легеневі, імунологічні захворювання та хронічні інфекції). Хоча ФТТ у дитячому віці є частим явищем, органічні причини рідкісні [2].
Діенцефалічний синдром (ДС), також відомий як синдром Рассела або диенцефалічна кахексія, є рідкісним станом, пов’язаним з гіпоталамічною/хіазматичною пухлиною [3]. DS є рідкісним розладом, але потенційно летальним, тому його швидка діагностика та лікування мають вирішальне значення для життя пацієнта.
Пухлини, пов’язані з ДС, як правило, є пілоцитарними (ІОЗ I ступеня) або піломіксоїдними (ІІО ВОЗ ІІІ) астроцитомами у маленьких дітей. Клінічними особливостями ДС є втрата ваги, що призводить до сильного виснаження, незважаючи на нормальне споживання калорій, гіпералертність, гіперкінез та ейфорію. Темпи приросту, як правило, залишаються лінійними. З моменту першого повідомлення про ДС, додаткові симптоми, такі як ністагм, гідроцефалія та блювота, є можливими проявами синдрому [4, 5].
Лікування ДС суворо пов’язане з лікуванням ураження гіпоталамуса: було показано, що клінічні ознаки та симптоми ДС регресують, коли пухлина видаляється хірургічним шляхом або зменшується нехірургічною терапією. Оскільки повна резекція гіпоталамо-хіазматичних уражень часто важка, часткова резекція супроводжується хіміотерапією та/або променевою терапією, яка може представляти єдине лікування, коли маса не піддається резекції [6]. Однак, будучи маленькими дітьми, променева терапія - не перший вибір лікування. Були оцінені різні схеми хіміотерапії для зупинки росту пухлини при цьому типі пухлин. Поки є ознаки та симптоми ДС, пацієнти потребують харчової підтримки, щоб уникнути наслідків виснаження та кахексії.
Досвід, наведений тут, свідчить про те, що хіміотерапія у високих дозах з аутологічною трансплантацією стовбурових клітин може бути ефективною для досягнення тривалого виживання без прогресування у пацієнтів із ДС, пов’язаних із гіпоталамусовою астроцитомою високого ступеня. Значимість нашого досвіду випливає з того факту, що існують лише клінічні дослідження з лікування низькоякісних гліом у хворих на ДС.
Презентація справи
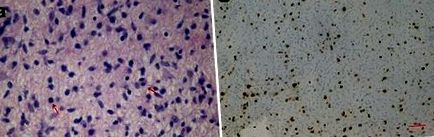
Мікрофотографії ураження: астроцити з ядерною атипією та мітозом (стрілки) (a: гематоксилін та еозин, 40X) та високий індекс проліферації (b, Ki-67 mmunocoloration, 10X). Хірургічний зразок звичайно фіксували у нейтральному буферному формалі і вкладали у парафін. Один гістологічний зріз товщиною 5 мкм, отриманий з кожного парафінового блоку, фарбували гематоксиліном та еозином. Подальші розділи найбільш репрезентативного парафінового блоку використовувались для імуногістохімії та молекулярного аналізу. Імуногістохімічні дослідження проводили із застосуванням стандартної методики стрептавідин-біотин та комерційно доступних антитіл (гліальний фібрилярний кислотний білок, GFAP; білок p53; Synaptophysin, SP; Ki-67). Гени BRAF та H3F3 аналізували, як описано раніше [7, 8]
Серійні МРТ-дослідження показують реакцію на хіміотерапію високими дозами у п’ятимісячного немовляти з анапластичною астроцитомою гіпоталамуса. Осьове та корональне Gd-посилене T1-зважене МР сканування: негайно постбіопсійне зображення ураження гіпоталамуса (a-b); c МРТ після хіміотерапії, що демонструє часткову відповідь (c-d); МРТ показує стабільне захворювання через 27 місяців з моменту встановлення діагнозу (e-f)
Через п’ять місяців після діагностики МРТ показали зменшення об’єму (часткова відповідь за критеріями RANO) [10] (рис. 2, c c - -d). г). Після одужання від ускладнень вага починала зростати до задовільного рівня (рис. 1). На момент написання цього звіту за нашим молодим пацієнтом ще активно стежили. Він залишається живим із залишковими захворюваннями через 27 місяців після початку хіміотерапії (стабільне захворювання за критеріями RANO) [10] (рис. 2, e e - -f f).
Висновки
FTT можна визначити як стан, що характеризується поганим збільшенням ваги або серйозною втратою ваги. Це може бути наслідком різних розладів як несприятливого середовища, психологічних факторів або органічних захворювань. Основним питанням за наявності підозри на ФТТ є причина недоїдання. Діагностичні зусилля повинні бути спрямовані на те, щоб визначити, чи є проблема другорядною через недостатнє споживання, недостатнє засвоєння або надмірну потребу в калоріях. Незважаючи на свою клінічну мінливість, ФТТ залишається найпоширенішим симптомом ДС під час діагностики та основною причиною звернення пацієнта до лікаря, тоді як довжина/зріст, як правило, залишається незмінним [4, 5, 11, 12]. Клінічними особливостями виснаження, які можуть викликати підозру на ДС, пов’язану з пухлинами ЦНС, є втрата ваги, виражена відсутність підшкірного жиру та генералізована ліподистрофія без ознак порушення всмоктування та психічних розладів. Деякі найпоширеніші симптоми на початку включають втрату гостроти зору, дефіцит поля зору, косоокість, ністагм, проптоз та гіпоталамічний синдром через гормональну дисфункцію [4, 13–15].
На відміну від інших методів терапії LGG, наш недавній досвід показав, що менші дози цисплатину (25 мг/м2/добу) та етопозиду (100 мг/м2/добу) є, мабуть, однією з найбільш активних схем зі зниженою нейротоксичністю та мієлотоксичністю для лікування діти з ДС, пов’язаними з низькоякісною оптико-гіпоталамічною гліомою [20].
Результат для дітей з повноцінними астроцитомами залишається похмурим, незважаючи на агресивну хірургічну резекцію та променеву терапію з подальшою допоміжною хіміотерапією. Намагаючись поліпшити результат для цієї групи дітей, клініцисти вивчали роль високодозової аблятивної хіміотерапії, що супроводжується аутологічним врятуванням гемопоетичних клітин.
Гарре та ін. показав дані щодо невеликої серії злоякісної гліоми, проведеної централізовано, у дітей молодше 3 років при діагностиці, які у шести випадках лікувались із графіком послідовної хіміотерапії у високих дозах із застосуванням високих доз метотрексату, етопозиду, циклофосфаміду та карбоплатину, після два курси з карбоплатином/етопозидом та тіотепою/мелфаланом у мієлоаблативних дозах та порятунок гемопоетичних стовбурових клітин. Фокальна променева терапія проводилася лише у випадку прогресуючого та/або залишкового захворювання в кінці хіміотерапії [7].
Ми повідомляли про рідкісний випадок діенцефального синдрому через анапластичну астроцитому гіпоталамуса (ІІІ ступінь ВООЗ). Він записався на програму хіміотерапії з послідовною хіміотерапією у високих дозах, після чого два курси з тіотепою в мієлоаблативних дозах та аутологічну трансплантацію гемопоетичних стовбурових клітин. Через 27 місяців після початку хіміотерапії пацієнт все ще живий зі стабільним захворюванням та хорошою зоровою функцією.
Багато дослідників оцінювали ендокринологічні відхилення, які можуть зіграти певну роль у патогенезі ДС. Повідомлялося, що або рівень ГР був підвищений, або регуляція секреції РГ була змінена. Зокрема, часткова резистентність до GH у пацієнтів із ДС спостерігалась [12]. Додаткові дослідження гіпоталамо-гіпофізарних факторів, що беруть участь у регуляції апетиту та метаболізмі, можуть прояснити патогенез ДС. Було висловлено гіпотезу, що цитокіни як IL-1, IL-6, IFN-γ, TNF-α, похідний від мозку нейротрофічний фактор, MIC-1 можуть брати участь у процесі кахексії, в дисбалансі, який сприяє катаболізму над анаболізмом, і в неврологічні та нервово-психічні прояви захворювання. Похідні від пухлини молекули, пептиди/нейропептиди, нейромедіатори та гормони, як лептин та GH-релін, можуть взаємодіяти з цитокінами при генерації/розвитку процесу кахексії [21]. Хоча ці біохімічні зміни були описані як патологічні механізми кахексії раку, на жаль, біохімічні причини ДС залишаються невідомими.
Пацієнтам із ДС потрібна адекватна харчова підтримка, яка повинна бути встановлена якомога швидше. Усний маршрут - це перший вибір. Однак у ряді випадків ентеральне або парентеральне харчування може забезпечити дітей, які не можуть годувати поживними речовинами, необхідними для забезпечення належного росту, для виправлення або запобігання недоїдання [22].
Вибір між різними видами штучного вигодовування слід робити, виходячи з клінічних умов. Зокрема, ентеральне введення поживних речовин через зонд травної системи показано пацієнтам з пероральним харчуванням, недостатнім для підтримання адекватного харчового статусу. З цією метою гастростомія широко застосовується для її безпечного прямого доступу до шлунку через черевну стінку. Парентеральне введення слід розглядати лише як другий вибір, коли ентеральне втручання не вдалося.
У цьому звіті ми розглянули аномальний клінічний випадок діенцефальної кахексії внаслідок гіпоталамічної анапластичної астроцитоми. Виграшна стратегія лікування дітей з ДС повинна враховувати харчову підтримку хіміотерапією від стандартних до високих доз, залежно від ступеня пухлини. Ми вважаємо, що швидке діагностування та гістологічна ревізія після діагностики пухлин гіпоталамуса є обов’язковими для точного лікування захворювання з поганим прогнозом.
Згода
Письмова інформована згода була отримана від законних опікунів пацієнта на публікацію цього звіту про справу та будь-яких супровідних зображень. Копія письмової згоди доступна для ознайомлення з редактором цього журналу.
Подяки
Цю роботу підтримали: Associazione Italiana per la Ricerca sul Cancro (AIRC), грант IG-12799; “Amicodivalerio” Onlus; “Noi per Voi” Onlus, Fondazione Tommasino Bacciotti.
- Немовля з гіпералертністю, гіперкінезами та відмовою у розвитку рідкісного діенцефального синдрому через
- Рідкісний випадок потрапляння стороннього тіла ШКТ; Скляний живіт
- Переваги дитячої суміші Нутрілон - станція рідного міста
- Рідкісна причина дисфагії, здавлення стравоходу переднім шийним остеофітом через
- Ягоди, що лопаються з користю - особливо при метаболічному синдромі