Недоїдання, новий індуктор для кальцифікації артерій у хворих на гемодіалізі?
Анотація
Передумови
Артеріальна кальцифікація є важливим фактором серцево-судинного ризику у хворих на гемодіалізі. У процесі кальцифікації артерій бере участь ряд факторів; однак взаємозв'язок між недоїданням та кальцифікацією артерій досі незрозумілий.
Методи
У це дослідження було включено 68 хворих на гемодіаліз. Статус харчування оцінювали за допомогою модифікованої кількісної суб'єктивної глобальної оцінки (MQSGA). Вимірювали відповідні біохімічні параметри сироватки. А зразки променевої артерії були зібрані під час операцій на артеріовенозних фістулах. Гематоксилін/еозинові плями використовували для спостереження за артеріальними структурами, тоді як червоне пляма алізарину для спостереження кальцинованих відкладень та класифікації ступеня звапнення. Експресії кісткового морфогенетичного білка 2 (BMP2) та матричного білка Gla (MGP) були виявлені за допомогою імуногістохімії та вестерн-блот-методів.
Результати
66,18% пацієнтів на гемодіалізі страждали від недоїдання. У хворих на гемодіаліз кальциновані відкладення головним чином розташовувались у медіальному шарі променевих артерій, а вираження BMP2 та MGP були збільшені в кальцифікованих зонах. Рівні сироваткового альбуміну негативно асоціювались з показником кальцифікації та експресією BMP2 та MGP. У той час як показник MQSGA, сироватковий фосфор та кальцій × фосфорний продукт показав позитивні зв’язки з показником кальцифікації та вираженнями BMP2 та MGP.
Висновки
Гіпотрофія переважає у хворих на гемодіаліз і пов’язана з кальцифікацією артерій та вираженнями BMP2 та MGP у кальцифікованих променевих артеріях. Гіпотрофія може бути новим кандидатом на індуктор для кальцифікації артерій у хворих на гемодіалізі.
Передумови
Артеріальна кальцифікація є основним фактором ризику серцево-судинної смертності, особливо для хворих на гемодіалізі [1]. Це підвищує жорсткість артерій, швидкість пульсових хвиль, зменшує артеріальну комплаєнс і в кінцевому підсумку призводить до серйозних серцево-судинних подій [2, 3].
Традиційно кальцифікація артерій вважається пасивним процесом; однак нещодавні дослідження показали, що кальцифікація артерій є активно регульованим процесом, і в цей процес бере участь ряд факторів [4]. Кістковий морфогенетичний білок 2 (BMP2) і матричний білок Gla (MGP) - це два тісно пов’язані критично важливі білки, які регулюють кальцифікацію артерій [5]. І встановлено, що BMP2 є промотором артеріальної кальцифікації, тоді як MGP вважається інгібітором артеріальної кальцифікації [6, 7]. Однак досі незрозуміло, який ключовий фактор пов'язаний з поширеністю артеріальної кальцифікації та експресією BMP2 та MGP при кінцевій стадії ниркової хвороби (ESRD).
Гіпотрофія також є ключовим фактором, пов’язаним із збільшенням захворюваності та смертності хворих на гемодіалізі [8]. Однак чи бере участь гіпотрофія в процесі кальцифікації артерій та чи пов’язує це з виразами BMP2 та MGP, недостатньо зрозуміло. У цьому дослідженні ми оцінили стан харчування хворих на гемодіалізі та дослідили роль гіпотрофії у процесі кальцифікації артерій.
Матеріали і методи
Пацієнти
Збір даних про демографічні характеристики та оцінка стану поживності
Демографічні характеристичні дані збирали таким чином: стать, вік, зріст, вага, первинні захворювання, ускладнення та тривалість гемодіалізу.
Модифікована кількісна суб’єктивна глобальна оцінка (MQSGA), хороший метод оцінки стану поживності, була спеціально використана для пацієнтів із ШОЕ. У цьому дослідженні ми використовували MQSGA для оцінки стану харчування хворих на гемодіаліз. MQSGA складається із семи компонентів: зміни ваги, шлунково-кишкові симптоми, вживання їжі, функціональна здатність, супутня захворюваність, підшкірний жир та ознаки втрати м’язів. Кожен компонент має оцінку від 1 (нормальний) до 5 (дуже важкий). «Оцінка недоїдання» - це цифра від 7 (норма) до 35 (тяжке недоїдання) [9]. На основі оцінки MQSGA було класифіковано дві групи: група нормального харчування (оцінка 7–10) та група недоїдання (оцінка 11–35).
Збір біохімічних даних
Перед операцією зразки крові збирали у пробірки, що містять етилендіамінтетраоцтову кислоту (ЕДТА), а потім зберігали при -20 ° С перед аналізом. Кальцій у сироватці крові, фосфор у сироватці крові, альбумін, тригліцериди, загальний холестерин (TG), холестерин ліпопротеїдів низької щільності (LDL-c) та холестерин ліпопротеїдів високої щільності (HDL-c) вимірювали за допомогою автоаналізатора TBA-120 (Toshiba Medical Systems, Японія).
Рівні інтактного паратиреоїдного гормону (ПТГ) у сироватці крові оцінювали методом хемілюмінесценції (Immulyte 2000; DPC, Лос-Анджелес, Каліфорнія). Кальцій × фосфор (Ca × P) розраховували на основі кальцію та фосфору в сироватці крові. Кальцій у сироватці крові 1 ммоль/л = 4 мг/дл, фосфор у сироватці крові 1 ммоль/л = 3,1 мг/дл, коригований рівень кальцію в сироватці (мг/дл): кальцикульт у сироватці крові + 0,8 × [4-sAlb (сироватковий альбумін) (г/дл )]].
Гістологічний аналіз
У хворих під час операцій на артеріовенозних фістулах вирізали окружний відрізок променевої артерії розміром 2–3 мм і негайно помістили у фізіологічний розчин. Зразки розтинали без жиру та підшкірно, фіксували на ніч у 4% параформальдегіді, а потім вносили у парафін. Зрізи тканин товщиною 4 мкм готували і фарбували гематоксиліном/еозином (ВІН, Інститут біології Бейотіме, Сучжоу, Китай). І алізарин червоний (Genmed Scientifics Inc., США).
ВІН пляма
Від 3 до 5 зрізів на зразок депарафінізували та гідратували у воду. Ядра фарбують гематоксиліном протягом 10 хвилин. Потім промити в проточній водопровідній воді протягом 10 хвилин. Після зневоднення 5 секунд у 95% спирті зрізи фарбували еозином від 30 секунд до 2 хвилин залежно від віку еозину та бажаної глибини зустрічного плями. Зневоднюють у 95% спиртах 2 хвилини і повторюють один раз, щоб видалити надлишок еозину. Під мікроскопом ми могли бачити, як ядра забарвлювались у синій колір, а цитоплазма - у рожевий.
Алізаринова червона пляма
Червоне пляма алізарину - це PH-залежний метод диференціації оксалату кальцію від карбонату кальцію та фосфату. Від 3 до 5 зрізів на зразок депарафінізували та гідратували до дистильованої води. Забруднюйте предметне скло розчином червоного алізарину близько 2 хвилин. Струсіть надлишки барвників і протріть зрізи. Зневоднюють у ацетоні, а потім у розчині ацетон-ксилолу (1: 1). Очистіть у ксилолі та встановіть у синтетичному монтажному середовищі. Під мікроскопом ми бачили, як відкладення кальцію (крім оксалату) були пофарбовані в оранжево-червоний колір.
Гістологічна оцінка кальцифікації
Гістологічний показник кальцифікації був отриманий шляхом усереднення всіх балів з усіх зрізів червоного плями алізарину та оцінки від 0 до 4 [10]. Оцінка 2,5-4 = сильний кальцинат. Згідно з оцінкою червоних плям Алізарину, ми класифікували пацієнтів на три групи: група не кальцинована (NC), група слабо кальцифікована (SLC) та група важких кальцифікованих (SEC).
Імуногістохімічне пляма
Від 3 до 5 незабарвлених предметних стекол кожного зрізу тканини депарафінізували в ксилолі та регідратували у спадному ахолі. Потім предметні стекла поміщали в 3% перекис водню для інгібування ендогенної пероксидази. Після промивання сольовим розчином Tris зрізи блокували 3% бичачим сироватковим альбуміном (Sigma-Aldrich Tradign Co, Ltd) протягом 15 хвилин, а потім інкубували з первинним антитілом у відповідних розведеннях протягом ночі. Використаними антитілами були: BMP2 (1: 100, Abcam) і MGP (1: 100, Santa Cruz Biotechnology). Фарбування без первинного антитіла, розрізаного як негативний контроль. Другу кон'юговану з пероксидом антитіла козу-анти-мишу (Вейцзя, Гуанчжоу, Китай) при розведенні 1: 400 застосовували протягом 45 хвилин, розробляли разом з DAB (Вейцзя, Гуанчжоу, Китай), а зрізи фарбували Гаррісом Гематоксиліном (Вейцзя, Гуанчжоу, Китай).
Імуногістохімічний аналіз
Вирази BMP2 та MGP були напівкількісно проаналізовані за допомогою систем цифрового аналізу Image Pro плюс 6.0 (Media Cybernetics, США). Під світловим мікроскопом середнє значення оптичної щільності (MODV) клітин обчислювали випадково в 5 полях зору. MODV представляв щільність позитивних білків. Середнє значення виміряної величини було використано як остаточне значення для розрахунку.
Вестерн-блот-аналіз
Тканини променевої артерії гомогенізували в 250 мкм буфера для гомогенізації за допомогою електронної мішалки. Концентрацію білка визначали за допомогою набору BCA (Biocolors, Шанхай, Китай).
Потім однакові кількості (30 мкг) загального білка відокремлювали електрофорезом на гелях з поліакриламід-SDS і переносили на мембрану полівінілідендифториду (мембрани іммоболон-Р; Millipore, Bedford, MA), використовуючи мокрий метод. Мембрани промивали і блокували 5% знежиреним сухим молоком у буфері TBS/T протягом 1 години при кімнатній температурі. Потім мембрани інкубували протягом ночі при 4 ° C з первинними антитілами: мишачий анти-BMP2 (1: 1000) та мишачий анти-MGP (1: 1000) та мишачий анти-β-актин (1: 1000, Вейцзя, Гуанчжоу, Китай). Після промивання мембрани інкубували з кон'югованим пероксидазою кози вторинним антитілом (1: 5000, Вейцзя, Гуанчжоу, Китай), а потім візуалізували за допомогою набору ECL (Thermo Scientific, США) згідно з інструкціями. Конкретні діапазони були визначені кількісно за допомогою програмного забезпечення Quantity One (Bio-Rad, США).
Статистичний аналіз
Дані виражаються як середнє значення ± стандартна помилка (SEM). Оскільки не кожна змінна нормально розподілялася, кореляція коефіцієнта Пірсона та кореляція Спірмена були використані для оцінки взаємозв'язку між показником кальцифікації, виразами BMP2 та MGP, оцінкою MQSGA та кількома факторами ризику, пов'язаними з кальцифікацією. Для оцінки факторів, що впливали на кальцифікацію артерій, використовувались множинні лінійно-регресійні аналізи. Тест ANOVA та тест Крускала-Уолліса використовувались для порівняння біохімічних характеристик та оцінки MQSGA серед різних звапнених груп. Значення Р
Результати
Демографічні та біохімічні характеристики у хворих на гемодіалізі
Всього в це дослідження було включено 68 пацієнтів (35 чоловіків та 33 жінок), які проходили гемодіаліз. Середній вік пацієнтів становив 62 ± 2,15 року. Майже у кожного пацієнта (92,31%) в анамнезі була гіпертонія, тоді як близько третини (30,77%) пацієнтів страждали на діабет. Середня тривалість гемодіалізу становила 5,6 місяців. Ми згрупували пацієнтів залежно від оцінки MQSGA. 45 пацієнтів (66,18%) мали недоїдання. Демографічні та біохімічні характеристики двох груп були представлені в таблиці 1. У порівнянні з групою нормального харчування група недоїдання показала значно нижчу масу тіла (56,79 ± 1,56 кг проти. 61,93 ± 1,76 кг, р = 0,046) та індекс маси тіла (ІМТ) (21,18 ± 0,46 г/м 2 проти. 23,00 ± 0,54 г/м 2, p = 0,018) та значно вищий показник MQSGA (25,28 ± 1,13 проти. 8,26 ± 1,73, p Таблиця 1 Демографічні та біохімічні характеристики у хворих на гемодіалізі
Медіальна кальцифікація, розташована в променевих артеріях хворих на гемодіалізі
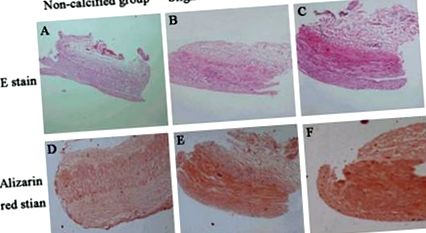
Для спостереження за структурами та кальцинованими відкладеннями в променевих артеріях хворих на гемодіалізі проводили червоні плями від ВІН та алізарину, а репрезентативні дані були показані на малюнку 1A-F. Результати алізаринового червоного фарбування показали, що 46,15% (31/68) променевих артерій мали різну ступінь кальцинованих відкладень, і кальциновані відкладення знаходились в основному в медіальному шарі (рис. 1D-F). Ми згрупували пацієнтів на гемодіалізі на основі червоного плями алізарину та розрахували бали кальцифікації залежно від ступеня кальцифікованості променевих артерій. Середній показник кальцифікації становив 0,34 для NC-групи, 1,84 для SLC-групи та 3,44 для SEC-групи. Крім того, пляма від ВІН (малюнок 1A-C) також показала, що медіальний шар кальцифікованих променевих артерій збільшений.
Гематоксилін/еозин (ВІН, A-C) та алізариновий червоний (D-F) плями променевих артерій хворих на гемодіаліз, що не харчуються. Пляма від ВІН (A-C.) показали, що товщина медіального шару збільшувалася разом із ступенем кальцинованого. І червона пляма Алізарина (D-F) продемонстрували, що кальциновані відкладення в основному розташовувалися в медіальному шарі променевих артерій. Скоротити: NC, не кальцинований; SLC, незначно кальцинована; SEC, важко кальцинована.
Біохімічні характеристики
У таблиці 2 наведено відповідні біохімічні характеристики сироватки крові та показники MQSGA у хворих на гемодіалізі. У порівнянні з групою NC, групи SLC та SEC мали значно підвищений рівень фосфору в сироватці крові, Ca × P та значно знижений рівень сироваткового альбуміну. І супроводжуючись кальцинованим ступенем променевих артерій, показник MQSGA значно збільшився. Потім ми проаналізували взаємозв'язок між кальцинованим ступенем та рівнем фосфору в сироватці крові, Ca × P та сироваткового альбуміну. Результати показали, що ступінь звапнення значною мірою позитивно корелювала з рівнем фосфору в сироватці крові (r = 0,726, p Рисунок 2
(A-D) Взаємозв'язок між показником кальцифікації та рівнем фосфору в сироватці крові, продукту кальцію × фосфору, сироваткового альбуміну та шкалою модифікованої кількісної суб'єктивної глобальної оцінки. Рівні фосфору в сироватці крові, кальцію × фосфорного продукту та показник MQSGA мали позитивний зв’язок із показником кальцифікації (малюнок 2A, B, D), тоді як рівні сироваткового альбуміну мали негативну кореляцію (малюнок 2C).
Підвищена експресія BMP2 та MGP у кальцифікованих променевих артеріях
BMP2 і MGP - два критично важливі білки, що регулюють процес кальцифікації артерій. Імунозабарвлення обох білків було майже виключно в шарі середовища та помітно в кальцифікованих областях (Фігура 3A-F). MODV, який представляв щільність позитивних білків, показав, що як експресія BMP2, так і MGP поступово суттєво зростала у відповідь на ступінь звапнення (рис. 3G). Результати вестерн-блот також продемонстрували, що експресія BMP2 та MGP суттєво зростала зі ступенем кальцифіку (Рисунок 4). А співвідношення MGP/BMP2 у NC, SLC та SEC групі становило 1,27, 1,2 та 0,78 відповідно.
(A-G) Результати імунозабарвлення морфогенетичного білка-2 кістки (BMP2) та білка матриксу Gla (MGP). Як легка кальцинована (SLC) група, так і тяжка кальцинована (SEC) група мали значно вищі експресії BMP2 та MGP в променевих артеріях хворих на гемодіалізі, ніж не кальцинована (NC) група (Рисунок 3A-G). І порівняно з групою SLC, група SEC також продемонструвала значно підвищену експресію BMP2 та MGP (Рисунок 3B-C, E-G).
Вестерн-блот результати морфогенетичного білка-2 кістки (BMP2) та матричного білка Gla (MGP). Порівняно з групою, що не кальцифікована (NC), група як з легким кальцинозом (SLC), так і група з важким кальцифіком (SEC) суттєво збільшила експресію BMP2 та MGP у променевих артеріях хворих на гемодіалізі. І група SEC також мала значно вищі вираження BMP2 та MGP, ніж група SLC.
Взаємозв'язок між BMP2/MGP та фосфором у сироватці крові, продуктом кальцій × фосфор, сироватковим альбуміном та показником MQSGA
Ми дослідили взаємозв'язок між виразами BMP2 та MGP та факторами кальцифікації. Таблиця 3 показала, що рівні сироваткового фосфору та кальцію × фосфорного продукту позитивно корелювали з експресією BMP2 та MGP у променевих артеріях хворих на гемодіалізі. На відміну від цього, рівні сироваткового альбуміну суттєво негативно корелювали з експресією BMP2 та MGP. Більше того, було показано, що вирази BMP2 та MGP мали позитивні зв'язки з оцінкою MQSGA (Таблиця 3).
Обговорення
Це дослідження продемонструвало, що у хворих на гемодіалізі переважає недоїдання. А у пацієнтів з недостатнім харчуванням частота кальцифікації променевих артерій висока. Крім того, експресія BMP2 та MGP була збільшена в кальцифікованих променевих артеріях. Вперше, наскільки нам відомо, у хворих на гемодіалізі ми продемонстрували, що недоїдання (високий бал MQSGA та низький рівень сироваткового альбуміну) тісно пов’язане з кальцифікацією артерій та експресією BMP2 та MGP. Крім того, певні фактори ризику, такі як фосфор у сироватці крові та продукт Ca × P, корелювали зі ступенем кальцинованості, аналогічно попереднім дослідженням [11].
BMP2 і MGP - це два тісно пов’язані білки в процесі кальцифікації артерій. BMP2 належить до сімейства факторів росту TGF-β (трансформуючий фактор росту β) і продемонстрував, що він відіграє ключову роль у процесі кальцифікації артерій [19, 20]. MGP, вітамін K-залежний білок, зв’язується з BMP2 та діє як ендогенний інгібітор кальцифікації [21]. Оскільки BMP2 і MGP беруть участь у процесі кальцифікації артерій, ми спостерігали експресію BMP2 та MGP у кальцифікованих променевих артеріях хворих на гемодіалізі. Ми виявили, що експресія BMP2 та MGP одночасно зростала в кальцифікованих променевих артеріях. Тим часом оцінка MQSGA позитивно корелювала з виразами BMP2. А рівні сироваткового альбуміну показали негативну кореляцію з експресією BMP2. Це дає непрямі докази того, що недоїдання пов’язане з кальцифікацією артерій.
Цікаво, що ми також виявили, що підвищена експресія MGP не виявляє інгібованого BMP2 ефекту для артеріального звапнення. Це може пояснюватися співвідношенням MGP/BMP2 або формами MGP. Зеббудж та ін. продемонстрували, що MGP залежно від дози регулює активність BMP2 та підвищує кальцифікацію [5, 22]. У цьому дослідженні співвідношення MGP/BMP2 зменшувалось із ступенем кальцифікованості, що вказує на те, що чим нижчий коефіцієнт MGP/BMP2, тим важче розвивається артеріальна кальцифікація. Більше того, MGP існує у карбоксильованих та некарбоксильованих формах, і це може по-різному впливати на процес кальцифікації. У нашому дослідженні ми виявили, що експресія MGP була підвищена в кальцифікованих променевих артеріях людини в умовах гемодіалізу. Два можливих пояснення полягають у тому, що підвищений MGP може бути некарбоксильованою формою, яка не виявляла ефекту для пригнічення артеріального звапніння або лише відповіді на кальцифікований процес, але не першопричиною кальцифікації артерій. Однак, оскільки недостатньо оцінено некарбоксильований MGP, необхідні додаткові дослідження на людях і тваринах для вивчення ролі MGP в артеріальному кальцифікації.
Висновки
Гіпотрофія є можливим механізмом кальцифікації артерій у хворих на гемодіалізі. Ефективне лікування гіпотрофії буде перспективною стратегією зменшення кальцифікації артерій та зменшення захворюваності та смертності від серцево-судинних подій у хворих на гемодіалізі.
- Гіпотрофія, кахексія та якість життя у хворих на рак SpringerLink
- ISRCTN - ISRCTN96125404 Додавання кавуна в раціон хворих на гіперемезіс гравідарум допоможе
- Як перетворити звичайний круасан у досконалість; Марін Незалежний журнал
- Фактори ризику для здоров’я під час недоїдання
- МІСЦЕВІ ХАРЧУВАННЯ, УРБАНІЗАЦІЯ ТА ТРАНСПОРТ, ВИРОБНИЦТВА ПАРНИКІВ - КАРА - 2017