Нанобіосенсори на основі FRET для візуалізації внутрішньоклітинних мікродоменів Ca 2+ та H +
Алсу І. Замалєєва
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Париж F-75005, Франція; Електронні листи: [email protected] (A.I.Z.); [email protected] (C.L.)
Гійом Деспра
2 Департамент Чімі, Дослідницький університет École Normale Supérieure-PSL, CNRS UMR 7203 LBM, 24, rue Lhomond, і Університет Сорбони, UPMC Univ Paris 06 LBM, 4 місце Жус'є, Париж F-75005, Франція; Електронні листи: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Камілла Луккардіні
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Париж F-75005, Франція; Електронні листи: [email protected] (A.I.Z.); [email protected] (C.L.)
Майоль Колло
2 Департамент Чімі, Дослідницький університет École Normale Supérieure-PSL, CNRS UMR 7203 LBM, 24, rue Lhomond, і Університет Сорбони, UPMC Univ Paris 06 LBM, 4 місце Жус'є, Париж F-75005, Франція; Електронні листи: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Мішель де Ваард
3 Inserm U836, Інститут нейронауки Гренобля, Дослідницька група 3, LabEx Ion Channel Science and Therapeutics, Університет Джозефа Фур'є, BP170, Гренобль Седекс 09 38042, Франція; Електронна пошта: [email protected]
Мартін Охайм
4 Фізіологічна лабораторія мозку, CNRS UMR 8118, Faculté des Sciences Fondamentales et Biomédicales, Fédération de Neurosciences FR3636, Паризький університет Декарта, PRES Sorbonne Paris Cité, Париж F-75006, Франція; Електронна пошта: [email protected]
Жан-Моріс Маллет
2 Департамент Чімі, Дослідницький університет École Normale Supérieure-PSL, CNRS UMR 7203 LBM, 24, rue Lhomond, і Університет Сорбони, UPMC Univ Paris 06 LBM, 4 місце Жус'є, Париж F-75005, Франція; Електронні листи: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Енн Фельц
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Париж F-75005, Франція; Електронні листи: [email protected] (A.I.Z.); [email protected] (C.L.)
Пов’язані дані
Анотація
1. Вступ
Для кращого задоволення умов виявлення іонних мікродоменів ми пропонуємо тут використовувати флуоресцентну та багатофункціоналізовану наночастинку, що несе кілька молекул іонних сенсорів, а також пептиди, що проникають у клітини (CPP), щоб полегшити її цитоплазматичну доставку. Ми використовували комерційну квантову точку (QD), тобто неорганічну колоїдну флуоресцентну частинку, як центральну ліску для нашого біосенсора. Широкий спектр поглинання, чітко визначений симетричний спектр випромінювання та велика яскравість та висока стійкість до вибілювання у порівнянні з маломолекулярними органічними флуорофорами роблять КТ хорошими донорами енергії для флуоресцентного резонансного переносу енергії (FRET) та полегшують виявлення одиничних КТ всередині живих клітини. Кілька молекул органічних іонів-індикаторів, пов'язаних з поверхнею КТ, діють як акцептори флуоресцентної енергії. Ефективність FRET цієї збірки визначається перекриттям спектра випромінювання КТ зі спектром поглинання флуоресцентного іонного індикатора, а також їх кількістю, орієнтацією та близькістю до поверхні КТ.
Тут ми повідомляємо про синтез, характеристику та перевірку пари FRET на основі QD/Ca (H) Ruby та демонструємо, що зв’язаний Ca (H) Ruby титрується проти Ca 2+/протонів як вільний барвник у розчині. Нарешті, ми перевіряємо як in vitro, так і in situ, клітину на основі FRET, що проникає в нанобіосенсор Ca 2+, а також нанобіосенсор H +, поглинений ендоцитотичним шляхом.
1.1. Матеріал та методи
Хімія сполук CaRuby1 та HRubies буде представлена відповідно в [17] та [19]. Хімія CaRuby2 описана в Додатковій інформації та задокументована зі схемою S1 для синтетичної стратегії та малюнками S1 – S46 для характеристики проміжних сполук синтезу та кінцевих сполук.
Більшість протоколів, що використовуються тут (для хімії поверхні КТ, умови підтримання стабільної експресії клітинної лінії BHK, що експресує NR2A-NMDAR, та їх використання для мікроскопії TIRF) були раніше описані в Довідковій інформації Замалеева та ін., 2014 [8] до яка стосуватиметься синтезу покритих пептидом КТ, функціоналізації КТ та їх очищення, культури клітин клітинної лінії BHK, що експресує NR2-NMDAR, та візуалізації одиничних частинок за допомогою мікроскопії TIRF. Тут ми в основному описуємо протоколи, що стосуються вивчення наносенсорів рН на основі HRu-PiAC.
1.2. Барвники ПЕГІЛУВАННЯ
ПЕГилирование CaRubies з використанням бічного ланцюга для хімічної хімії було детально описано [8]. Та сама процедура ПЕГилирования дотримувалась і для HRu-PiAC.
1.3. Флуориметрія
Методи, використовувані для CaRubies2, були опубліковані раніше [18]. Коротко, динамічний діапазон CaRuby для зондування Ca 2+ оцінювали на основі піку PL CaRuby, виміряного в розчині, що містить (в мМ) 100 KCl, 30 MOPS, де [Ca 2+] регулювали за допомогою набору Invitrogen Ca Buffer (Life Technologies, посилання: C-3008MP). Для титрування HR-PiAC ми використовували універсальний буфер рН, див. Додаток 3, с. 830 у [20], який має майже постійну іонну силу в діапазоні рН від 2 до 12. Криві флуоресценції коригуються для чутливості до рН флуоресценції КТ (детальніше див. Малюнок S3). Спектри флуоресценції FRET (500–700 нм) були отримані при світлі збудження при 407 нм, а спектри прямого випромінювання (550–700 нм) - при збудженні при 545 нм. Всі значення для пар FRET були розраховані після спектрального лінійного змішування, підлаштовуючись під спектри QD та Ca/HRuby (інструмент кріплення кривої MatLab).
Конфокальна мікроскопія: Покриті клітини інкубували з наносенсорами рН (при 100 нМ КТ в живильному середовищі DMEM без сироватки) протягом 2 год, а потім протягом 30 хв з 500 нМ Lysotracker Green. Після того, як їх двічі промивали лише забуференним фосфатом фізіологічним розчином (PBS) (Invitrogen, Cergy Pontoise, Франція), нарешті, було знову введено середовище DMEM, забуференне HEPES. Потім живі клітини негайно аналізували за допомогою конфокальної лазерної скануючої мікроскопії за допомогою операційної системи Zeiss LSM. Зонди рН (561 нм) та Lysotracker green (488 нм) одночасно збуджувались та збирали флуоресценцію випромінювання.
1.4. Внутрішньоклітинне калібрування датчиків рН за допомогою проточної цитометрії
Внутрішньоклітинне калібрування датчиків рН проводили за допомогою клітинної лінії BHK-21. Покриті 80% злиті клітини BHK інкубували з 100 нМ QD протягом 1 год у середовищі без антибіотиків або плодової телячої сироватки, а потім клітинам давали відпочити в інкубаторі (5% СО2, 37 ° С). Через 2 год клітини збирали з використанням ферменту TrypLE TM Express (Gibco, Waltham, MA, США) і ресуспендували в середовищі, не залежному від CO2 (Gibco, Великобританія).
Іонофор K +/H + нігерицин використовували для внутрішньоклітинного калібрування датчиків рН. Разом з високою концентрацією калію в буфері він вирівнює внутрішньоклітинний та позаклітинний рН. Клітини, що містять інтерналізовані датчики рН, ресуспендували в буферах, що містять 143 мМ KCl, 1,17 мМ MgCl2, 1,3 мМ CaCl2, 5 мМ глюкози та 10 мкМ нігерицину з визначеними рН-буферами від pH 4,0 до pH 8,0 з кроком 0,5. Потім 20 мМ лимонної кислоти використовували для буферного діапазону рН 4,0–6,5 і 20 мМ (4- (2-гідроксиетил) -1-піперазинетансульфонової кислоти) (HEPES) для буферів в діапазоні рН 7,0–8,0. Для виключення мертвих клітин додавали DAPI (4 ′, 6-діамідино-2-феніліндол; 0,05 мкМ). Після інкубації протягом 5 хв при кімнатній температурі зразки аналізували проточним цитометром (BD LSR Fortessa, BD Biosciences). Для придбання використовували лазери довжиною хвилі 532 нм або 405 нм для прямого або FRET-збудження H-Ruby відповідно, а його емісійну флуоресценцію збирали в спектральному каналі детектування 610 ± 20 нм. Кожного разу було придбано 10 000 подій. Для аналізу було використано програмне забезпечення FlowJo vX.0.7. Спочатку проводили зазор на клітини шляхом прямого/бічного розсіювання, потім відбирали популяцію живих клітин і визначали середню інтенсивність флуоресценції H-Ruby для кожного зразка.
2. Результати
2.1. Від принципу до модульного набору інструментів: побудова іонних датчиків на основі FRET
2.1.1. Принцип
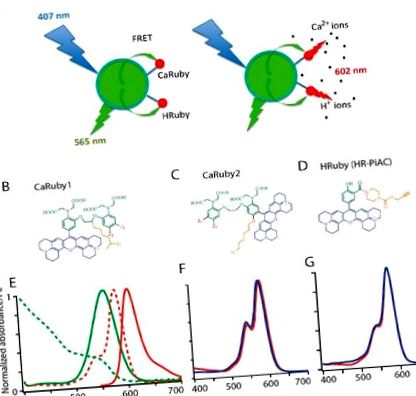
Ми побудували нанобіосенсори на основі FRET з центрального донора QD (D) та 1-10 молекул барвника, чутливого до іонів (A) (рис. Для останнього ми використовували представників нашої родини датчиків Ca 2+ та H + Ruby, що мають спектри поглинання та випромінювання, що відповідають спектру поглинаючого зелене світло комерційного донора QD, CANdot ® 565, що призводить до розрахункового радіуса Ферстера приблизно 4,5 нм (припускаючи диполь-дипольне зв’язування та ізотропну орієнтацію), тим самим вказуючи на ефективний FRET. Флуоресцентний акцептор поєднує в собі розширений родаміновий флуорофор, іонспецифічну хелатну групу та лінкерний рукав, що дозволяє кон'югувати його з поверхнею КТ (рис. 1 B – D).
У зондах Calcium Ruby, хоча квантовий вихід флуоресценції ΦF зростає при зв’язуванні Ca 2+, його абсорбція залишається незмінною, так що FRET між донором і акцептором не залежить від зв’язування аналіту і просто передає збудження, що призводить до очевидного великого стоксового зсуву 40 нм при збудженні в блакиті (при 405–407 нм). Однак ΦF переходить із загартованого стану при низькій концентрації аналіту до яскравого темно-червоного сенсибілізованого випромінювання при більш високій концентрації аналіту. Ефективність FRET зростає із збільшенням співвідношення A: D, як і очікувалося для багатоакцепторного FRET, який пропонує безліч непроменевих шляхів знезбудження та акцепторні орієнтації для донора QD. Як результат, при низьких концентраціях акцепторів нанобіосенсор може знаходитись при синьому збудженні та виявленні випромінювання КТ зеленого/жовтого кольору, а концентрація аналіту контролюється вище 600 нм або за допомогою FRET, або шляхом безпосереднього збудження рубінів поблизу 560 нм. Для мультиакцепторної системи (з A/D> 5) наночастинка є просто носієм для підвищення концентрації іонного датчика, а донорна флуоресценція настільки загальмована, що навіть при спокійній низькій концентрації іонів ансамбль може розташовуватися лише за випромінювання червоного кольору.
2.1.2. Дизайн іонних датчиків
Нещодавно ми представили сімейство функціоналізованих індикаторів червоного випромінювання на основі розширеного (X-) родаміну, що включає або сенсорний фрагмент на основі BAPTA (Європейський патент, ЄР 13 194 728.5), або фрагмент на основі фенолу для зондування Н + (ЄР 13 199 575,5). У цих сполуках (рис. 1 B – D) іон, що зв’язується з азотом BAPTA (для зондів Ca 2+, [21]) або з фенолятом (для зонда pH), блокує перенос фотоелектронів (PET), відповідальний за флуоресценцію гартування при низькій концентрації іонів. Отже, іонне зв’язування призводить до непогашеного флуорофору при високій концентрації аналіту. Щоб забезпечити флуориметрію при однохвильовому збудженні, а також двофотонну візуалізацію, ми зберегли сполуки, що не мають зсуву поглинання, коли концентрація іонів змінюється (рис. 1 F, G). На цьому етапі ми можемо очікувати однакової калібрувальної кривої для вільного датчика та для функціоналізованого КТ, якщо нетривіальні явища не спричиняють більш складних ефектів.
2.1.3. Датчики Ca 2+
Усі кальцієві рубіни (CaRuby) несуть (помаранчевий, на малюнку 1 B, C) роздільник азидо для хімічної хімії та результуючого потенціалу для реакцій зчеплення з високим виходом [22]. Це бічне плече ефективно дозволяє проводити реакції кон'югації без використання карбонових груп фрагменту BAPTA [23], і тому кон'югація не вносить значних збурень афінності зв'язування Ca 2+ [8].
Перше покоління CaRubies (відтепер іменованого CaRuby1) було сконструйовано з боковим плечем, прикріпленим до містка етиленгліколю між двома ароматичними кільцями BAPTA [15,16,17]. Ці CaRubies мали константи дисоціації від 3,4 до 21,6 мкМ, залежно від галогенідних замін на ароматичних кільцях (Z1, Z2 на малюнку 1 B, C). Для подальшого збільшення спорідненості CaRuby до Ca 2+, ми ввели атом кисню на одному з ароматичних кілець BAPTA за допомогою реакції SNAr, яка також служить ланкою для бічного плеча азидо у другому поколінні нових варіантів CaRuby, CaRuby2 ([18] та малюнок 1 С). Крім того, в останньому випадку флуорофор поміщали в метаположення, щоб зменшити його вплив на хелатний азот. Ці модифікації призвели до варіантів з субмікромолярними спорідненостями до зв'язування Ca 2+ і коливаються від 0,26 мкМ для CaRuby-Nano [18], яка тепер називається CaRuby2-H (див. Малюнок 1 B, C), 0,325 мкМ для CaRuby2-F та 1,71 µM для CaRuby2-Cl, що призводить до загального діапазону від 0,26 до 22 µM, покритого між усіма CaRubies.
Спектри поглинання та випромінювання CaRuby2-F ідентичні спектрам поглинання Caruby1-CH3, показаним на малюнку 1 E, де червоною пунктирною лінією показаний спектр випромінювання QD. Динамічний діапазон і QY ще не опублікованого CaRubies2 наведено нижче в таблиці 1 (див. [17,18]) для CaRubies1 та CaRuby2-H відповідно). Що важливо для фізіологічних застосувань, ці датчики не виявляли чутливості до Mg 2+ і були погано залежними від рН (рисунок S1C-E; див. Також [17,21] для CaRubies1 та [16,18] для CaRuby2-H). З іншого боку, ці сполуки гасяться іонами Cu 2+, отже, їх можна застосовувати для гасіння позаклітинних молекул барвника або проведення калібрувальних експериментів.
Таблиця 1
Біофізичні характеристики CaRu2-Cl та CaRu2-F.
- Центр візуалізації ГІ Об’єднані гастроентерологи УЗД КТ
- Підвищений ІМТ пов’язаний із зменшенням кровотоку в префронтальній корі з використанням візуалізації SPECT
- Ікра
- Калорії в цибульній сировині - Інформація про калорії, жири, вуглеводи, клітковину та протеїни SparkPeople
- Калорії Кайманового Джека