Енергія
Зміст, який далі, є суттю лекції загальної хімії 21. У цій лекції ми висвітлюємо визначення енергії та процесу калориметрії.
Енергія
На жаль, щоб обговорити наступні теми, існує безліч визначень, які потрібно обговорити спочатку, так що будьте готові зі мною.
Перш за все нам потрібно визначити цей розділ вивчення хімії. Термодинаміка або більш конкретно Термохімія - це дослідження поглинання або виділення тепла, що супроводжує хімічні реакції.
Енергія визначається як здатність виконувати роботу, і в хімії ми визначаємо Енергія як сума як виконаної роботи (w), так і тепла (q), що генерується або втрачається.
E = w + q
Енергія також поділяється на два загальних типи:
(1) Кінетична енергія (EK) або енергія руху: 1/2 mv 2, де m - маса, v - швидкість
(2) Потенційна енергія (ЕП): енергія, що зберігається в хімічних зв'язках, що виділяється при розриві або утворенні зв'язку.
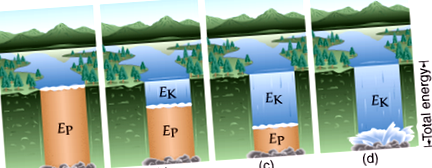
На малюнку нижче, коли вода починає текти, енергія змінюється від потенційної до кінетичної:
У будь-якому випадку вимірювана енергія, як правило, виражається в одній з двох одиниць: калорії (кал) або джоулі (J) Джоуль визначається як 1 кг. м 2/с 2. Калорія - це кількість тепла, необхідна для підняття 1 моля води на 1 градус Цельсія та 4.184 Дж = 1 кал.
Закон збереження енергії
Подібно до того, як Закон збереження маси створює основу для стехіометричних розрахунків, Закон збереження енергії встановлює основу для термодинамічних розрахунків.
Закон зазначає, що Енергію не можна ні створювати, ні руйнувати, і тому вона відома як Перший закон термодинаміки. Це означає, що загальна Енергія Всесвіту є постійною, і можна виміряти лише зміни в типі енергії.
У хімії це часто означає, що потенційна енергія, яка міститься в хімічних зв'язках, перетворюється на теплову енергію, яка в свою чергу перетворюється на кінетичну енергію, коли молекула реагує на підвищення температури тощо. Або, як показано нижче, утворення зв'язку перетворює хімічну енергію в теплової та світлової енергії. Важливою особливістю процесу є те, що кількість енергії залишається постійною.
Ось ще кілька визначень для вас:
1) Температура - у термодинаміці це визначається як міра кінетичної енергії, отриманої від молекулярного руху. Вигляд, який вперше з’явився на зразок курки чи яйця, оскільки при більш високих температурах молекули мають більшу кінетичну енергію, але ось вона у вас є.
2) Теплова енергія або тепло (q) - визначається як кінетична енергія, що передається від одного об’єкта іншому в результаті різниці температур між ними. Тож ми повинні виміряти різницю температур між двома об’єктами/речовинами, щоб визначити тепло.
3) Хімічна енергія - як показано вище, це потенційна енергія, яка міститься в хімічних зв’язках.
Розрахунки енергії
На даний момент існує лише кілька типів енергетичних розрахунків, за допомогою яких ми можемо робити енергію за рахунок роботи та тепла.
Яка енергія системи, яка виконує 100 Дж роботи і поглинає 250 Дж тепла?
Для того, щоб обчислити це, вам потрібно знати умовні ознаки:
У термодинаміці (як і в житті) виконанню роботи надається негативний знак, а робота над системою - позитивна. Таким же чином втрата тепла отримує негативний знак, а поглинання тепла - позитивним. Отже, для наведеної вище проблеми це насправді просто процес інтерпретації читання, оскільки математика - це просто додавання або віднімання:
Система виконує роботу, тому 100 Дж має бути від’ємним і поглинає тепло, тому 250 Дж є позитивним:
E = -100J + 250J = 150 Дж
а інший тип розрахунку - для кінетичної енергії:
EK = 1/2 мв 2
Отже, ось простий приклад:
Якщо лайнбек може пробігти 40 метрів за 4,15 секунди і важить 195 фунтів, скільки кінетичної енергії він має?
Спочатку згадайте одиниці Джоуля: 1 кг. м 2/с 2
Нам потрібно перевести фунти в кг: 195 фунтів x 1 кг/2,2 фунта = 88,6 кг
Тоді це просто plug and chug:
EK = ВЅ (88,6 кг) (40 м/4,15 с) 2 = В 4,12 кДж
А тепер повернемось до визначень.
Система та оточення
Як ми дізналися раніше, втрачена та отримана енергія повинна бути еквівалентною для будь-якого процесу, але ми не визначили, куди будемо втрачати або отримувати цю енергію, тому зробимо це зараз.
Система - визначається як процес, реакція або досліджуваний об'єкт.
Оточенняs - це все інше.
Наприклад, у реакції водної кислоти та основи, система буде самою реакцією між молекулами кислоти та основи, а оточення - водою та контейнером, в якому вони перебувають.
Офіційно існує три типи систем:
Відкритий - може обмінюватися теплом і речовиною з оточенням
Закритий - може обмінюватися теплом, але не має значення з оточенням
Ізольовані - не можуть обмінюватися теплом або речовиною з оточенням
На цьому етапі я хочу ще раз нагадати вам про Перший закон термодинаміки: Енергія не створюється і не руйнується. Інший спосіб підтвердити це те, що чиста Зміна енергії між системою та її оточенням повинна бути нульовою. ΔE = ES-система + ES-оточення = 0. Щоб це було правдою, тоді Енергія системи повинна бути еквівалентною енергії оточення, але протилежна за знаком.
ESystem = -ESurroundings або -ESystem = ESurroundings
І як і раніше, коли система втрачає енергію, ми даємо їй негативний знак, а коли вона набирає енергію, це позитив.
Коли хімічна реакція відбувається у відкритому контейнері, більша частина енергії, що отримується або втрачається, відбувається у вигляді тепла. Практично ніякої роботи не робиться (тобто нічого не рухається). Тепло (q) визначається як передача енергії між системою та її оточенням. В Тепло протікає між системою та оточенням до тих пір, поки вони не стануть однаковою температурою. Коли відбувається хімічна реакція, в якій система поглинає тепло, процес називається таким ендотермічний (відчувається холод). Коли відбувається хімічна реакція, в якій система виробляє тепло, вона і є екзотермічний (відчувається жарко).
Визначення теплоти - калориметрія
Калориметрія - це процес, за допомогою якого вимірюється зміна температури системи.
Існує два основних типи калориметрії - постійний тиск і постійний об’єм.
Калориметр постійного тиску часто називають калориметром кавової чашки, оскільки він нагадує і часто будується з чашки кави в лабораторних експериментах.
Показаний тут qSys - це сумарне тепло для всього калориметра, який містить воду та калориметр навколишнього середовища, як ми це вже визначили раніше, і qRxn, який ми визначили як систему раніше. Подібно до того, як вище, де ми заявляли, загальна енергія повинна дорівнювати нулю, як і qSys, показаний тут. Це означає, що перестановка рівняння вище встановлює q оточення рівним за величиною, але протилежним за знаком так само, як і раніше.
Розрахунок q залежить не тільки від зміни температури, але також від її питомої теплоємності та кількості.
Питома теплоємність (с)
Питома теплоємність (с) речовини - це кількість теплоти (q), необхідна для підвищення температури одного грама речовини на один градус Цельсія.
Це рівняння для тепла просто означає, що чим більше речовини у вас є, тим більше тепла воно може поглинути або виділити, тому тепло вважається великою властивістю. А також враховується, що різні типи матеріалів по-різному поглинають/виділяють тепло. Той, хто коли-небудь готував з алюмінієвої фольги або чавунної каструлі, розуміє цю різницю. Фольги можна торкнутися з мінімальною небезпекою, оскільки вона майже відразу після зняття з вогню прохолодна, але залізний посуд залишатиметься небезпечним протягом тривалого часу. Це пов’язано з різною теплоємністю (див. Таблицю вище).
Повертаючись до калориметрії, інший тип калориметра - це калориметр з постійним обсягом або "бомба". Частина "бомби" походить від того, що оскільки об'єм постійний, тиск усередині калориметра може бути досить високим. Якщо за ними уважно не стежити, це може призвести до катастрофічних результатів.
Рівняння для розрахунку теплоти практично ідентичні рівнянням калориметра з постійним тиском. Велика різниця між ними полягає в тому, що, хоча в калориметрі для кавової чашки реакція протікає у воді як частина водного розчину, реакція в калориметрі-бомбі взагалі знаходиться в окремому відділенні.
- Молекулярно-клінічна характеристика інфекції Giardia duodenalis у дітей дошкільного віку з
- Молекулярний водень, що прикрашає шкіру MISTER Сьюзен Сміт Джонс, доктор філософії
- Формули контролю ваги Royal Canin є
- Нова техніка, розроблена для розділення складних молекулярних сумішей
- Шафран; Кролики з куркумою