Метилювання ДНК, пов’язане з ожирінням, у відбитих генах у спермі людини: результати дослідження TIEGER
Анотація
Передумови
Епігенетичне перепрограмування в гаметах ссавців скидає знаки метилювання, які регулюють моноалельну експресію імпринтованих генів. У чоловіків це включає стирання знаків метилювання матері та встановлення специфічного для батьків метилювання для належного керування нормальним розвитком. Ступінь впливу екзогенних факторів на вірність перепрограмування метилювання невідома. Раніше ми виявили взаємозв'язок між ожирінням батьків та зміненим метилюванням ДНК у пуповинній крові, припускаючи, що ендокринний, харчовий статус або спосіб життя батька можуть посилити епігенетичні відхилення від поколінь. Під час цих аналізів ми досліджуємо взаємозв'язок між надмірною вагою/ожирінням чоловіків та статусом метилювання ДНК відбитих генних регуляторних областей у гаметах.
Методи
Моделі лінійної регресії були використані для порівняння відсотків метилювання ДНК сперми, кількісно визначених за допомогою піросеквентування бісульфіту, у 12 диференційовано метильованих областях (DMR) у 23 чоловіків із надмірною вагою/ожирінням та 44 з нормальною вагою. Наше дослідження включало 69 добровольців із дослідження «Вплив навколишнього середовища на гаметичне епігенетичне перепрограмування» (TIEGER), яке базується в штаті Північна Кароліна, США.
Результати
Після коригування віку та стану пацієнтів із фертильністю, сперма чоловіків із надмірною вагою або ожирінням мала значно менший відсоток метилювання MEG3 (β = -1,99; SE = 0,84; стор = 0,02), NDN (β = -1,10; SE = 0,47; стор = 0,02), SNRPN (β = −0,65; SE = 0,27; стор = 0,02), і SGCE/PEG10 (β = -2,5; SE = 1,01; стор = 0,01) DMR. Наші дані також дозволяють припустити незначне збільшення метилювання ДНК у MEG3-IG DMR (β = +1,22; SE = 0,59; стор = 0,04) і H19 DMR (β = +1,37; SE = 0,62; стор = 0,03) у сперми чоловіків із надмірною вагою/ожирінням.
Висновки
Наші дані підтверджують, що статус надмірної ваги/ожиріння чоловіків простежується в епігеномі сперми. Потрібні подальші дослідження, щоб зрозуміти вплив таких змін та місце виникнення відмінностей метилювання ДНК між худими та чоловіками із зайвою вагою/ожирінням. Разом з нашими попередніми звітами про ожиріння батьків та епігенетичні зрушення у нащадків, наші дослідження створюють основу для майбутніх досліджень, що стосуються аберацій метилювання гаметичного самця у чоловіків через такі фактори способу життя батьків, як ожиріння.
Передумови
Сукупність досліджень, що підтверджують гіпотезу про те, що хронічні захворювання дорослих, такі як діабет ІІ типу, метаболічні розлади та ожиріння, походять з раннього віку, переросла у нову сферу розвитку здоров'я та хвороб (DOHaD) [1]. У світлі наростаючої епідемії ожиріння роль ожиріння батьків у впливі на розвиток потомства представляє особливий інтерес [2, 3]. Взаємозв'язок між материнським впливом на дієту та ожиріння та результатами потомства відзначався у багатьох дослідженнях [4–6], проте було порівняно менше досліджень щодо ролі батьків. Однак дедалі більший консенсус погоджується з тим, що не слід залишати без уваги вплив батьківських факторів, зокрема ожиріння, на здоров'я потомства [3, 7–9].
Наша попередня робота над когортою епігенетичного дослідження новонароджених (NEST) показала, що новонароджені діти з ожирінням мають модифікований епігеном у вигляді змінених профілів метилювання в деяких відбитих регіонах регуляції генів [24, 25]. Відбиті гени відрізняються від інших епігенетично регульованих генів тим, що їх епігенетичні знаки та схеми експресії залежать від батьківства походження, і ці моделі передаються з вірністю та послідовністю, що призводить до моноалельної експресії [26, 27]. Відбиткові знаки протистоять глобальному епігенетичному перепрограмуванню, яке відбувається після запліднення, до уточнення зародкового шару, фактично дозволяючи потомству успадковувати будь-які зміни цих стабільних знаків метилювання від батьків [7]. Таким чином, імпринтовані гени є ідеальними кандидатами для дослідження рано придбаних батьківських внесків у епігеноми потомства.
Для того, щоб остаточно пов’язати ожиріння батьків із модифікаціями метилювання потомства, такі зміни слід простежити до сперми батька. Дослідження сперматозоїдів дозволяє вивчити можливі зміни у встановленні епігенома чоловічої статевої клітини до будь-якого впливу та модуляції з боку материнських факторів та внутрішньоутробно навколишнє середовище. Дослідження на тваринах вже почали пов'язувати епігенетичні та фенотипові аномалії потомства з відповідними епігенетичними змінами сперми батьків. Вей та ін. встановили, що миші-самці з індукованою резистентністю до інсуліну та порушеною глюкозою натще мали потомство з підвищеною сприйнятливістю до діабету та зміненими схемами метилювання на своїх острівцях підшлункової залози, що відповідало зміненому метилюванню у спермі від їхніх батьків [20].
У людських популяціях проведено дуже мало досліджень, пов’язуючих ожиріння батьків із конкретними епігенетичними модифікаціями сперми. Метою цього дослідження було визначити, чи існує взаємозв'язок між надмірною вагою/статусом ожиріння та профілями метилювання в спермі в 12 відбитих регіонах. Наші гени, що представляють інтерес, включають експресований материнами ген 3 (MEG3), по батькові експресований ген 1/специфічна транскрипція мезодерми (PEG1/МОНТ), інсуліноподібний фактор росту 2 (IGF2), H19, фактор росту, пов'язаний з рецептором білок 10 (GRB10), нейронатин (NNAT), некдін (NDN), малий ядерний рибонуклеопротеїновий поліпептид N (SNRPN), епсилон саркоглікан (SGCE)/по батьковій експресії ген 10 (PEG10), генетично експресований ген 3 (PEG3), і геноподібний геном плейоморфної аденоми 1 (ПЛАГАЛ1). Ці відбиті гени є ефекторами росту, важливими для раннього росту ембріона та плода та/або регуляції росту пухлини.
Методи
Учасники дослідження та збір даних
Збір зразків
Волонтерів попросили здати сперму, сечу та зразки крові. Їх попросили утриматися від еякуляції щонайменше 3 дні, але не більше ніж за 10 днів до візиту. Насіння збирали на місці шляхом мастурбації без використання мастильних матеріалів у стерильний контейнер для збору поліпропілену (Cardinal Health, Дублін, Огайо). Посібник лабораторії Всесвітньої організації охорони здоров’я (ВООЗ) для обстеження та обробки сперми людини 5-е видання було посиланням на нормальні значення [28]. Сперму аналізували на стандартні клінічні показники після зрідження, не пізніше 60 хв від забору. Після завершення цих клінічних аналізів сперми зразки піддавали двоступеневому центрифугуванню із градієнтом ISolate (Irvine Scientific) для відбору рухомої популяції, збагаченої нормальною морфологією. Цей колоїдний градієнт діоксиду кремнію, що складається з 90% нижнього шару та 50% верхнього шару, готується шляхом послідовного додавання 1,5 мл кожного в 15 мл полістирольної конічної трубки. Зразок сперми піпетували поверх верхнього шару і центрифугували при 200 ×g протягом 15 хв. Градієнтний розчин видаляли і гранульовану сперму заморожували та зберігали при -80 ° C для подальшого аналізу метилювання ДНК.
Аналіз метилювання ДНК
Були досліджені диференційно метильовані ділянки (DMR), пов'язані з наступними генами: Два DMR, проаналізовані на DLK1/MEG3 імпринт-домен складався з домену MEG3-IG DMR (4 сайти CpG) та MEG3 DMR (8 сайтів CpG) (chr 14q32.2). Регіон вище за течією IGF2 відбиті генні промотори включали три CpG-динуклеотиди (chr 11p15.5). DMR для H19 включав чотири сайти CpG (chr 11p15.5). Також були протестовані наступні DMR генних промоторів: GRB10 (6 сайтів CpG) (chr 7p12.2), NDN (6 сайтів CpG) (chr 15q11.2), NNAT (3 сайти CpG) (chr 20q.11.2), ПЛАГАЛ1 (6 сайтів CpG) (chr 6q24), SGCE/PEG10 (6 сайтів CpG) (chr 7q21.3), SNRPN (4 сайти CpG) (chr 15q11.2), PEG1/MEST (4 сайти CpG) (chr 7q21.3) та PEG3 (10 сайтів CpG) (chr 19q13.43) [29, 30].
Геномну ДНК витягували із зразків сперми, використовуючи реагенти пурегену (Qiagen; Валенсія, Каліфорнія). Геномну ДНК (800 мкг) обробляли бісульфітом натрію за допомогою набору метилювання ДНК Zymo EZ (Zymo Research; Ірвін, Каліфорнія), перетворюючи неметильовані цитозини в урацили. Метильований цитозин не змінюється при такому лікуванні. Після обробки бісульфітом ДНК (
Статистичний аналіз
Змінні були визначені наступним чином: вік (18–24, 25–29, 30–35), найвищий ступінь освіти (середня школа, певний коледж/аспірантура), сімейний стан (неодружений, одружений/проживає з партнером, або розлучені/вдова), діти, що народилися (так чи ні), кількість годин інтенсивних фізичних вправ на тиждень (менше 4 або 4 год і більше), кількість годин, проведених за переглядом телевізора, сидячих або неактивних за тиждень (менше 4 год. на тиждень або 4 год або більше), концентрація сперми (менше 1,5 × 10 7 або 1,5 × 10 7 сперматозоїдів/мл або більше), рухливість сперми (менше 40 або 40% або більше), загальна кількість сперми або ТМС (менше більше або дорівнює 3,9 × 10 7 або більше 3,9 × 10 7), а також статус пацієнта в клініці народжуваності (так чи ні). Тести хі-квадрат використовувались для порівняння стану надмірної ваги/ожиріння учасників у різних підгрупах. Якщо кількість учасників була невеликою (2 ≤ ІМТ 2), надмірною вагою (25 кг/м 2 ≤ ІМТ 2) та ожирінням (ІМТ ≥ 30 кг/м 2). Для цілей цього аналізу особи з ІМТ старше 25 були віднесені до категорії «надмірна вага/ожиріння».
Середні відсотки метилювання ДНК на кожному сайті CpG та середнє значення загального DMR у чоловіків із нормальною вагою порівняно із чоловіками із зайвою вагою/ожирінням порівнювали за допомогою методу Манна-Уітні U тест. Ці аналізи були розширені за допомогою багатоваріантних регресійних моделей з урахуванням потенційних незрозумілих факторів. Потенційні перешкоди були обрані на основі відомих або спостеріганих асоціацій з метилуванням ДНК та ожирінням; в остаточному, основному аналізі ми контролювали вік та стан пацієнтів у клініці фертильності як незрозумілі. Аналізи чутливості з використанням підгруп наших учасників та різні багатовимірні аналізи, з нашими змінними та без, були повторені та порівняні. Усі аналізи базувались на наявних лабораторних даних для кожного сайту CpG в DMR. Статистичний аналіз проводили в SAS 9.4 (SAS Institute Inc., Cary, NC, USA).
Етика
Дослідження TIEGER було проведено з дозволу Інституційної комісії університету Дюка (довідковий номер: Pro00036645). Інформована згода була отримана від усіх учасників на використання їх біологічних зразків та даних анкет.
Результати
Характеристика учасників дослідження
Розподіл характеристик учасників дослідження за категоріями ІМТ наведено в таблиці 1. Двадцять три чоловіки були віднесені до категорії осіб із надмірною вагою/ожирінням, що становить 33,3% від загальної кількості досліджуваних. Більш конкретно, 11 чоловіків мали надлишкову вагу (25 ≤ ІМТ Таблиця 1 Соціально-демографічні дані чоловіків-добровольців
Метилювання на імпринтованих генах у ДНК сперми учасників TIEGER
Профілі метилювання ДНК сперми у чоловіків із нормальною вагою представлені в таблиці 2. Як передбачалося, наступні DMR генів були майже на 100% метильовані (діапазон, від 80,0 до 93,9%): MEG3-IG, H19, і IGF2, відповідає відомому батьківському походженню метилювання для цих регіонів. Інші досліджені генні DMR були майже повністю неметильованими (діапазон, від 1,6 до 4,1% метильованих), що відповідає відомому материнському походженню метилювання для цих регіонів та вимозі, що ці ділянки деметилюються у спермі до зачаття. Винятком був DMR для MEG3, який був неметильованим (приблизно 0%) у спермі, незважаючи на те, що це відомий по батькові метильований DMR. Однак, як відомо, цей DMR набуває метилювання після запліднення у мишей [31]; таким чином, така схема метилювання все ще відповідає батьківському походженню.
Рівні метилювання в генах із імпринтом у сперми чоловіків із надмірною вагою/ожирінням порівняно з чоловіками із нормальною вагою
Принаймні два з 12 DMR, що вивчались у спермі, були диференційовано метильовані ожирінням або статусом надмірної ваги. Сперма чоловіків із надмірною вагою або ожирінням мала значно вищий (2,8%) рівень метилювання ДНК, ніж сперма чоловіків із нормальною вагою (стор Таблиця 3 Багатофакторний аналіз: метилювання ДНК в DMR імпринтованих генів у сперматозоїдах добровольців із ожирінням та надмірною вагою проти чоловіків із нормальною вагою
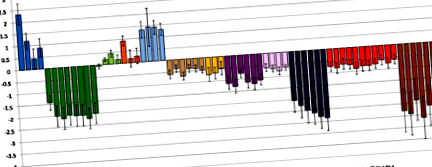
Відмінності метилювання сперми у чоловіків із надмірною вагою/ожирінням у порівнянні із нормальною вагою у чоловіків із імпринтованими генами. Різниця у відсотках метилювання між чоловіками із зайвою вагою/ожирінням та чоловіками нормальної ваги показана на сайті CpG для кожного досліджуваного DMR, скоригованого з урахуванням віку та стану пацієнта в Центрі народжуваності Дюка. Бари представляють SE
Для того, щоб оцінити можливість упередженості відбору за віком, ці аналізи повторювались, обмежуючи досліджувану вибірку 41 чоловіком у віці від 25 до 35 років. У цьому віковому діапазоні віковий розподіл за категорією ІМТ був подібним. Незважаючи на те, що це зменшення обсягу вибірки знизило точність наших оцінок, загальні висновки не змінились (дані не наведені), що свідчить про те, що зв'язок між надмірною вагою або ожирінням та метилуванням ДНК у цих регіонах не зазнає надмірного впливу віку.
Обговорення
Також можуть бути задіяні інші дії, такі як ендокринний фактор BPA або його метаболіти. Ці фактори навколишнього середовища можуть зіграти свою роль у впливі як на збільшення ваги, так і на сперматогенез, і, отже, не можна повністю виключати, що як збільшення ІМТ, так і зміни метилювання є паралельними результатами впливу навколишнього середовища [45]. Майбутні дослідження повинні намагатися з'ясувати основні механізми, за допомогою яких надмірна вага/ожиріння може впливати на відмінності метилювання, і якщо третій фактор, такий як вплив навколишнього середовища або харчові профілі, може впливати на обидва результати.
Зміни метилювання, які ми виявили в цьому дослідженні, були незначними. Однак ці незначні зміни сперми все ще можуть вплинути на фенотипи потомства. Мерфі та ін. повідомили, що 1% зміна метилювання в IGF2 DMR призводить до подвоєння або зменшення вдвічі IGF2 транскрипція, залежно від напрямку метилювання. Цей ступінь змін еквівалентний повній втраті імпринтингу, що особливо важливо, оскільки ця втрата імпринтингу часто спостерігається при раку [46]. Виявлені тут помірні зміни метилювання сперми, пов’язані з ожирінням, також узгоджуються із змінами метилювання, спричиненими людьми внаслідок впливу навколишнього середовища та факторів способу життя у ранньому віці, включаючи пренатальний вплив голоду [47], добавки до харчування матері [48], вживання ліків під час вагітності [49, 50] та опромінення матері кадмієм [51] та свинцем (у пресі Най та Хойо в “Епігенетика навколишнього середовища”). Великі зміни в метилюванні насправді можуть бути менш значущими щодо впливу між поколіннями, оскільки значні аберації метилювання не можуть призвести до життєздатного потомства.
Хоча інші проводили подібний аналіз для менших груп населення [33], можливою слабкістю цього дослідження залишається обмежена статистична сила виявлення значних відмінностей. Крім того, третина нашого населення була завербована в Центрі родючості Герцога. Незважаючи на те, що ми скоригували статус пацієнта у Центрі народжуваності, можуть бути залишкові незрозумілі наслідки невід’ємних відмінностей в характеристиках ДНК сперми між (ожирінням) чоловіками з потенційними проблемами фертильності, які відвідують клініку та тими, хто не відвідує клініку. Отже, наші результати щодо епігенетичних відмінностей сперми можуть частково відображати наслідки для пацієнтів, які звертаються за допомогою до клініки фертильності, а не серед загальної популяції. Окрім того, ми зосередились лише на чоловіках кавказького віртуального розвитку, тоді як Північна Кароліна також включає значну частину населення з інших етнічних груп чи походження, з більшою поширеністю ожиріння, наприклад, афроамериканців [52]. З огляду на зростаючу поширеність ожиріння серед чоловіків, наші провокаційні висновки вимагають повторення в більш масштабному багатоетнічному дослідженні.
Сильні сторони нашого дослідження включають те, що нашу досліджувану групу складали чоловіки репродуктивного віку. Далі ми не відбирали наші групи ожиріння та не ожиріння за будь-якими критеріями. Не було зроблено жодних виключень на основі стану здоров'я (крім тих, що стосуються фертильності), як це було зроблено в роботі Donkin et al. дослідження [33]. Ми зосередились на групі регуляторних елементів, які встановлюються під час сперматогенезу (або раннього післязапліднення у випадку MEG3 DMR) і є критично важливими при програмуванні правильних моделей експресії імпринтованих генів. Оскільки імпринтовані гени, як правило, позбавлені глобального репрограмування після запліднення, моделі метилювання, встановлені під час сперматогенезу, є стійкими і, таким чином, передаються потомству.
Висновки
Поточне дослідження було зосереджене виключно на програмуванні відбитків під час чоловічого гаметогенезу. Наші результати вказують на те, що ожиріння або пов'язані з ним фактори можуть змінити епігенетичне програмування у невеликій частці клітин сперми. Внесок ожиріння батьків у внутрішньоутробний та пізній розвиток дорослих особливо важливий через загальну тенденцію ожиріння та заслуговує на подальші дослідження. На щастя, дослідження також показали, що батьківський вплив на майбутнє потомство можна запобігти втратою ваги та фізичними вправами [53]. Епігенетика може забезпечити ключ до впливу покоління на ожиріння та інші фактори способу життя як матерів, так і батьків на здоров'я потомства. Якщо ожиріння батьків насправді впливає на подальше здоров'я та розвиток нащадків, то потреба у зміні способу життя є ще більш нагальною.
- Результати нашого дослідження
- Віддавайте перевагу чаю за кавою, це можуть бути ваші гени, результати досліджень; CBS Сакраменто
- Різниця між селом та містом у дієтичній поведінці та ожирінні Результати дослідження Ріскесдаса у
- Харчові науки Харчові науки Гуманітарні науки TTU
- Бакалаврська програма з харчових наук Пенсильванський державний коледж охорони здоров'я та розвитку людини