Механізми винагороди при ожирінні: нові уявлення та майбутні напрямки
Пол Дж. Кенні
1 Лабораторія поведінкової та молекулярної нейронауки, Відділ молекулярної терапії, Науково-дослідний інститут Скриппса, Юпітер, Флорида 33458, США
Анотація
Їжа вживається для того, щоб підтримувати енергетичний баланс на гомеостатичному рівні. Крім того, смачна їжа також споживається за її гедонічні властивості, незалежно від енергетичного стану. Таке споживання, пов'язане з винагородою, може призвести до того, що споживання калорій перевищує потреби, і вважається головним винуватцем швидко зростаючих показників ожиріння в розвинених країнах. Порівняно з гомеостатичними механізмами харчування, набагато менше відомо про те, як гедонічні системи мозку впливають на споживання їжі. Що цікаво, надмірне споживання смачної їжі може спричинити нейроадаптивні реакції у схемах винагороди мозку, подібних до зловживання наркотиками. Крім того, подібні генетичні вразливості в системах винагороди мозку можуть збільшити схильність до наркоманії та ожиріння. Тут будуть розглянуті останні досягнення в нашому розумінні мозкових схем, що регулюють гедоністичні аспекти харчової поведінки. Також будуть розглянуті нові докази, що ожиріння та наркоманія можуть поділяти загальні гедоністичні механізми.
"Не існує щирішої любові, ніж любов до їжі".
Вступ
Ожиріння, що визначається як індекс маси тіла (ІМТ)> 30, - це стан, при якому ожиріння є аномально високим і може бути наслідком гіперфагії або зниження швидкості метаболізму (O’Rahilly, 2009). Надмірна ожиріння є основним фактором ризику серцево-судинних захворювань, раку, діабету 2 типу та розладів, пов’язаних з настроєм, оскільки люди з ожирінням часто страждають від соціальної стигматизації (Bean et al., 2008; Центри контролю та профілактики захворювань, 2009; Luppino et al ., 2010). За даними Центру контролю за захворюваннями (CDC), витрати на охорону здоров’я, пов’язані з ожирінням, у США між 1998 і 2000 рр. Становили приблизно 213 млрд. Доларів. Крім того, 300 000 смертей у Сполучених Штатах щороку можна віднести до захворювань, пов’язаних із надмірною вагою та ожирінням (Allison et al., 1999), при цьому ожиріння є другою провідною причиною смерті, яку можна запобігти вживанню тютюну. Тим не менше, поширеність ожиріння в західних суспільствах продовжує різко зростати, і, за сучасними підрахунками, понад 30% дорослих людей у Сполучених Штатах страждають ожирінням (Flegal et al., 2010).
Більшість концептуалізацій регулювання годівлі передбачають взаємодію двох паралельних систем, що впливають на споживання їжі (Hommel et al., 2006; Lutter and Nestler, 2009; Morton et al., 2006). Гомеостатична система включає гормональні регулятори голоду, ситості та ожиріння, такі як лептин, грелін та інсулін, які діють на схеми гіпоталамусу та стовбура мозку для стимулювання або гальмування харчування для підтримки належного рівня енергетичного балансу. Порушення функціонування компонентів гомеостатичної системи, наприклад, вроджений дефіцит лептину, може призвести до стійкого стану позитивного енергетичного балансу та розвитку ожиріння (Campfield et al., 1995; Halaas et al., 1995; Pelleymounter et al., 1995 ). Механізми, за допомогою яких гормональні регулятори голоду та ситості діють на схеми гіпоталамусу та стовбура мозку для підтримки енергетичного гомеостазу, були детально описані в інших місцях, і читачів, зацікавлених у цій темі, посилаються на безліч чудових оглядів на цю тему (наприклад, Abizaid et al., 2006a; Gao and Horvath, 2007).
Активація систем винагороди мозку у відповідь на смачну їжу: взаємодія з гормональними регуляторами енергетичного балансу
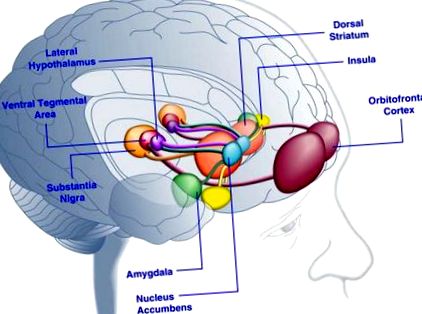
Вважається, що орбітофронтальна кора і мигдалина кодують інформацію, що стосується винагородної вартості їжі (Baxter and Murray, 2002; Holland and Gallagher, 2004; Kringelbach et al., 2003; O'Doherty et al., 2002; Rolls, 2010) . Інсула обробляє інформацію, що стосується смаку їжі та її гедонічної оцінки (Balleine and Dickinson, 2000; Small, 2010). Nucleus accumbens і дорсальний смугастий вузол, які отримують дофамінергічний вхід з вентральної ділянки ділянки та чорної субстанції, регулюють мотиваційні та стимулюючі властивості їжі (Baicy et al., 2007; Berridge, 1996, 2009; Farooqi et al., 2007; Malik та ін., 2008; Söderpalm and Berridge, 2000). Бічний гіпоталамус може регулювати корисні реакції на смачну їжу та стимулювати поведінку, яка шукає їжу (Kelley et al., 1996). Ці мозкові структури діють узгоджено, щоб регулювати вивчення гедоністичних властивостей їжі, спрямовуючи увагу та зусилля на отримання продовольчих винагород та регулюючи стимулюючу цінність екологічних стимулів, які передбачають наявність харчових винагород (Dagher, 2009). Для наочності показано не всі взаємозв'язки між цими структурами.
Мозкові схеми, що регулюють гедонічне харчування: дофамінові системи середнього мозку
Мозкові схеми, що регулюють гедонічне харчування: Стриатогіпоталамічні системи
Враховуючи основний вплив акумуляльної сигналізації на гедонічне годування, Томпсон і Суонсон (2010) використовували процедуру відстеження ланцюгів, щоб точно визначити точні анатомічні мережі, за допомогою яких NAc може впливати на смачне споживання їжі. У цих елегантних дослідженнях щури отримали дві неперекриваючі ін'єкції антероградних/ретроградних індикаторів (що називаються COIN) у місцях оболонки NAc, які сильно впливають на споживане їжу, і були виявлені аферентні/еферентні зв'язки. Було показано, що ділянки, пов'язані з годуванням, у NAc поширюють гальмівні проекції переважно на передній ЛГ та вентральний блідий (VP) (Thompson and Swanson, 2010). На відміну від решти NAc, яка щільно проектується на VTA, гедонічні гарячі точки в оболонці NAc, пов'язані з їжею, проектуються на міжфасцікулярне ядро (IFN), структуру, розташовану поруч з VTA, яка поширює дофамінергічні проекції у відповідь назад до Оболонка NAc (Томпсон і Суонсон, 2010). Крім того, передній LH проектується на LHb (Thompson and Swanson, 2010), ще раз припускаючи, що габенулярний комплекс може відігравати роль у гедоніці їжі (Friedman et al., 2011).
Область оболонки nucleus accumbens (NAc) отримує іннервацію від кіркових і лімбічних ділянок головного мозку і проектується в бічний гіпоталамус і вентральний блідий. У свою чергу, бічний гіпоталамус також проектується на вентральний палідум, а також на PAG, IFN, VTA та дорсальне ядро рафе. IFN та дорсальний раф поширюють дофамінергічну та серотонінергічну проекції відповідно до NAc. Бічний гіпоталамус також іннервує таламічну (PVN і PON) та епіталамічну (LHb) структури. Не показані незначні виступи від бічного гіпоталамуса до ділянок мозку перегородки. 5-HT, серотонін; ІФН, міжфасцікулярне ядро; LHb, бічна габенула; PON, преоптичне ядро; ПВН, паравентрикулярне ядро таламуса; VTA, вентральна тегментальна область. Малюнок адаптовано з дозволу Томпсона та Суонсона (2010).
Мозкові схеми, що регулюють гедонічне харчування: стриатопаллідальні системи
Мозкові схеми, що регулюють гедонічне харчування: системи Амігдали
Надалі підтримуючи уявлення про те, що аспекти негомеостатичного прийому їжі є нерозв'язними, вливання налоксону в оболонку NAc або VP, але не в базолатеральну мигдалину (BLA), зменшує смакові якості розчинів сахарози (Wassum et al., 2009). Однак, коли антагоністи μ-опіоїдних рецепторів налоксон або CTOP вводили в BLA, але не в оболонку NAc або VP, спостерігалося помітне послаблення підвищеної мотивації реагувати на розчини сахарози, які зазвичай спостерігаються в голодному стані (Wassum et al., 2011; Wassum et al., 2009). Це свідчить про те, що стимулюючі властивості сахарози регулюються амігдалярними схемами. Загалом, вищезазначені результати показують, що різні аспекти гедонічного харчування, такі як обробка інформації, пов’язаної з смаком їжі, поведінкою підходу та підвищенням стимулюючої цінності смачної їжі у голодних тварин, диференційовано регулюються дискретними мікросхемами в контексті більша кортиколімбічна-стриатопалідально-гіпоталамо-таламокортикальна схема (рис.2).
Робіть адаптації в мозкових гедонічних ланцюгах, що стимулюють компульсивне харчування?
Змінена діяльність за винагороду мозку при ожирінні: дослідження зображень мозку людини
Збільшення ваги пов’язане зі зниженням активації смугових тканин у відповідь на смачну їжу, виміряну за допомогою фМРТ, і зниженням рівня наявності у людей смугастого рецептора дофаміну D2 (D2R) (детальніше див. Текст).
Дефіцитна сигналізація рецептора дофаміну D2 при ожирінні
Дефіцитна сигналізація D2R сприяє дефіциту винагороди при ожирінні
Нокдаун рецепторів дофаміну D2 (D2R) у стриатумі щурів прискорює появу дисфункції винагороди та примусове харчування у щурів з розширеним доступом до смачної їжі.
Дефіцитна сигналізація D2R може спричинити компульсивне харчування при ожирінні
Ожиріння характеризується переїданням, яке зберігається, незважаючи на виражене бажання обмежити споживання та знання про глибокі негативні наслідки для здоров’я та соціальні наслідки тривалого надмірного споживання (Booth et al., 2008; Delin et al., 1997; Puhl et al., 2008) . Прикладом цього є той факт, що багато пацієнтів із ожирінням будуть піддаватися потенційно небезпечній баріатричній (шлунковому шунтування) операції для контролю своєї ваги (Yurcisin et al., 2009), але часто рецидив переїдання, хоча операція знижує суб'єктивні показники голоду та знижує здатність споживати велику кількість їжі (Kalarchian et al., 2002; Saunders, 2001). Наркоманія аналогічно визначається як втрата інгібіторного контролю над споживанням наркотиків та збереження звички, незважаючи на усвідомлення потенційно руйнівних наслідків для здоров'я, соціальних або фінансових наслідків (DSM-IV; Американська психіатрична асоціація, 1994). Таким чином, ожиріння та наркоманія поділяють ознаки компульсивних розладів тим, що є помітним невдалим використанням інформації щодо майбутніх шкідливих наслідків помірного споживання та наполегливості споживання, незважаючи на наявність менш шкідливих альтернативних способів поведінки.
Взаємодія між D2R та гормональними регуляторами енергетичного балансу при ожирінні
Дисрегульовані системи стресового мозку при ожирінні
Окрім регулювання впливу шкідливих стимулів навколишнього середовища на поведінку годування, CeA може також відігравати ключову роль у гедонічному харчуванні, пов’язаному зі стресом. У людей стрес сильно мотивує вибір та споживання енергійної смачної їжі, незалежно від потреби в калоріях (Gluck et al., 2004; Kandiah et al., 2006; O'Connor et al., 2008), а ожиріння пов’язане з підвищена секреція глюкокортикоїдів, пов’язана зі стресом (Björntorp and Rosmond, 2000; la Fleur, 2006). Екологічні та соціальні стресові фактори також викликають гіперфагію енергетично смачної їжі у гризунів та мавп, при цьому смачна їжа може послабити несприятливі наслідки стресу (Dallman et al., 2003, 2006; Pecoraro et al., 2004; Wilson et al., 2008). Крім того, препарат, що викликає стрес, йохімбін може відновити раніше загашену смачну їжу, яка шукає відповіді (натискання на важіль) у щурів, що послаблюється антагоністом рецептора кортикотропіну-реліз-фактора-1 (CRF-1) анталармін (Ghitza et al., 2006 ). Важливо зазначити, що точний вплив стресу на споживання їжі у людей та лабораторних тварин залежить від природи та величини стресора, типу їжі, доступної для споживання (смачна проти м'якої), маси тіла та статі (Даллман, 2010).
Висновки
Подяка
Автор підтримується грантами Національного інституту зловживання наркотиками (NIDA). Автор вдячний Полу Джонсону та Крісті Фаулер за цінну інформацію та коментарі до рукопису. Це рукопис № 21042 Науково-дослідного інституту Скриппса.
- Визначення, оцінка, поширеність та механізм фізичної активності та саркопенічного ожиріння Майбутнє
- Зниження ожиріння вимагає життя села HuffPost
- Підготовка до шлункового шунтування Що потрібно знати; Новини ожиріння сьогодні
- Ліки, що відпускаються за рецептом для лікування надмірної ваги та ожиріння Кето Нескінченний Accel Legal Speed таблетки Дієта
- Ліки, що відпускаються за рецептом для лікування надлишкової ваги та ожиріння BioOneGen Keto Shred Шлунок Жирові дієтичні таблетки