Маркери пухлини
Що таке маркери пухлини?
Пухлинні маркери - це біомаркери, які існують в пухлинних клітинах або непухлинних клітинах крові, сечі, кісток та інших органах, що вказують на виникнення, прогресування та рецидив раку. Більшість пухлинних маркерів є білками, однак останнім часом як онкомаркери використовуються моделі експресії генів або зміни ДНК і навіть тривала некодирующая РНК. Тим часом тест на онкомаркери розглядається як супутній діагностичний тест, і його результат слід додатково підтвердити біопсією або іншими способами.
Функції пухлинних маркерів
Маркери пухлини застосовуються в наступних полях:
Виявлення: Ви можете відстежувати конкретні симптоми за допомогою певних онкомаркерів, щоб своєчасно викопати загарбників.
Діагностика: допомогти перевірити певні пухлини, такі як деякі пухлини мозку.
Постановка: Ви можете контролювати стадію пухлини за допомогою розташування пухлинних маркерів, які використовуються для метастазування та моніторингу втікачів пухлини після лікування, щоб запобігти рецидиву.
Підтвердження персоналізованої медицини: направляти ліки та зменшувати шкоду від непотрібного лікування.
Прогноз: Щоб перевірити ефект від лікування та допомогти спланувати майбутнє пацієнтів після операції.
Як класифікувати маркери пухлин?
За своїми хімічними та імунологічними характеристиками онкомаркери можна класифікувати як онкофетальні білки, такі як AFP (альфа-фетопротеїн), асоційовані з пухлиною антигени або вуглеводні антигени, такі як CA (антиген карциноми), гормони, такі як HCG (хоріонічний гонадотропін людини), ферменти та ізоферменти як PAP (фосфатаза простатичної кислоти), спеціальні білки сироватки, такі як феритин, прото-онкогени та анти-онкогени, такі як p53, інші, як ген злиття BCR-ABL.
Відповідно до їх джерела, пухлинні маркери також можна класифікувати як маркери, що виробляються оригінальними пухлинними тканинами, такими як AFP, або наступними тканинами, такими як рецептор інтерлейкіну та фактор некрозу пухлини (TNF) .
Механізм та виявлення пухлинних маркерів
Традиційні способи перевірки пухлин включають магнітно-резонансну томографію, мамографію, ультрасонографію, комп’ютерну томографію, тест маркера пухлини та біопсію. При проведенні тесту на онкомаркери деякі специфічні онкомаркери будуть перевірятись на кількох зразках, відібраних протягом часу лабораторіями, що використовують різні імунологічні, біологічні та хімічні аналізи. Механізм та виявлення такі:
Активована або підвищена експресія пухлинних маркерів вказує на існування раку. Ми можемо використовувати технологію qPCR або FISH для виявлення експресії ДНК/РНК, а також технологію WB, IHC або ELISA для виявлення експресії білка.
Структурна мутація пухлинних маркерів вказує на існування раку. Структурна мутація включає ампліфікацію, транслокацію та інверсію генів, які можна виявити за допомогою технології qPCR або FISH. Для рівня білка ми можемо застосувати технологію WB, ELISA або IHC для виявлення.
Загальновживані маркери пухлин для раку
Пухлинні маркери широко використовуються для тестування в лабораторіях, хоча деякі з них є специфічними, що відповідають встановленим стандартам, а інші - ні. Тут ми якомога повніше перераховуємо загальні онкомаркери (табл. 1).
Таблиця 1. Загальновживані маркери пухлини в клініці
Ми представимо застосування онкомаркерів для кількох найпоширеніших видів раку, зокрема наступне:
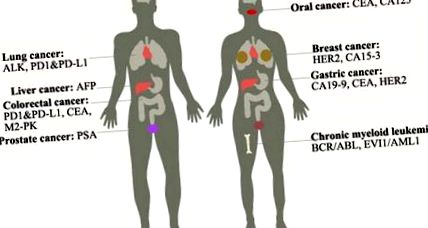
Рак молочної залози: Це другий за поширеністю тип раку серед американських жінок. На сьогоднішній день існує три типи раку молочної залози: просвітній тип, тип HER2 та базальноподібний тип. До пухлинних маркерів для нього належать: HER2, ампліфікація гена або надмірна експресія білка призводить до пухлини; CA15-3, який підвищує його експресію, коли пухлина трапляється або коли жінки вагітні [1]. Лише 8% раку молочної залози є спадковим [2]. Лікування включає променеву терапію, мастектомію тощо.
HER2 також відомий як рецептор тирозин-протеїнкінази erbB-2, який є одним із рецепторів епідермального фактора росту людини. Ненормальна кількість копій генів становить 20-30% випадків раку молочної залози [3]. Ми можемо використовувати специфічний зонд FISH для перевірки генних копій або специфічних антитіл для виявлення рівня білка. Позитивний тип HER2 стимулюватиме шлях PI3K/AKT та шлях RAS/RAF/MAPK і може бути заблокований за допомогою моноклональних антитіл Герцептин. Крім того, надмірне вираження HER2 може мати місце при раку яєчників, легенів, шлунку.
Крім того, серед пацієнтів типу базального типу, сигнальні шляхи Notch та Wnt/бета-катеніну нерегульовані, EGFR ідентифікується як маркер цього шляху. У той час як у пацієнтів з раком молочної залози просвіту спостерігається неправильне регулювання шляху естрогену (ЕР).
Рак передміхурової залози: це найпоширеніший тип раку серед чоловіків і друга причина за смертю від раку серед чоловіків. Дефіцитні рівні PTEN та NKX3.1 призводять до зниження рівня p27, зменшення апоптозу та збільшення проліферації. Маркером пухлини для нього є: PSA, який підвищений у крові, коли трапляється рак. Лікування включає хірургічне втручання, променеву терапію, гормональну терапію тощо. Це найпоширеніший тип раку серед чоловіків і друга причина за смертністю від раку серед чоловіків. Дефіцитні рівні PTEN та NKX3.1 призводять до зниження рівня p27, зменшення апоптозу та збільшення проліферації. Маркером пухлини для нього є: PSA, який підвищений у крові, коли трапляється рак. Лікування включає хірургічне втручання, променеву терапію, гормональну терапію тощо.
PSA також відомий як простатоспецифічний антиген. Це може бути перевірено специфічним антитілом. Підвищена кількість ПСА в крові може бути виявлена у людей, які страждають на рак передміхурової залози та непростативної залози, але мають запалення.
Рак легенів: Існує два типи раку легенів: недрібноклітинний рак легенів (85%) і дрібноклітинний рак легенів (15%). Куріння є основною причиною цього захворювання. До пухлинних маркерів для нього належать ALK, які переставляють змушуючи ALK зливатися з геном EML4 [4]; PD1 та його ліганд PD-L1, які підвищують їх експресію, коли відбувається пухлина, і становлять 53% -62% випадків НМРЛ [5]. Лікування включає хірургічне втручання, хіміотерапію, цілеспрямовану терапію тощо. Цільова терапія, така як моноклональні антитіла та інгібітори тирозинкінази, може зменшити шкоду для нормальних клітин.
Молекулярний механізм недрібноклітинної легені включає активацію деяких генів, таких як ALK, EGFR, RAS та інактивацію генів супресорів пухлини, таких як p53. Коли ALK-EML4 зливаються між собою, безперервно активуючи ALK, що призведе до інвазії, збільшення проліферації та зменшення апоптозу. Мутація або надмірна експресія EGFR сприяє збільшенню проліферації. Мутація RAS передає сигнал зростання. Інактивація p53 сприяє збільшенню проліферації та зменшенню апоптозу.
Ген рецептора анапластичної лімфоми тирозинкінази (ALK), розташований у 2p23, що є гарячою точкою для розпаду, і він може обернутися з EML4, викликаючи недрібноклітинну легеню. Тим часом він може переставляти інші гени, щоб викликати інші злоякісні пухлини [4] [6]. Ми можемо використовувати специфічні зонди FISH для перевірки мутації.
Хронічний мієлоїдний лейкоз: Це захворювання кісткового мозку, оскільки воно виробляє занадто багато білих клітин у кістковому мозку і може поступово впливати на клітини крові. Це захворювання в основному серед людей старше 55 років і рідше серед дитинства. Більше 90% ХМЛ має філадельфійську хромосому, яка робить злитий ген BCR-ABL, що веде до безперервної активації ABL, що в кінцевому підсумку регулює нижні гени через сигнальний шлях JAK-STAT та MAPK [7]. Методи лікування - цілеспрямована терапія інгібітором тирозинкінази, таким як іматиніб, хірургічне втручання тощо. Онкомаркерами для нього є: BCR/ABL, EVI1/AML1 тощо.
BCR, також відомий як регіон кластерних областей, розташований на 22q11. ABL (abelson), який кодує нерецепторну тирозинкіназу, знаходиться в 9q34. Злиття BCR/ABL усуває негативну регуляцію ABL, що веде до фосфорилювання серійних генів та пригнічення апоптозу. Ми можемо використовувати специфічні зонди FISH для перевірки мутації. Крім того, аномалія також існує серед пацієнтів з ВСІ та ГМЛ.
EVI1, також відомий як сайт 1 інтеграції екотропних вірусів, розташований на 3q26.2. Це може збільшити копії генів, що призведе до надмірної експресії або перебудови, що призведе до злиття з геном AML1, що запобіжить диференціюванню та апоптозу. Ми можемо використовувати специфічні зонди FISH або специфічні антитіла для перевірки мутації [8] .
Рак печінки: Це один з найбільш смертоносних видів раку, який включає рак жовчних проток (холангіокарцинома) та гепатоцелюлярну карциному (HCC). HCC, який складає 80% випадків, включає хронічну інфекцію гепатитом B або C та цироз печінки. На гепатит В припадає 90% гепатоцелюлярної карциноми, яку можна запобігти специфічною вакциною. Маркером пухлини для нього є: AFP. Лікування включає хірургічне втручання, хіміотерапію тощо.
AFP (альфа-фетопротеїн) - це глікопротеїн, що продукується плодом, отриманим із ембріональних клітин ендодерми, і не може бути виявлений у крові здорових дорослих чоловіків чи жінок. AFP відповідає його рецептору. AFP/AFPR викликає приплив Са 2+, що в кінцевому підсумку збільшує рівень CAMP, посилюючи активність протеази А та ампліфікацію ДНК, а потім пухлина проліферує [9]. Більше того, AFP може викликати імунний втечу шляхом пригнічення функції дендритних клітин, природних клітин-кілерів та Т-лімфоцитів, так що підвищений рівень вказує на первинний рак печінки або пухлину статевих клітин, і він привертає більше уваги до раку печінки імунотерапія [10]. Це може бути виявлено за допомогою специфічних антитіл.
Колоректальний рак: Колоректум допомагає нам засвоювати поживні речовини та передавати відходи з організму, тоді як колоректальний рак, включаючи рак товстої кишки та прямої кишки, є другим смертоносним вбивцею серед ракових захворювань у західних країнах. Це може бути спричинено спадковістю тощо. Якщо своєчасно виявити та видалити поліп, він не стане гіршим. Маркерами пухлини для нього є CEA, M2-PK, PD-L1 та ін. Лікування включає цілеспрямовану терапію, хірургічне втручання тощо.
Це робить ряд генетичних змін, що включають активацію онкогенів, таких як K-Ras, та інактивацію TSG, таких як p53, DCC/Smad4 та APC. Це також асоціюється з генними мутаціями та спадковим синдромом.
В даний час PD1, PD-L1 та CTLA4 затверджені як інгібітори контрольних точок. Шлях PD1 сигналізує про втечу від пухлин. PD-L1 (запрограмований ліганд смерті 1), оскільки його ліганд може інгібувати Т-ефекторні клітини від вбивства пухлинних клітин, визначається кількісно за допомогою IHC. Однак іноді він пропускає деяких пацієнтів-кандидатів на імунотерапію як стандарт через гетерогенність або інші причини. У супроводі ТМБ (мутаційне навантаження на пухлину, неоантиген в результаті соматичної мутації може спричинити деяку імунну відповідь, заблоковану імунною контрольною точкою, яка передбачається наступним поколінням), ми можемо аргументувати або замінювати дані. PD-L1 експресується на різних типах пухлин, включаючи НМРЛ та рак товстої кишки. Ми можемо використовувати специфічні антитіла для перевірки мутації та використовувати пембролізумаб для зупинки цього шляху [5] .
Рак шлунка: Він утворюється у внутрішньому шарі шлунка і поширюється на зовнішній шар. Підвищений вік, захворювання шлунка та нездорова дієта можуть підвищити ризик раку шлунка. Маркери пухлини для нього включають CA19-9, CEA та HER2, так що ми можемо використовувати специфічні антитіла для виявлення раку [11] [12]. Рамуцирумаб може запобігти росту нових кровоносних судин, необхідних для росту пухлини. Додаткові методи лікування включають хіміотерапію, променеву терапію тощо. Молекулярний механізм полягає в тому, що рак шлунка пов’язаний з мутацією p53, APC, CDH1 та надмірною експресією c-ErbB2, MET, FGFR2F.
Маркери пухлини CA19-9 (антиген карциноми 19-9), CA72-4 (антиген карциноми 72-4), CEA (карциноембріальний антиген) мають хороші поради щодо моніторингу та прогнозу. Підвищений їх рівень може свідчити про рецидив [12] .
Рак порожнини рота: Це один із раків голови та шиї. Нездорова дієта, така як горіх ареки, вживання тютюну, вживання алкоголю, папіломавірусна інфекція людини може підвищити ризик розвитку раку порожнини рота, якого слід уникати якомога більше. Ознаками цього захворювання є ущільнення в роті, кровотеча і біль у роті або горлі, оцінка, яку неможливо вилікувати протягом тривалого часу. Хоча ознаки не означають, що у вас вже є рак порожнини рота, ми можемо додатково виявити його за допомогою КТ, ендоскопії тощо. До пухлинних маркерів цього захворювання належать CEA, CA125 [13]. Лікування залежить від стадії раку, включаючи хіміотерапію, хірургічне втручання тощо.
Завдяки великим дослідженням онкомаркерів, персоналізована допомога раку зараз швидко стає реальністю в клінічній оцінці та лікуванні пацієнтів. Ми сподіваємось, що додаток принесе користь більшій кількості людей із ефективністю та нижчою ціною в майбутньому. Крім того, ми повинні докласти максимум зусиль, щоб захиститися від факторів ризику розвитку пухлин.
[1] Feizic H, Mujagic S та ін. Маркер пухлини CA 15-3 у хворих на рак молочної залози [J]. Acta Med Acad, 2015 (44): 39-46
[2] Calarf GM, Zepeda AB та ін Молекулярні аспекти стійкості до раку молочної залози до наркотиків [J]. Int J Oncol, 2015 (47): 437-445
[3] Slamon DJ, Clark GM та ін Рак молочної залози людини: кореляція рецидиву та виживання з посиленням онкогену HER-2/neu [J]. Наука, 1987 (235): 177-182
[4] Takeuchi K, Choi YL та ін. Мультиплексний скринінг зворотної транскрипції та ПЛР для транскриптів злиття EML4-ALK [J]. Clin Cancer Res. 2008 (14): 6618-6624
[5] Cyriac G, Gandhi L. Нові біомаркери для інгібування імунної контрольної точки при раку легенів [J]. Semin Cancer Biol, 2018 травень
[6] Lin E, Li L та ін. Профілювання масиву Exon виявляє злиття EML4-ALK при раку легенів молочної залози, колоректального та недрібноклітинного раку [J]. Mol Cancer Res, 2009 (7): 1466-1476
[7] Shteper PJ, Ziegfried Z та ін. Метилювання ABL1 у Ph-позитивному ALL є виключно асоційованим із формою P210 BCR-ABL [J]. Лейкемія, 2001 (15): 575-582
[8] Glass C, Wilson M та ін. Роль EVI1 у мієлоїдних злоякісних пухлинах [J]. Blood Cell Mol Dis, 2014 (53): 67-76
[9] Li MS, Li PF та ін. Сприяючий молекулярний механізм альфа-фетопротеїну на ріст клітинної лінії гепатоми людини Bel7402 [J]. World J Gastroenterol, 2002 (8): 469-475
[10] Ван XP, Ван QH. Імунітет до альфа-фетопротеїну та гепатоцелюлярної карциноми [J]. Can J Gastroenterol Hepatol, 2018 квіт
[11] Gravalos C, Jimeno A. HER2 при раку шлунка: новий прогностичний фактор і нова терапевтична мета [J]. Енн Онкол 2008 (19): 1523-1529
[12] Shimada H, Noie T та ін. Клінічне значення сироваткових маркерів пухлини для раку шлунка: систематичний огляд літератури Цільовою групою японської асоціації раку шлунка [J]. Рак шлунка, 2014 (17): 26-33
[13] Zhou YG, Li CM та ін Діагностичні значення виявлення на окремих різних онкомаркерах при раку порожнини рота на різних стадіях [J]. J Beihua Univ, 2016 (17): 217-221
- Термонейтральність пригнічує термогенні маркери та посилює безалкогольну жирну печінку у мишей
- Цільове лікування уповільнює прогресування рідкісної сполучнотканинної пухлини - ScienceDaily
- Характеристика маркерів профіброзу та ендотеліальних дисфункцій у хворих на астму
- Лікування пухлини головного мозку Що відбувається після лікування гамма-ножем
- Взаємозв'язок співвідношення нейтрофілів і лімфоцитів крові з маркерами харчування та результатами здоров'я