Маркери для прогнозування смерті як результату для мишей, що використовуються при дослідженні інфекційних хвороб
Rita A Trammell
1 Відділи внутрішньої медицини Спрингфілд, штат Іллінойс
Лінда Тот
2 Фармакологія, Медичний факультет університету Південного Іллінойсу, Спрингфілд, штат Іллінойс
Анотація
Лабораторні миші є найкращими видами для багатьох видів досліджень інфекційних хвороб. Однак дослідження інфекційних хвороб часто включають мишей, які хворіють і, можливо, вмирають в результаті інфекційних проблем, яким вони піддаються. Ця ймовірність викликала зацікавленість у визначенні гуманних експериментальних кінцевих точок, які підтримують наукову цілісність експерименту чи тесту. 5,6 Розробка точних об'єктивних маркерів, які могли б бути використані для прогнозування можливої смерті та запобіжної евтаназії, була б корисною як для пом'якшення лиха від тварин, так і для дозволу на виконання термінальних процедур та забору зразків до смерті.
Експериментальні кінцеві точки в біомедичних дослідженнях повинні визначатися на основі поєднання наукових, етичних, правових, практичних та гуманних міркувань. Нашою метою цього дослідження було визначити, чи можна застосовувати критерії, які були запропоновані для прогнозування неминучої смерті в дослідженнях довголіття 11, для відносно гострих досліджень інфекційних захворювань. Дані досліджень, проведених з інших причин, були зібрані та проаналізовані ретроспективно, щоб визначити, чи можна використовувати показники маси тіла (BW) та температури для диференціації мишей, які жили б, від тих, які загинули б за різних моделей інфекційних захворювань.
Матеріали і методи
Усі миші були придбані в лабораторії Джексона і були розміщені в одностатевих групах по клітинах розміром 5 × 11 дюймів × 7 дюймів × 5 дюймів. Клітки представляли собою клітини з відкритим верхом у стилі взуттєвих коробок із підстилкою з дерев’яної тріски (Beta Chip, Northeastern Products, Warrensburg, NY). Мишей утримували за допомогою звичайних методів вирощування, клітини міняли щотижня. Кімнатну температуру підтримували на рівні 21,1 ± 1,2 ° C (70 ± 2 ° F), а відносну вологість - від 40% до 60%. Більшість мишей годували LabDiet 5001 (PMI Nutrition International, Сент-Луїс, Міссурі), хоча одна група отримувала дієту з високим вмістом жиру (D12492, 60 ккал% жиру, Research Diets, Нью-Брансвік, Нью-Джерсі). Їжа та водопровідна вода були доступні за бажанням. Всі миші не мали відомих інфекцій мишачим вірусом гепатиту, хвилинним вірусом мишей, парвовірусом мишей, мишачим норовірусом, вірусом мишачого енцефаломієліту Theiler, епізоотичною діареєю вірусу немовлят, вірусом Сендаї, Mycoplasma pulmonis, вірусом пневмонії мишей, реовірусом 3, лімфоцитарним вірус хоріоменінгіту, вірус ектомелії та ендо- та ектопаразити, що контролюється за допомогою щомісячного тестування мишей-сторожових, розміщених в одній кімнаті. Комітет з лабораторного догляду та використання тварин при Медичній школі Університету Південного Іллінойсу схвалив усіх тварин та експериментальні процедури, використані в цьому дослідженні.
Вимірювання температури.
Для більшості досліджень мишам імплантували під наркозом ізофлуран підшкірний мікрочіп, що дозволяє дистанційно вимірювати температуру тіла за допомогою зчитувача палички (модель IPTT300, BioMedic Data Systems, Сіфорд, Делавер). Мікрочіп імплантували за допомогою пристрою для доставки із залученням голки 12 калібру, без розрізу або закриття рани. Перед використанням окремі мікросхеми не перевірялись на точність і не калібрувались іншим способом, але використовувались відповідно до рекомендацій виробника. Мишам, щепленим Candida albicans, імплантували під кетамін-ксилазиновою анестезією внутрішньочеревні передавачі, щоб забезпечити безперервне вимірювання температури тіла через приймач, розміщений під кліткою. 15
Дослідження було ретроспективною оцінкою мишей, які зазнали різних інфекційних проблем, для використання в інших дослідженнях. Мишей оцінювали щонайменше щодня як до, так і після щеплення. Температуру та масу тіла вимірювали протягом 2-годинного періоду після настання світла. Для мишей з черевними передавачами аналізованими значеннями температури були середні значення, отримані протягом 2 год після настання світла. Клінічні кінцеві точки попереджувальної евтаназії включали відчутну гіпотермію (за нашим досвідом мишей, яким імплантували телеметричні перетворювачі температури під час різних інфекційних станів, відчутна гіпотермія, як правило, відображає температуру тіла менше 25 ° C), нездатність або небажання ходити, відсутність реакції до маніпуляцій та важкої задишки або ціанозу. Мишей, у яких з’явився будь-який із цих ознак, негайно евтаназували і вважали померлими.
Інфекційні проблеми.
Штам грипу A/HK/x31 (H3N2).
Вірусні запаси штаму грипу A/HK/X31 (H3N2) (X31) готували шляхом інокуляції зароджених курячих яєць. Алантоєву рідину, інфіковану вірусом, збирали і аліквоти заморожували при -80 ° C до використання. Титр вірусного запасу визначали за допомогою аналізу TCID50. Щоб створити грипозну інфекцію, дорослим самцям мишей A/J (n = 11) знеболювали злегка та інназалізували інтраназально 25 мкл аллантоїсної рідини, що містить від 5 × 10 1 до 5 × 10 5 штаму вірусу грипу TCID50 X31, як описано раніше. 16 З нашого досвіду використання цього вірусу, найвища доза, що застосовується тут у мишей A/J, не є летальною для мишей C57BL/6J або BALB/cByJ. Евтаназію проводили знекровленням під анестезією ізофлураном.
Штам Streptococcus pneumoniae D39 (серотип 2).
S. pneumoniae, яка була трансформована за допомогою люкс-оперону 2, була отримана від д-ра Джонатана Маккаллера (Дитяча дослідницька лікарня Сент-Джуд, Мемфіс, Теннессі). Для підготовки запасів колонії бактерій, виділені з триптичного соєвого агару, доповненого 3% дефібринованою кров’ю овець (кров’яні агарові пластинки, Enova Medical, St Paul, MN), інокулювали в бульйон Тодда Хьюітта (Fisher Scientific, Пітсбург, Пенсильванія) і вирощували при 37 ° С до щільності OD620 від 0,6 до 0,7. Стерильний гліцерин додавали до кінцевої концентрації 16,7% перед заморожуванням аликвот при -80 ° C. Серійні розведення запасів бактерій висівали у трьох примірниках на пластинки кров’яного агару для отримання титру. Для інокуляції мишей бактеріальний запас розводили у стерильному фізіологічному розчині без ендотоксинів, а дорослим самцям мишей BALB/cByJ (щонайменше 4 миші на дозу; загальне значення n = 36) інокулювали інтраназально 25 мкл 10-кратних серійних розведень запас, з дозами від 1 × 10 2 до 1 × 10 7 КОЕ. LD50 люкс-трансформованого штаму S. pneumonia D39 для мишей BALB/cByJ становив 1 × 10 5,2 cfu, що ідентично LD50 штаму бактерій дикого типу. 12 Евтаназію проводили знекровленням під анестезією ізофлураном.
Штам грипу A/Пуерто-Рико/8/34 (H1N1).
Вірусні запаси A/Пуерто-Рико/8/34 (H1N1) (P8) люб’язно надав Річард Веббі (Дитяча дослідницька лікарня Сент-Джуд) та приготував їх шляхом посіву зароджених курячих яєць. Алантоєву рідину, інфіковану вірусом, збирали і аліквоти заморожували при -80 ° C до використання. Титр вірусного запасу визначали за допомогою аналізу TCID50.
У дослідженні мишей BALB/cByJ вірусний запас розбавляли стерильним фізіологічним розчином, не містить ендотоксинів. Чотирьом дорослим самцям мишей BALB/cByJ на дозу (загальна кількість, n = 28) інокулювали інтраназально 25 мкл 10-кратних серійних розведень запасу, дози коливались від 1 × 10 1 до 1 × 10 7 TCID50 PR8. LD50 PR8 для мишей BALB/cByJ становив 1 × 10 3,5 TCID50.
У дослідженні мишей C57BL/6J мишей годували або звичайною дієтою (4,5% жиру; n = 10), або дієтою з високим вмістом жиру (60% жиру; n = 9) у віці від 6 до 34 тижнів. Потім мишей інокулювали 25 мкл аллантоїсної рідини, що містить 1 × 10 3 TCID50 PR8 (1/3 дози LD50 для мишей BALB/cByJ). Евтаназію проводили знекровленням під анестезією ізофлураном.
C. albicans (штам 10231).
C. albicans вирощували протягом ночі на агарі декстрози Сабуро. Для внутрішньовенного інокуляції мишей колонії суспендували в стерильному фізіологічному розчині без пірогену. Титр культури оцінювали за допомогою гемоцитометра, і суспензію розбавляли до досягнення приблизно 5 × 10 5 КОЕ в 0,2 мл. Фактичні інокульовані дози визначали згодом культурою серійних розведень інокуляту, висіваного на агар Сабуро Декстроза, і виявляли середню дозу 5,6 ± 0,6 × 10 5 КОЕ (n = 24). Для щеплення дорослим самцям мишей DBA/2J (n = 24) знеболювали ізофлуран і вводили внутрішньовенно через ретроорбітальний синус. Ретроорбітальний шлях застосовувався з двох причин: 1) ін’єкція виконується під загальним наркозом і, отже, не вимагає стримування тварин, і 2) оскільки синус великий по відношенню до вени, введення речовин цим шляхом надзвичайно легко виконати і забезпечує високу впевненість у тому, що ін'єктований матеріал потрапив у кровообіг, а не в периваскулярний простір. Дослідження було завершено за проектом через 5 днів після щеплення. Евтаназію проводили знекровленням під анестезією ізофлураном.
Статистика.
Описові заходи складалися із засобів та стандартної похибки засобів. Статистичний аналіз проводили з незалежними t-тестами із статистичною значимістю, встановленою на рівні 5%.
Результати
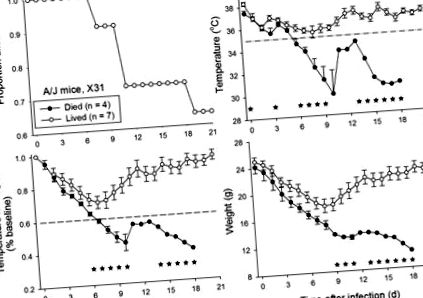
Мишам A/J (n = 11) інокулювали інтраназально діапазон доз штаму вірусу грипу X31 (1 × 10 1,65 - 1 × 10 5,65 TCID50; n = 2 - 3 на дозу). Серед цих мишей 63% (7 з 11) вижили через 21 день після зараження (рис. 1). Значення температури (T) і добутку температури та маси тіла (T × BW) мишей, які жили порівняно з померлими, показали стійке значне значення (P Рисунок 1). Використання порогового значення падіння температури в ядрі до рівня нижче 35 ° C на 7 день після зараження виявило б усіх 4 мишей, які врешті загинули, без помилкового виявлення мишей, які вижили. Для порівняння, зменшення T × BW до менш ніж 60% вихідних значень на 7 день після зараження виявило б 3 з 4 мишей, які врешті загинули, і неправильно виявило 1 з 7 мишей, які вижили.
Повні та нормальні миші C57BL/6J, інфіковані штамом вірусу грипу PR8. Мишей C57BL/6J годували або звичайною дієтою (4,5% жиру; n = 10), або дієтою з високим вмістом жиру (60% жиру; n = 9) у віці від 6 до 34 тижнів. Потім мишей інокулювали 25 мкл алантоїсної рідини, що містить 1 × 10 3 штаму вірусу грипу TCID50 PR8 (1/3 дози MLD50 для мишей BALB/cByJ). *, P Рисунок 4). Температура та T × BW були інформативними щодо диференціації мишей, які жили та загинули, тоді як вага тіла - ні (рис. 4). Зниження T × BW до 85% або менше вихідних значень на 1-й день після зараження виявило б усіх 9 мишей, які врешті загинули, і неправильно виявило 3 з 15 мишей, які вижили.
Декілька експериментів, які дали результати, проаналізовані тут, були попередніми дослідженнями визначення дози, що оцінювали результати серед мишей, які отримували різні дози того самого агента. Чисел, перевірених у кожній дозі в цих дослідженнях, було недостатньо для порівняння між дозами. Однак, враховуючи, що інфекційна доза, безсумнівно, є найкращим предиктором смерті після зараження інфекцією, ідеальним тестом для перевірки цих виробників буде подальше дослідження з використанням дози LD50. Такі дослідження були б важливими для перевірки як визначення дози, так і маркерів кінцевих точок, якщо модель була призначена для багаторазового використання (наприклад, для скринінгу терапевтичних засобів).
Разом із попередньою роботою наші висновки підкреслюють важливість ретельного пристосування вибору маркерів кінцевих точок до конкретної експериментальної моделі та перевірки цих маркерів для цієї моделі. Визначення гуманних кінцевих точок для лабораторних тварин стає все більш важливим для IACUC та регулюючих органів. Це дослідження та наша попередня робота 11 надають просту стратегію для ідентифікації маркерів можливої смерті у мишей. У світлі наших даних, ми пропонуємо дослідникам, які проводять подібні дослідження з використанням інших моделей мишей інфекційних хвороб, оцінювати наш підхід у своїх поточних дослідженнях та повідомляти свої висновки науковому співтовариству.
Подяка
Ця робота була частково підтримана грантами NIH K26-RR17543 та R01-NS40220 та Медичною школою Університету Південного Іллінойсу. Ми дякуємо Крістін Босграф та Лізі Кокс за надану чудову технічну допомогу.
- Інфекційні служби Тампа загальної лікарні
- Теорії змови голови групи HNA "Раптова смерть"; Дипломат
- Невинний тато "згвалтували та побили до смерті" пильними батьками після того, як 10-річна дівчина "збрехала", що він
- Схуднути, щоб запобігти серцевим захворюванням
- Втрачайте вагу, зменшуйте стрес та знижуйте ризик захворювання за допомогою цих 6 звичок Fox News