Малоінвазивна хірургія підслизових доброякісних пухлин стравоходу: показання, передопераційні дослідження, відбір пацієнтів та клінічні результати
Емануеле Асті, Стефано Сібоні, Андреа Сіроні, Лавінія Барб'єрі, Луїджі Бонавіна
Внески: (I) Концепція та дизайн: L Barbieri, E Asti, S Siboni; (II) Адміністративна підтримка: відсутні; (III) Надання навчальних матеріалів або пацієнтів: Е Асті, С Сібоні, Л. Бонавіна; (IV) Збір та збір даних: E Asti, S Siboni, L Bonavina; (V) Аналіз та інтерпретація даних: L Bonavina, E Asti; (VI) Написання рукописів: Усі автори; (VII) Остаточне затвердження рукопису: Усі автори.
Анотація: Доброякісні підслизові пухлини стравоходу рідкісні і найчастіше представлені лейоміомами. Пацієнтів з пухлинами, які мають симптоматичний характер або швидко зростають і потребують диференціальної діагностики із злоякісними пухлинами, слід видаляти, бажано за допомогою позаслизової енуклеації, за допомогою торакоскопічного або лапароскопічного підходу. Ці мінімально інвазивні методи були продемонстровані як безпечні та ефективні, і призводять до мінімальних післяопераційних болів, короткого перебування в лікарні та клінічних результатів, еквівалентних відкритому підходу.
Ключові слова: Лейоміома; ендоскопічна ультрасонографія (EUS); торакоскопія; лапароскопія; енуклеація
Отримано: 16 травня 2019 р .; Прийнято: 25 червня 2019 р .; Опубліковано: 29 серпня 2019 року.
Вступ
Підслизові доброякісні пухлини стравоходу рідкісні порівняно зі злоякісними пухлинами. Більш пізні дані свідчать про збільшення поширеності цих уражень, що, ймовірно, відображає поліпшення діагностики та скринінгу (1). Доброякісні маси стравоходу можна класифікувати як інтрамуральні [лейоміома, шлунково-кишкова стромальна пухлина (GIST), шваннома], інтралюмінальні (фіброзно-судинні поліпи, ліпома, гемангіома, зернисто-клітинна пухлина) та екстраезофагеальні (розмноження та кісти).
Лейоміома, найбільш часто зустрічається підслизова пухлина стравоходу, - це мезенхімальне новоутворення, яке зазвичай походить від muscularis propria, що складається з пучків веретенових клітин з рідкісними мітозами. Найпоширенішим анатомічним розташуванням є середня або нижня третина стравоходу. Маса пухлини коливається від 0,5 до 5 см у діаметрі і виглядає інкапсульованою з круглою або овальною морфологією. Очікується, що помітна деформація просвіту стравоходу відбуватиметься у пацієнтів з великими пухлинами у формі підкови та переважною формою внутрішньосвіткового росту. Як правило, імуногістохімічний аналіз позитивний для актину та дезміну гладкої мускулатури.
Лейоміоми, як правило, протікають безсимптомно через повільний ріст і здатність просвіту стравоходу адаптуватися до зовнішньої компресії. Найпоширенішим симптомом є дисфагія, особливо коли ріст пухлини внутрішньосвітловий. Іншими симптомами, спричиненими внутрішньосвітлевим ростом, можуть бути дискомфорт під грудьми, біль у грудях, регургітація та печія (2). Ці неспецифічні симптоми можуть виникати внаслідок асоційованого стану (грижа перерви, гастроезофагеальна рефлюксна хвороба). У пацієнтів із позаслизовим ростом маса може спричинити компресію дихальних шляхів або нижньої порожнистої вени (3). Ендолюмінальні кровотечі з великих виразкових лейоміом вкрай рідкісні. У таких пацієнтів слід радше розглядати діагноз ГІСТ.
Природна історія
Природна історія цих новоутворень сприятлива. Насправді малими та безсимптомними підслизовими масами можна керувати консервативно. Пацієнтам слід заспокоїтись щодо доброякісної природи пухлини, і може бути запропоновано ендоскопічне ультразвукове спостереження для виявлення будь-яких прогресивних змін у розмірі або формі пухлини. Зростання пухлини з часом є показником для резекції. Інші показання включають появу симптомів, виразку слизової, збільшення регіонарних вузлів та нерегулярність маси. Недавнє дослідження (4) підрахувало, що ріст лейоміоми під час спостереження становив близько 0,5 мм під час середнього спостереження довше 5 років.
Діагностика
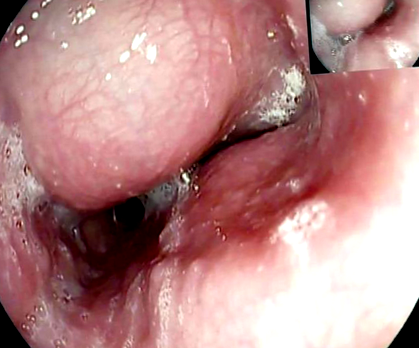
У більшості пацієнтів діагноз лейоміома є випадковим під час дослідження ковтання барію, ендоскопії верхніх відділів шлунково-кишкового тракту або комп’ютерної томографії (КТ) грудної клітки. Потрібна ретельна обробка, щоб спланувати найкращу терапевтичну стратегію. Ендоскопічна оцінка зазвичай виявляє опуклість просвіту стравоходу з неушкодженою слизовою оболонкою (рис. 1), що дозволяє плавно проходити через область. У більшості пацієнтів із підслизовою масою стравоходу слід не рекомендувати біопсію слизової оболонки (5). Типовими є рентгенологічні особливості лейоміоми при дослідженні ковтання барію (рис. 2). Комп’ютерна томографія грудної клітки особливо корисна у випадку гігантських лейоміом із позасвітковим ростом для виключення злоякісних новоутворень (рисунок 3). Лейоміома має однорідний та гіпоехогенний вигляд при ендоскопічній ультрасонографії (EUS), а аналіз шарів стінок дозволяє визначити місце походження маси. Аспіраційну біопсію тонкої голки можна провести, якщо є підозра на ГІСТ або злоякісне утворення. Позитронно-емісійна томографія (ПЕТ) за допомогою фтор-18-фторидооксиглюкози може іноді викликати хибнопозитивний тест, як і в інших доброякісних станах, особливо у пацієнтів із CD34-негативними ураженнями (6) (рис.4).
Хоча позаслизові кісти надзвичайно рідкісні, диференціальний діагноз слід розглядати у пацієнтів з підслизовими пухлинами. Ці кісти мають змішаний ембріогенез і можуть бути вродженими (тобто бронхогенними, шлунковими, розмножувальними або інклюзійними), нейроентеричними або набутими (ретенційні кісти) (7). Близько 40% позаслизових кіст діагностується у пацієнтів у період з другої до четвертої декади (8), і більше третини пацієнтів безсимптомно проявляються (9). Найбільш поширена клінічна картина у дорослих складається з таких симптомів, як гастроезофагеальний рефлюкс, дисфагія та біль у епігастрії.
Трент
Традиційно відкрита резекція була стандартом лікування лейоміом стравоходу (5,10); останнім часом у спеціалізованих центрах дедалі частіше застосовують малоінвазивні методики (11,12). Через доброякісний характер пухлини та наявність порівняно легкого плану розщеплення, найпоширенішою хірургічною процедурою є мінімально інвазивна енуклеація та реконструкція м’язового шару за допомогою торакоскопічного або лапароскопічного підходу. Для лейоміом шлунково-стравохідного з’єднання збереження цілісності та функції сфінктера має першочергове значення, і необхідна особлива обережність для запобігання післяопераційному шлунково-стравохідному рефлюксу.
Техніка енуклеації лейоміоми
Незалежно від шляху підходу, процедура складається з міотомії, розширеної над і під лейоміомою з максимальним збереженням м’язових волокон. Інтраопераційна ендоскопія забезпечує накачування повітря та перепросвічування під час процедури та може підвищити безпеку (13). Зовнішня тяга, накладена трансфіксуючим швом, може полегшити ідентифікацію плану розщеплення зі слизової та прогресуючу енуклеацію маси. Це дозволяє уникнути ефекту фрагментації пухлини шляхом прямого захоплення. Альтернативний метод полягає у надуванні ендоскопічного балона та виштовхуванні пухлини назовні для полегшення енуклеації. Після видалення пухлини необхідно ретельно оглянути слизову, щоб забезпечити цілісність, а поздовжні м’язові волокна апроксимують із перерваними швами. Повідомлялося про симптоматичні псевдодивертикули у випадку процедур енуклеації, які не супроводжувались зшиванням залишкових країв м’язів (5).
Протягом останніх трьох десятиліть малоінвазивна хірургія показала явні переваги перед відкритим підходом. Торакоскопічна, лапароскопічна, ендоскопічна та гібридна процедури майже замінили відкриту хірургію в лікарнях, що направляються в лікарню. Лапароскопічна енуклеація є кращою для пухлин дистального відділу стравоходу, оскільки вона забезпечує ідеальне оголення нижнього середостіння та дозволяє проводити антирефлюксну репарацію (фундаментальна терапія Дор або Тупе) (рис. 5). Потрібно п’ять портів, і критичні кроки операції можна виконати за допомогою ендоскопічної допомоги.
У пацієнтів з гігантськими пухлинами, що випадають через шлунково-стравохідний зв’язок, необхідний трансгастральний підхід (14). Передопераційне ендоскопічне відсікання дистального кінчика пухлини та інтраопераційна ендоскопічна допомога полегшують процедуру. Ендокліпи легко ідентифікувати за допомогою невеликої передньої гастротомії, а маса екстеріоризується. Висічення лейоміоми проводять за допомогою лінійного ендосталера, приділяючи увагу запобіганню закупорки виходу стравоходу. Після ручного або степлерованого закриття розрізу гастротомії виконується передня фундоплікація для запобігання гастроезофагеального рефлюксу (рис. 6).
Ендоскопічна підслизова дисекція за допомогою ретрофлексованої відео-ендоскопії також виявилася безпечною та ефективною у пацієнтів з лейоміомами кардії (12,15). Пацієнту під загальним наркозом та в положенні лежачи на спині розведений адреналін вводять голкою для склеротерапії в підслизову площину для підняття слизової. Переважним є інсуфлятор CO2. Розріз слизової оболонки, що перекриває масу, бажано проводити з розмахом у ретрофлексному вигляді, починаючи з нижньої межі ураження. Використовується електрохірургічний ніж (IT-ніж 2, Olympus) та гачковий ніж. Краї слизової закриваються за допомогою 3-5 металевих затискачів. В кінці процедури пухлина забирається за допомогою пластикового ендо-пакета і витягується через рот. Пневмоперитонеум за відсутності перфорації є потенційним ускладненням процедури і обумовлений фільтрацією повітря/СО2 через тонку задню стінку шлунка в кардії, не покритій шаром серози. Це ускладнення можна лікувати консервативно або може вимагати пришкірного дренажу біля ліжок (16).
Торакоскопічна енуклеація призначена для лейоміом верхньої та середньої третини стравоходу. 3-портовий торакоскопічний підхід у положенні лежачого або напівлежачого пролежня забезпечує хорошу експозицію по всій довжині грудного відділу стравоходу (рисунок 7), одночасно значно покращуючи глобальну доставку кисню та зменшуючи легеневий шунт (17,18). Після розрізу середостінної плеври лейоміома ідентифікується та енуклеюється, як при лапароскопічному підході, і м’язовий шар ретельно апроксимується. Для лейоміом, розташованих у верхньому відділі грудного відділу стравоходу, для кращого опромінення може знадобитися поділ дуги язикової вени за допомогою гемоблокувальних затискачів або лінійного степлера.
Рідше у пацієнтів з дифузним лейоміоматозом шлунково-стравохідного з’єднання або гігантськими масами, які не підлягають енуклеації через великі інтраопераційні травми слизової оболонки або неможливість реапроксимації залишкових країв м’язів, може бути показана трансторакальна або трансхіатальна відео-допоміжна езофагектомія та реконструкція шлункового каналу ).
Лікування позаслизових кіст
Пацієнти, які протікають без симптомів, можуть бути обстежені за допомогою EUS або КТ. І навпаки, наявність дисфагії, респіраторні симптоми, втрата ваги, збільшення розміру кісти та підозра на злоякісність є показаннями до хірургічної терапії. Аспірація кісти була запропонована у пацієнтів, непридатних для хірургічного втручання, але торакоскопічна або лапароскопічна резекція залишається найкращим напрямком у експертних центрах (20). Основні положення хірургічної терапії ті самі, що описані для лейоміоми, але зшивання є кращим у разі щільних спайок зі стінкою стравоходу.
Результати енуклеації лейоміоми
У нашому закладі протягом 2002–2017 рр. 35 пацієнтів вважались придатними для хірургічного втручання та перенесли енуклеацію лейоміоми за допомогою торакоскопії (n = 15), лапароскопії (n = 15) та ендоскопії (n = 5). У цій когорті пацієнтів, які включають осіб з гігантськими (до 12 см) пухлинами, не було необхідності переходити на відкриту хірургічну операцію та езофагектомії. Загальний рівень захворюваності становив 14,3%, і смертності не було. Біль у післяопераційній рані за необхідності лікували парацетамолом та/або кеторолаком. Звичайне дослідження ковтання гастрографіну проводили в післяопераційний день 1. Пацієнтам дозволяли пити і дотримуватися м’якої дієти до першого наступного візиту через місяць. У всіх пацієнтів гістопатологія підтвердила діагноз доброякісної лейоміоми. Середній діаметр маси становив 7,5 см. Імуногістохімія дала позитивний результат для актину та дезміну гладком’язових м’язів, а негативний - для CD117 та CD34. Медіана спостереження становила 49 місяців, і за всіма пацієнтами спостерігали щонайменше 1 рік. Жодних рецидивів лейоміом при ендоскопії та/або дослідженні ковтання барію не зафіксовано (рисунок 8). Під час останнього спостереження бали SF-36 залишились незмінними порівняно з базовим рівнем. Однак симптоми рефлюксу та використання ІПП частіше виникали після ендоскопічного треденту (12).
Висновки
Підхід до підслизових доброякісних пухлин стравоходу суттєво змінився порівняно з попередніми десятиліттями. Поява малоінвазивних методик, ймовірно, знизило поріг для хірургічного втручання через меншу захворюваність та більший комфорт пацієнта. Сьогодні мінімально інвазивна енуклеація лейоміоми повинна проводитися відповідно до локалізації пухлини та морфології. Лапароскопія та торакоскопія повинні представляти початковий підхід навіть у пацієнтів, які мають великі маси у несприятливих місцях. Порівняно з ендоскопічним підходом, лапароскопічна енуклеація лейоміоми може усунути залежність від інгібіторів протонної помпи. У майбутньому ендоскопія третього простору, швидше за все, відіграватиме більш важливу роль у пацієнтів з підслизовими пухлинами.
Подяка
Робота за підтримки AIRES (Associazione Italiana Ricerca ESofago).
Виноска
Конфлікт інтересів: Автори не мають заявляти про конфлікт інтересів.
Етична заява: Автори несуть відповідальність за всі аспекти роботи, забезпечуючи належне дослідження та вирішення питань, що стосуються точності або цілісності будь-якої частини роботи.
- Малоінвазивна (лапароскопічна) операція з резекції печінки
- Харчування в кардіохірургії дорослих Передопераційна оцінка, лікування в післяопераційний період
- Зменшення періодичного ризику планової судинної хірургії за допомогою короткого передопераційного обмеження дієти
- Малоінвазивна процедура виявляє перспективність у боротьбі з ожирінням
- Мінімально інвазивне лікування ожиріння Перлини, підводні камені та досвід роботи в Карибському басейні -